小麦酚酸提取工艺优化及产区与品种差异对酚酸含量的影响
2019-12-04王淑芳俞明正徐剑宏史建荣
王淑芳,董 飞,王 刚,俞明正,徐剑宏,史建荣*
(江苏省食品质量安全重点实验室—省部共建国家重点实验室培育基地,农业农村部农产品质量安全控制技术与标准重点实验室,农业农村部农产品质量安全风险评估实验室(南京),江苏省现代粮食流通与安全协同创新中心,江苏省农业科学院农产品质量安全与营养研究所,江苏 南京 210014)
酚类是一类含有活跃酚羟基的植物次生代谢产物,包括酚酸、黄酮和花色苷类,具有抗氧化[1]、抗癌、抗衰老[2]等生理作用。在禾谷类籽粒中,酚酸是主要的酚类物质[1,3],以游离和结合形式存在。酚酸主要有没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、丁香酸、对香豆酸、阿魏酸和芥子酸等[4-5]。早期以福林-酚法研究谷物中的总酚类物质含量[6],随着研究的不断深入,黄酮、酚酸和花色苷类物质被分别测定[7]。然而,酚酸在各种植物源食品中的存在形式不同,因此,适合的提取和测定方法对深入研究谷物籽粒中的酚类物质具有重要意义。
目前,植物食品中酚酸含量的测定主要采用高效液相色谱(high performance liquid chromatography,HPLC)法。Chen Zhijie等[8]采用HPLC法定量了小麦苗中酚酸的含量,孙元琳等[9]用HPLC定量了黑麦麸皮中酚酸的含量。因酚酸结构相似,色谱条件显著影响酚酸组分的分离,故近年来有学者引入高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用法定量酚酸[10-11]。通过质谱定量离子的选择,避免了因分离度不理想而影响准确定量的问题。然而,质谱鉴定和定量对样品纯度要求较高,在前期制样过程中,需要进行初步纯化,尽量去除结构近似的杂质,有助于定量离子的选择。因此,合适的提取和前期纯化方法有助于HPLC-MS法准确定量酚酸。常用的酚酸提取溶剂有甲醇、乙醇和丙酮[12],在水果和蔬菜酚酸提取中,使用乙醇为提取溶剂的较多,而在谷物酚酸提取中,甲醇较为常用。李春玲[12]比较了甲醇、乙醇和丙酮对景天中酚酸提取率的影响,结果显示甲醇对酚酸的提取能力更好。但是在提取以结合酚酸为主,且淀粉含量高的样品中的酚酸时,需先用碱液水解。对于结合酚酸含量高的谷物样品,研究碱使用浓度和提取液料比有利于充分提取酚酸。前期研究发现,用碱水解小麦籽粒样品后,水解液呈凝胶状,酚酸分散其中难以分离,用常规方法难以提取,因而需用有机溶剂萃取的方法才能有效提取酚酸[13-14]。乙酸乙酯是较为有效的萃取溶剂,但对于不同的样品,溶剂萃取时间和次数需进一步探讨。
目前,江淮麦区小麦主栽品种主要有江苏省农科院育成的宁麦系列、烟农19、以及淮麦系列,黄淮麦区主栽品种有河南的百农207、新麦26,山东的济麦22等,北方春麦区主栽品种有黑龙江的龙麦35和内蒙古的永良4号。由于受基因型[15]、气候条件[16]、土壤状况[17]等自然条件的影响,我国不同产区生产的小麦品质存在极大差异[18]。同时,同一产区不同小麦品种营养和功能品质有显著差异。因此,研究小麦主要产区主栽品种酚酸含量的差异具有重要的意义。
本研究采用NaOH溶液水解小麦籽粒后,用乙酸乙酯萃取的方法,探讨水解及萃取条件对小麦籽粒酚酸提取量的影响,并优化提取条件;然后用HPLC-MS方法定量我国小麦主要产区主栽品种酚酸含量的差异。为我国小麦品种选育、品质区划及小麦的综合利用提供科学依据和数据支撑。
1 材料与方法
1.1 材料与试剂
小麦品种为:江淮麦区:宁麦系列、淮麦系类、扬麦系类等;黄淮麦区:百农207、矮抗58、新麦26等;北方麦区:龙麦35、津强7号、永良4号等,均为2017年收获,详见表1。
酚酸标准品:没食子酸(G7384-100G)、原儿茶酸(08992-50MG)、4-羟基苯甲酸(240141-100G)、香草酸(94770-10G)、咖啡酸(C0625-2G)、丁香酸(S6881-5G)、对香豆酸(C9008-1G)、阿魏酸(128708-5G)和芥子酸(D7927-1G) 美国Sigma公司;乙腈、甲醇、甲酸、NaOH、乙酸乙酯 上海安谱生物科技有限公司。
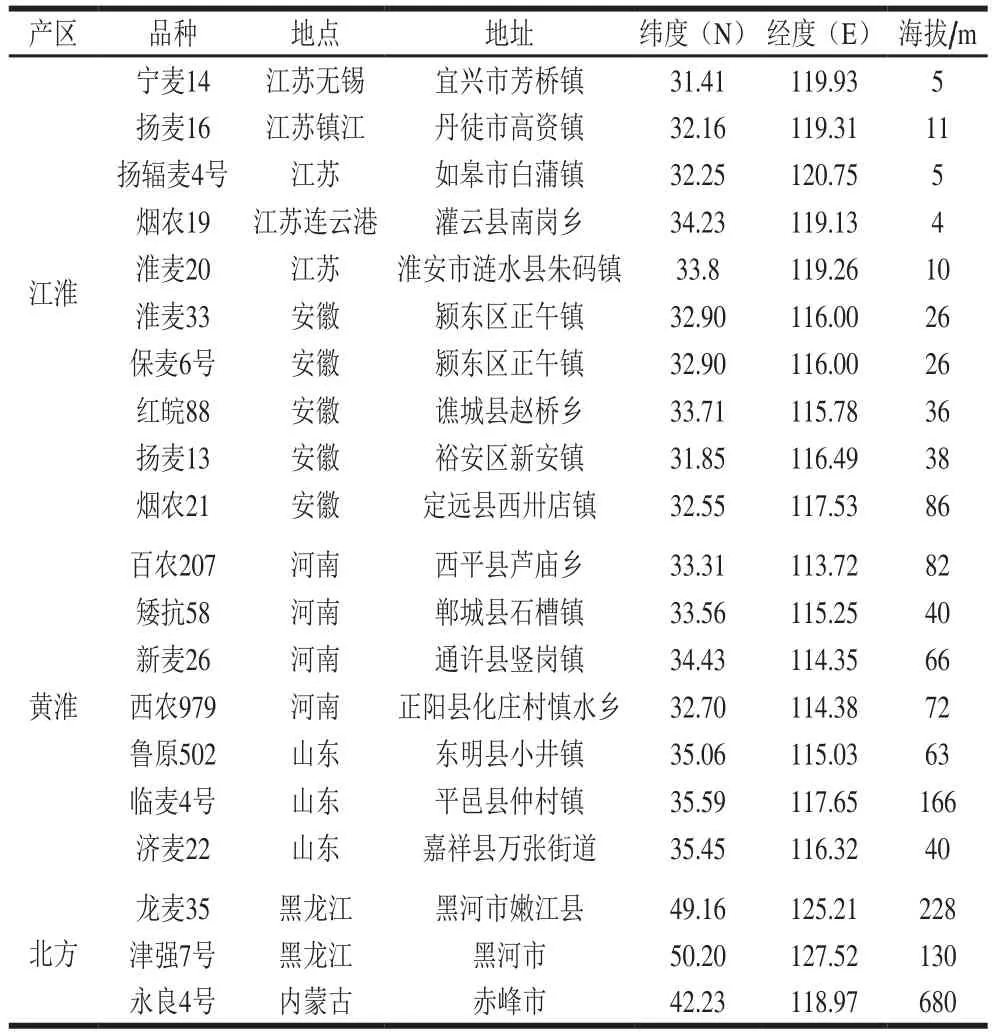
表1 不同产地和品种小麦采样点Table 1 Wheat sampling points from different growing areas and varieties
1.2 仪器与设备
ZHSY-50WS型水浴往复恒温振荡培养箱 上海知楚仪器有限公司;5810R型离心机 Eppendorf公司;WH-3微型旋涡混合仪 上海沪西分析仪器厂;AB6500 HPLC-MS 美国AB SCIEX公司;RE-2000A型旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 NaOH浓度对酚酸提取量的影响
小麦籽粒经挑选除杂后,打粉过0.425 mm筛。分别用0.5、1.0、1.5、2.0、2.5、3.0 mol/L的NaOH溶液恒温振荡水解3 h(30 ℃,150 r/min),液料比为15∶1(mL/g);然后用1 倍体积的乙酸乙酯在30 ℃、150 r/min萃取2 次,每次15 min,合并萃取液旋蒸,用10 mL 50%的甲醇溶液复溶,过0.22 µm的滤膜后测定酚酸含量。
1.3.2 液料比对酚酸提取量的影响
过0.425 mm筛的样品用液料比5∶1、10∶1、15∶1、20∶1(mL/g)的2.0 mol/L NaOH溶液恒温振荡水解3 h(30 ℃,150 r/min),然后用1 倍体积的乙酸乙酯在30 ℃、150 r/min萃取2 次,每次15 min,合并萃取液旋蒸,用10 mL 50%的甲醇溶液复溶,过0.22 µm的滤膜后测定酚酸含量。
1.3.3 乙酸乙酯萃取时间对酚酸提取量的影响
过0.425 mm筛的样品用液料比15∶1(mL/g)的2.0 mol/L NaOH溶液恒温振荡水解3 h(30 ℃,150 r/min),然后用1倍体积的乙酸乙酯在30 ℃、150 r/min振荡2 次,每次萃取时间分别为5、10、15、20 min,合并两次萃取液旋蒸,用10 mL 50%的甲醇溶液复溶,过0.22 µm的滤膜后测定酚酸含量。
1.3.4 萃取次数对酚酸提取量的影响
过0.425 mm筛的样品用液料比为15∶1(mL/g)的2.0 mol/L NaOH溶液恒温振荡水解3 h(30 ℃,150 r/min),然后用1 倍体积的乙酸乙酯分别在30 ℃、150 r/min振荡萃取1、2、3 次,每次萃取时间为15 min,合并萃取液旋蒸,用10 mL 50%的甲醇溶液复溶,过0.22 µm的滤膜后-20 ℃保存待测。
1.3.5 提取条件优化
在单因素试验的基础上,以NaOH浓度、液料比和乙酸乙酯萃取时间为因素,以酚酸提取量为响应值做响应面优化试验。采用Design-Expert 8.0.6统计软件对响应面试验数据进行线性回归和方差分析,优化出最适条件组合。
1.3.6 测定指标及方法
1.3.6.1 酚酸提取
在Chen Zhijie等[13]的方法上改进。准确称取2.00 g完全通过0.425 mm孔筛的小麦样品于250 mL三角瓶中,按照本实验设置的体积质量比和不同浓度的NaOH溶液水解样品,水解结束后采用1 mol/L盐酸调节水解液pH值在1.5~2.0之间;然后取1 倍体积的乙酸乙酯与水解液充分混合萃取不同时间,4 ℃、10 000 r/min离心5 min,取上层乙酸乙酯层,重复此操作0~2 次,合并所有乙酸乙酯层于40 ℃条件下旋转蒸干,残渣采用10 mL 50%的甲醇溶液复溶,过0.22 µm的滤膜后测定酚酸含量。
1.3.6.2 HPLC条件
分别取2 μL上述提取液采用HPLC-MS进行分析:Agilent XDB-C18(3.5 µm×2.1 mm,150 mm)色谱柱,流速为0.5 mL/min,流动相A溶液为含1%甲酸的水溶液,B溶剂为含1%甲酸的乙腈溶液;流动相洗脱程序:0~5 min,流动相A由90%~60%;流动相B从10%~40%;5~12 min,流动相A从60%~10%;流动相B从40%~90%;12~15 min,流动相A从10%~90%;流动相B从90%~10%;柱温40 ℃。
1.3.6.3 质谱条件
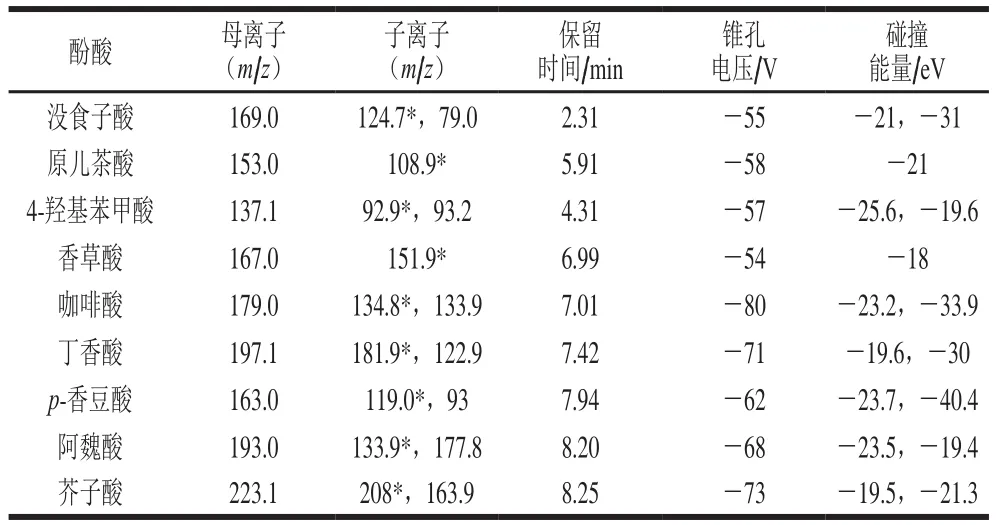
表2 酚酸质谱参数Table 2 Mass spectrometry parameters of phenolic acid
离子化模式为电喷雾电离负离子模式,多反应监测,离子源温度500 ℃,驻留时间100 ms,雾化气压50 psi,辅助气压50 psi,喷雾电压-4 500 V,碰撞室射出电压6 V。质谱参数如表2所示。
1.3.6.4 酚酸标准曲线建立
建立9 种酚酸标准曲线,在相应的线性范围内,9 种酚酸在小麦基质中均线性良好,相关系数R2不低于0.99,见表3。

表3 酚酸标准曲线及检出限、定量限检测结果Table 3 Standard curves, LODs and LOQs of phenolic acids
1.3.6.5 酚酸含量计算公式
试样中酚酸含量按计算公式如下:

式中:X为试样中酚酸含量/(mg/kg);V为样品最终定容体积/mL;m为称样量/g;c为仪器测得试样溶液中酚酸质量浓度/(μg/mL)。
1.4 数据分析
响应面试验采用Design Expert 8.0.6软件设计,实验设置重复3~6 次(n≥3),以表示,实验数据采用SPSS 18.0软件Duncan多重比较法进行显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 小麦籽粒酚酸提取条件单因素试验
由图1A可以看出,用不同浓度的NaOH溶液水解显著影响小麦籽粒中酚酸的提取量。随着NaOH浓度的不断增加,酚酸提取量不断上升,在1.5 mol/L时达到最大;当NaOH浓度为3.0 mol/L时,酚酸含量降低。NaOH作为强碱,能水解小麦籽粒中酚酸与大分子之间的共价结合键[9,19],随着浓度的增加,水解能力增强,但是浓度过高时,可能对酚酸内部化学键具有破坏作用,导致酚酸降解。提取液料比能显著影响酚酸提取率,随着液料比的增大,酚酸提取量增加,在液料比为15∶1(mL/g)时达到1 047.3 mg/kg(图1B)。物质在特定溶剂中的溶解度是一定的,随着液料比的增加,溶解量不断增加,但是液料比达到一定值后,酚酸几乎被全部水解溶出,提取率达到动态平衡状态。因此,本研究中液料比20∶1(mL/g)时不再增加酚酸提取量。在以结合酚为主的样品中,结合酚酸被水解后需乙酸乙酯等有机溶剂萃取才能获得较纯的提取物以便用HPLC-MS检测[13,20]。本研究结果显示,乙酸乙酯萃取时间对小麦籽粒酚酸提取量有显著影响(图1C)。当提取时间大于15 min时萃取量达到最大,相比10 min萃取量增加45.02%。在设定乙酸乙酯为1 倍体积添加量和萃取15 min的情况下,萃取2 次以上对酚酸提取量无显著影响(图1D),因此后续采用萃取次数2 次,进行NaOH浓度、液料比和乙酸乙酯萃取时间的优化实验。
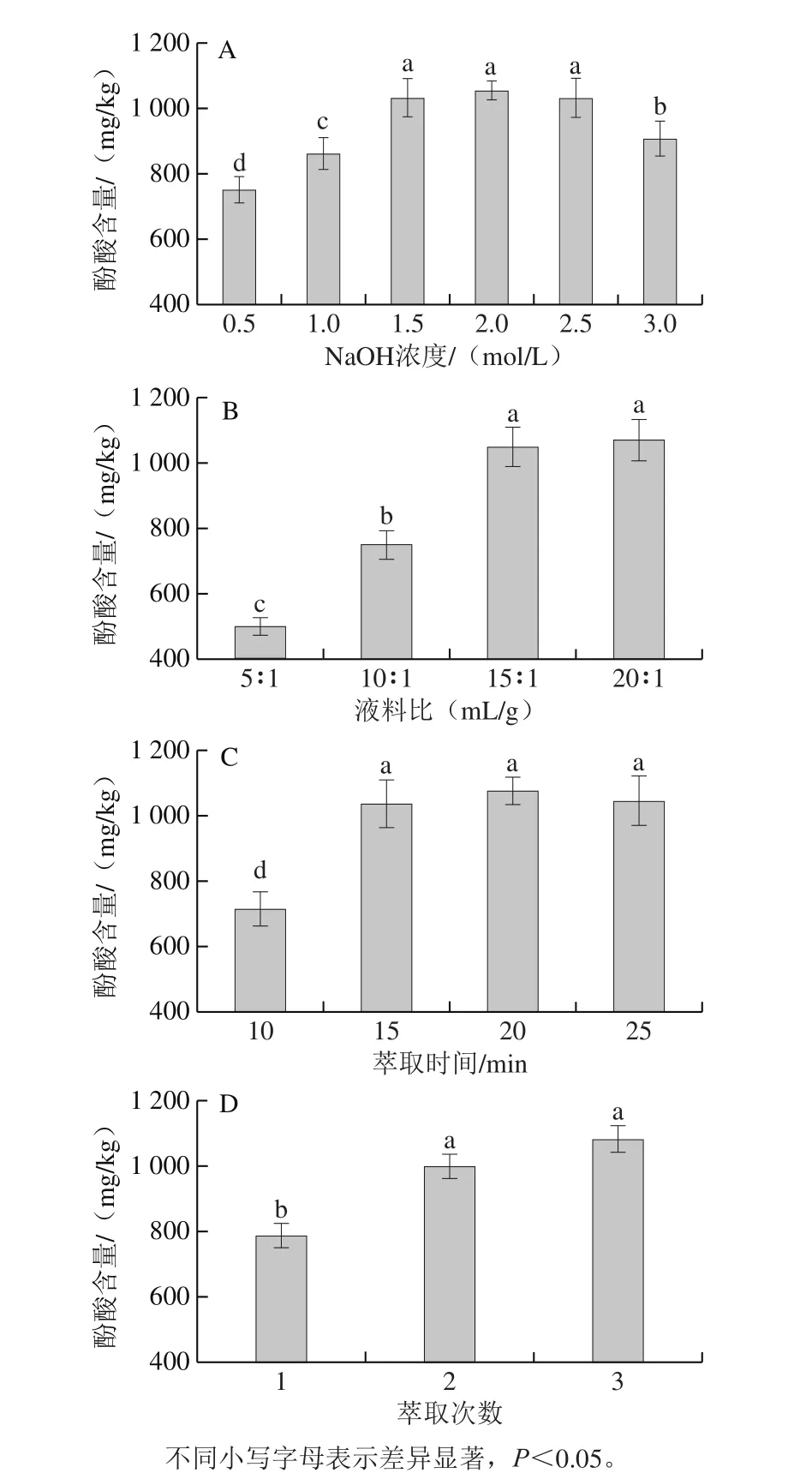
图1 NaOH浓度(A)、液料比(B)、萃取时间(C)和萃取次数(D)对酚酸提取量的影响Fig. 1 Effect of NaOH concentration (A), liquid-to-material ratio (B),extraction time (C) and number of extraction cycles (D) on the extraction efficiency of phenolic acid
2.2 响应面优化试验
在单因素试验的基础上,选用3因素3水平Box-Behnken试验设计对小麦籽粒中酚酸提取工艺进行优化,试验方案及结果见表4。运用Design Expert软件,对表4中数据进行Forward模式多元二次回归拟合,得到小麦籽粒中酚酸提取量预测值的二次多项回归方程:


表4 Box-Behnken试验设计与结果Table 4 Box-Behnken design with experimental and predicted values of phenolic acid
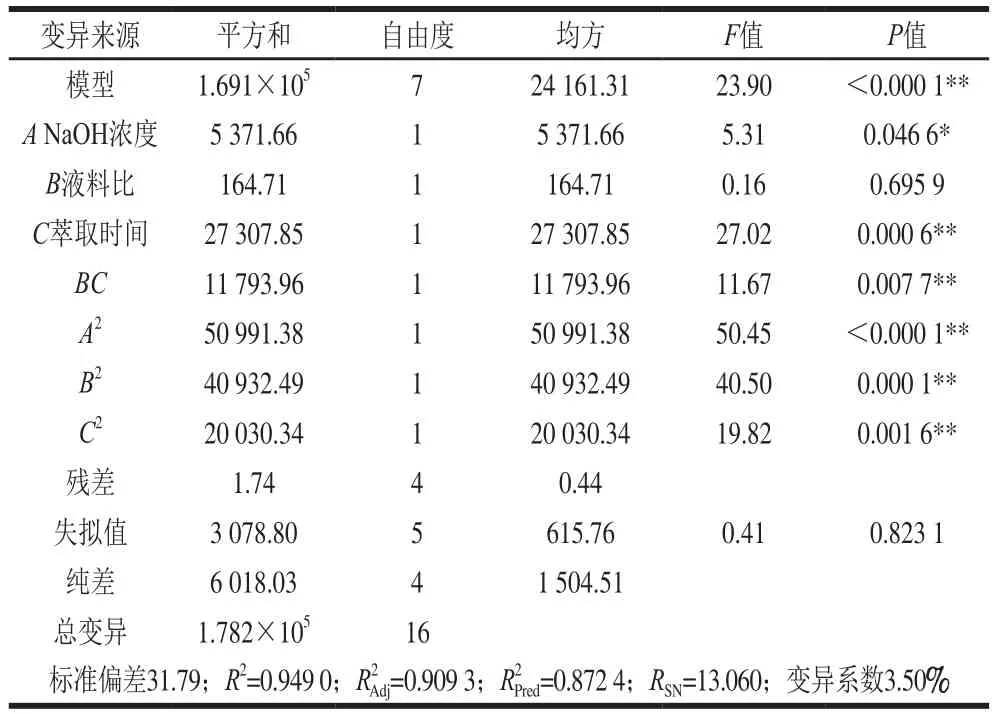
表5 回归模型方差分析Table 5 Analyses of variance for the effect of extraction conditions on the the extraction efficiency of phenolic acid
液料比和乙酸乙酯萃取时间之间有显著的交互作用(P<0.05),由图2可知,当液料比为10∶1(mL/g)时,萃取时间延长酚酸提取量先缓慢升高后有所降低;当液料比为20∶1(mL/g)时,随着萃取时间的延长酚酸提取先迅速增加后缓慢下降,且液料比越大,酚酸提取量升高的速率越快。

图2 液料比和乙酸乙酯萃取时间交互作用对酚酸提取量的影响Fig. 2 Response surface plot showing the interactive effects of liquid-tosolid ratio and extract time on the extraction efficiency of phenolic acid
由回归方程可得,NaOH水解-乙酸乙酯萃取方法提取小麦籽粒酚酸的最佳条件为NaOH浓度1.56 mol/L、液料比15.53∶1(mL/g)、萃取时间17.33 min、萃取2 次;模型预测值为1 053 mg/kg。便于操作,选取NaOH浓度1.56 mol/L、液料比15.5∶1(mL/g)、萃取时间17 min,在此提取条件下,小麦籽粒中酚酸提取量达到1 055.99 mg/kg,且显著高于随机组合试验结果(表6);说明本试验所拟合的二次多项式模型可预测提取条件和提取量之间的关系。

表6 响应面验证实验Table 6 Verification of optimal combination of extraction conditions
2.3 不同产区和品种小麦中主要酚酸组成和含量
由表7可以看出,小麦中的主要酚酸为阿魏酸,占总酚酸的73.07%~89.01%,其次为芥子酸。没食子酸只有在江淮麦区的保麦6号中含有,其他地区的小麦中都不含有。咖啡酸主要存在于江淮麦区和北方麦区的小麦中。研究表明[21],不同种类谷物间酚类物质含量差异较大,同种类谷物不同品种间酚类物质含量差异也较大。江淮麦区宁麦14中总酚酸含量最高,达1 001.12 mg/kg,和该产区的烟农19、淮麦33有显著性差异;黄淮麦区的品种新麦26中总酚酸含量最高,为1 016.03 mg/kg,和该产区的济麦22、百农207有显著性差异。Curvas等[22]比较了6 种小麦总酚含量,变幅为133.25~173.48 mg/kg。由此可见,谷物酚类物质含量主要受其种类和品种决定[23-24]。生长环境或产地的不同也会造成谷物多酚含量的较大差异。不同种类谷物的酚酸组成及含量差异也较大。Lin等[25]研究发现,美国6 种小麦中,阿魏酸、对香豆酸、丁香酸、香草酸、咖啡酸等5 种酚酸平均含量变异系数分别为19.10%、18.54%、24.42%、21.83%和32.38%。此外,提取或制备方法也对谷物酚酸构成及含量造成较大差异[26-27]。在本研究中,小麦采自中国江淮、黄淮和北方主要的小麦产区,产自海拔低的小麦品种宁麦14、扬麦16、扬辐麦4号,产自高海拔的小麦品种龙麦35、津强7号永良4号中咖啡酸含量较高,暗示咖啡酸可能与抵御极端环境有关[28]。北方小麦中原儿茶酸和丁香酸含量高于江淮和黄淮产区小麦,而阿魏酸的含量相对较低。说明日照时间长和昼夜温差大有助于原儿茶酸和丁香酸的累积[29]。

表7 不同产区和品种小麦中主要酚酸组成和含量Table 7 Main phenolic acid compositions and contents of different wheat varieties grown in different areas mg/kg
3 结 论
本研究经响应面优化获得NaOH水解-乙酸乙酯萃取一步法提取小麦籽粒中酚酸的条件为:NaOH浓度1.56 mol/L、液料比15.53∶1(mL/g)、萃取时间17.33 min、萃取2 次。以便操作,选取NaOH浓度1.56 mol/L、液料比15.5∶1(mL/g)、萃取时间17 min。在此提取条件下,小麦籽粒中酚酸提取量达到1 055.99 mg/kg。黄淮麦区的新麦26中总酚酸含量最高;阿魏酸为小麦中的主要酚酸,占总酚酸的73.07%~89.10%。不同产区小麦中酚酸的组成和含量差异较大,北方小麦中原儿茶酸、丁香酸和咖啡酸容易积累,而阿魏酸含量较江淮、黄淮区小麦低。本研究结果为我国主要产区小麦功能品质提供了重要参考。
