蛹虫草新型黄色素结构的初步鉴定及响应面优化提取工艺
2019-12-04唐鸿标陈楚欣林俊芳娄海伟叶志伟郭丽琼
唐鸿标,陈楚欣,林俊芳,*,娄海伟,叶志伟,郭丽琼,*
(1.华南农业大学食品学院,广东 广州 510642;2.广东省微生态制剂工程技术研究中心,广东 广州 510642)
蛹虫草(Cordyceps militaris),属子囊菌门(Ascomycota)昆虫寄生真菌[1],在我国被广泛用作民间医药或功能性食品[2]。蛹虫草子实体的活性成分含量高,如虫草多糖、总氨基酸、腺苷、虫草素等,因此常被用作冬虫夏草的替代品[3-4]。蛹虫草具有多种药理功能,如抗药性、炎症、抑制肿瘤和癌细胞生长[5]、增强动物和人的免疫力[6]、抗衰老、抗氧化[7-8]、抗凝血、降血糖[9-10]等。
在传统人工培养过程中,光照被用于刺激蛹虫草原基的形成和子实体的分化[11-12]。在固体培养基发酵培养条件下,当暴露于充足光照下,菌丝的颜色将从白色变为黄色[13-14]。随着光照培养的继续进行,蛹虫草子实体继续分化,虫草色素持续积累[15-16]。在光合作用植物、藻类和大型真菌的生长过程中,各种色素在协调生物体的正常发育和生长方面发挥着各种作用[17]。如叶绿素吸收光能并将其转化为化学能,为细胞生长提供能量[18];类胡萝卜素淬灭由光产生的氧自由基并保护细胞组织[19-20]。因此,为了研究蛹虫草黄色素在蛹虫草发育过程中的重要作用,必须先对蛹虫草黄色素的种类进行鉴定及归类。
付鸣佳[21]在蛹虫草中发现类胡萝卜素。有研究在蛹虫草中发现了玉米黄素[22]和叶黄素[23],并成功鉴定出4 种新型的水溶性北虫草黄素[24]。除了蛹虫草黄色素,多种虫草属真菌也都各具有色素。在双棱孢虫草(Cordyceps bifusispora)中发现一种新型黄色素[25],从冬虫夏草(Ophiocordyceps sinensis)的发酵液中分离出黑色素[26],单侧虫草(Cordyceps unilateralis BCC 1869)中发现了萘醌[27]。
本实验通过高效液相色谱(high performance liquid chromatography,HPLC)法对蛹虫草黄色素进行分离纯化,并结合质谱法、紫外-可见光谱法、傅里叶变换红外(Fourier transform infrared,FTIR)光谱法对纯化素色进行结构鉴定。同时,采用响应面法对蛹虫草黄色素提取工艺进行优化,为其日后的生产和综合开发利用提供依据。
1 材料与方法
1.1 材料与试剂
蛹虫草(C. militaris CM 19)保藏于华南农业大学食品学院生物炼制实验室;CM 19子实体购买自广东省江门市鸿豪生物科技有限公司。
甲酸、乙腈均为色谱纯,其他提取用有机溶剂均为分析纯,购自成硕化学试剂公司。
1.2 仪器与设备
An UV2310II紫外分光光度计 中国杭州奥盛仪器有限公司;RV8旋转蒸发仪 德国IKA公司;FD-1D-50冷冻干燥机 北京博医康实验仪器有限公司;Synapt G2-Si液相色谱-质谱联用仪 美国Waters公司;LC-2030 HPLC仪 日本岛津公司;Vertex 70 FTIR光谱仪德国Bruker公司。
1.3 方法
1.3.1 蛹虫草新型黄色素种类鉴定
1.3.1.1 提取溶剂的确定
蛹虫草子实体经冷冻干燥、粉碎、过60 目筛备用。取子实体粉末1.0 g,加入20.0 mL不同溶剂(丙酮、乙醚、石油醚、水、甲醇、乙醇、50%甲醇和50%乙醇),充分振荡2 min,室温浸提30 min,8 000×g离心10 min,取上清液观察。
1.3.1.2 黄色素提取液的分离纯化
样品的制备:取1.3.1.1节中50%乙醇提取液,过0.22 μm微孔滤膜后,供HPLC分析。
HPLC检测条件:GL Inertsil C18ODS-SP色谱柱(4.6 mm×250 mm,5 μm),柱温40 ℃,流速1 mL/min,进样量20 μL。洗脱程序为:A相为0.1%甲酸溶液,B相为0.1%甲酸-乙腈溶液(0 min, 45% B;1 min,45% B;8 min,48% B;9 min,45% B;14.21 min,停止)。采用二极管阵列检测器(diode array detector,DAD),检测波长为449 nm。在此基础上,利用制备型HPLC对各峰进行收集。
1.3.1.3 纯化色素的HRMS与FTIR分析
高分辨质谱(high resolution mass spectrometry,HRMS)检测条件:电喷雾离子源,负离子模式;DAD检测波长200~800 nm,干燥气温度350 ℃;干燥气流速750 L/h;毛细管电压2.5 kV;质量扫描范围m/z 100~1 000。
FTIR检测条件:采用溴化钾压片法,按照1∶100的比例加入纯化黄色素样品和溴化钾,研磨均匀后压片,在500~4 000 cm-1范围内测定红外光谱。
1.3.2 纯化黄色素标准曲线的绘制及提取量的计算
标准溶液的制备:取5.0 mg纯化色素,加入1.0 mL二甲基亚砜,充分溶解后过0.22 μm微孔滤膜,再用色谱纯乙腈稀释成不同质量浓度(0.1、0.5、1.0、5.0、10.0 μg/mL),以1.3.1.2节方法进行HPLC分析,得到标准曲线Y=80 411X-3 830.9,R2=0.999 4。Y为纯化色素峰积分面积,X为纯化色素质量浓度(μg/mL)。蛹虫草纯化色素提取量按下式计算:

式中:m0为用标准曲线测定得到的纯化色素质量/μg;M0为蛹虫草子实体质量/g。
1.3.3 单因素试验
分别以甲醇、乙醇溶液体积分数(0%、20%、40%、60%、80%、100%)、提取温度(4、16、25、40、50、60、70、80 ℃)、料液比(1∶5、1∶10、1∶20、1∶30、1∶40、1∶50(g/mL))、提取时间(15、30、45、60、90、120、160 min)为影响因素进行单因素试验,考察各因素对纯化色素提取量的影响。
1.3.4 响应面试验设计
以纯化色素提取量为响应值,根据单因素试验结果,采用Box-Behnken试验设计原理,选择乙醇溶液体积分数、提取温度和提取时间3 个因素,共17 个试验点的响应面分析试验,确定最佳提取工艺。每一变量的低、中、高水平分别以-1、0、1编码,试验因素与水平见表1。

表1 Box-Behnken试验因素与水平Table 1 Coded levels and corresponding actual levels of factors used in Box-Behnken design
1.4 数据处理
采用Design-Expert V8.0.6软件进行响应面Box-Behnken试验设计,采用GraphPad Prism 7软件对数据进行整理统计分析,各项指标结果以表示(n=6),采用Tukey’s Multiple Comparison Test进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 提取溶剂的比较

图1 不同提取溶剂的比较Fig. 1 Comparison of extraction efficiencies of yellow pigment with different solvents
如图1所示,蛹虫草黄色素能较好地溶解于水(图1H)、甲醇(图1E)溶剂,以及水分别与甲醇、乙醇的混合液(图1G、1F)。其微溶于乙醇(图1D)、丙酮(图1C)溶剂,在乙醚(图1B)、石油醚(图1A)中溶解性极差,说明水等强极性溶剂的提取效果明显优于石油醚等弱极性有机溶剂。根据相似相溶原理,说明蛹虫草黄色素是一类极性较大的化合物[28]。
2.2 HPLC、HRMS分析结果
为了进一步了解从蛹虫草中获得的色素种类,采用HPLC分离纯化蛹虫草粗提物,结果显示蛹虫草黄色素有9 个主要峰(图2A),各峰的分离度均大于1.5,说明通过反相C18柱可以实现蛹虫草黄色素的有效分离。同时,对第5号峰(保留时间为5.562 min)进行HRMS与全波长扫描测试,结果表明,纯化色素5准分子离子峰为m/z262.108 6 [M-H]-(图2B),并推测其分子式为C14H17N1O4。全波长扫描结果显示,纯化色素5在278、449 nm和477 nm波长处检测到最大吸收波长(图2C),表明该色素具有与类胡萝卜素结构相似的不饱和共轭体系[29]。

图2 HPLC、HRMS谱图Fig. 2 HPLC chromatogram and HRMS spectra
2.3 FTIR分析结果

图3 纯化色素5 FTIR光谱图Fig. 3 FTIR spectra of purified pigment 5
如图3所示,纯化色素5在3 384 cm-1处产生吸收,结合MS结果,氮规则表明该化合物有奇数个N原子存在,故推测此处为仲胺(R—N—H)伸缩振动。样品在3 303 cm-1处有强的宽带(R—O—H伸缩)振动吸收,并且在1 078、1 145 cm-1和1 175 cm-1处有较强的(C—O单键)振动吸收,在1 695 cm-1和1 565 cm-1处产生强的(C=C)伸缩振动,在876 cm-1处产生(C—H)面外扭摆振动吸收,表明纯化色素5具有与类胡萝卜素相似的红外吸收特征[30]。同时,根据纯化色素5具有不饱和共轭多烯结构的特点,将该色素命名为虫草烯。
为了最终确定虫草烯的分子结构和立体结构,需结合核磁共振波谱法和单晶衍射技术对虫草烯进一步分析。同时,鉴于虫草烯具有与类胡萝卜素相似的紫外、红外吸收特征,虫草烯在抗氧化、抗衰老方面的药用价值也值得进一步研究。
2.4 单因素试验结果
2.4.1 甲醇、乙醇溶液体积分数对虫草烯提取量的影响
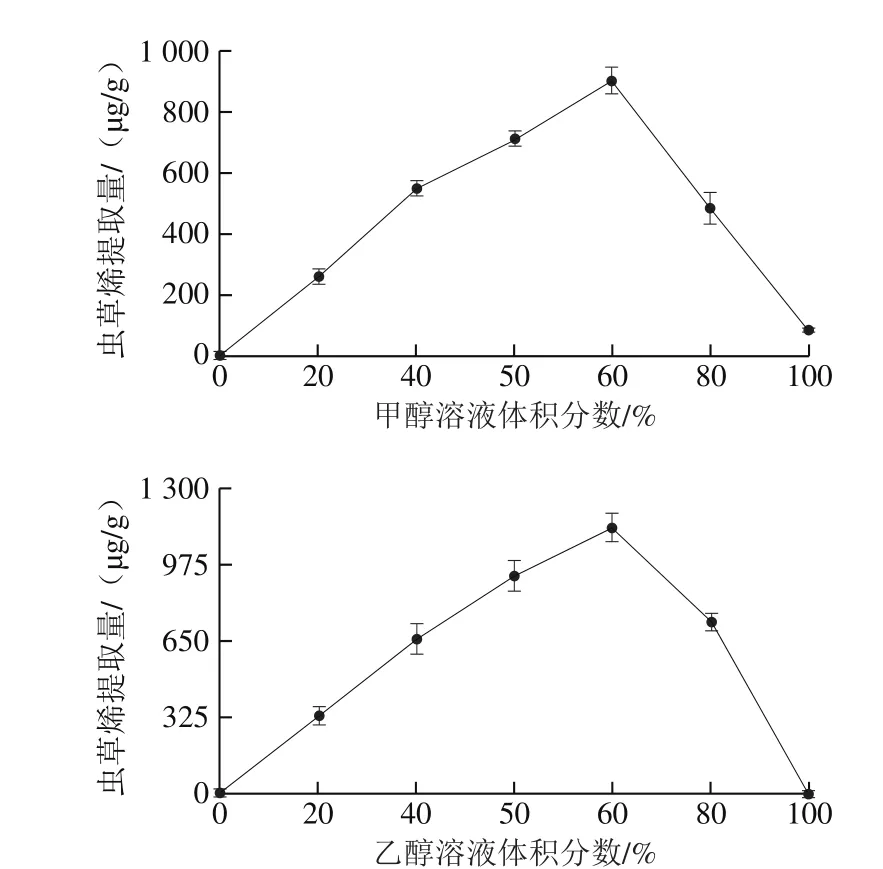
图4 甲醇、乙醇溶液体积分数对虫草烯提取量的影响Fig. 4 Effects of methanol and ethanol concentration on the extraction efficiency of cordycepene
在提取温度25 ℃、料液比1∶20、提取时间30 min条件下,测定不同体积分数甲醇和乙醇溶液对虫草烯提取量的影响。由图4可知,当甲醇、乙醇溶液体积分数为60%,虫草烯提取量最大,分别为(903.13±42.21)μg/g和(1 145.04±59.13)μg/g。再增加体积分数时,由于子实体粉末中脂溶性物质的溶出增加,从未减少虫草烯的溶解,提取量呈现下降趋势[31]。同时,由于甲醇具有一定毒性,不适宜应用于食品工业生产,所以选择60%乙醇溶液作为最佳提取溶剂。
2.4.2 提取温度对虫草烯提取量的影响

图5 提取温度对虫草烯提取量的影响Fig. 5 Effect of extraction temperatures on the extraction efficiency of cordycepene
在提取溶剂60%乙醇溶液、料液比1∶20、提取时间30 min条件下,测定不同提取温度对虫草烯提取量的影响。由图5可知,在较低温度范围内,随着提取温度的升高,增加了水分子的动能,促进了扩散运动的进
行[32],虫草烯提取量不断增加,在40 ℃时提取量达到最大值(1 277.15±57.78) μg/g。超过40 ℃后,高温破坏虫草烯的结构稳定性,导致虫草烯碳链分解,失去原有的光学性质,虫草烯提取量呈现较快的下降。因此,在单因素优化试验过程中,始终保持提取环节在40 ℃以下的工作环境中进行。
2.4.3 料液比对虫草烯提取量的影响

图6 料液比对虫草烯提取量的影响Fig. 6 Effect of solid to solvent ratio on the extraction efficiency of cordycepene
在提取溶剂60%乙醇溶液、提取温度40 ℃、提取时间30 min条件下,测定不同料液比对虫草烯提取量的影响。由图6可知,虫草烯提取量随料液比的增加,呈现先增加后稳定的趋势。当料液比为1∶20时,提取量达到(1 489.71±50.01)μg/g。这一现象符合质量传递原则,当提取溶剂使用量比较大时,较大的浓度差会促使传质推动力增加,使传质速率增大,从而提高提取量[33-34]。再增大料液比,提取量的增加不明显,表明溶剂已将有效成分基本溶出完全。同时,过大的料液比会造成溶剂和能源的浪费,不利于后期浓缩工作的进行。因此,选择1∶20作为最佳的料液比,继续进行优化实验。
2.4.4 提取时间对虫草烯提取量的影响
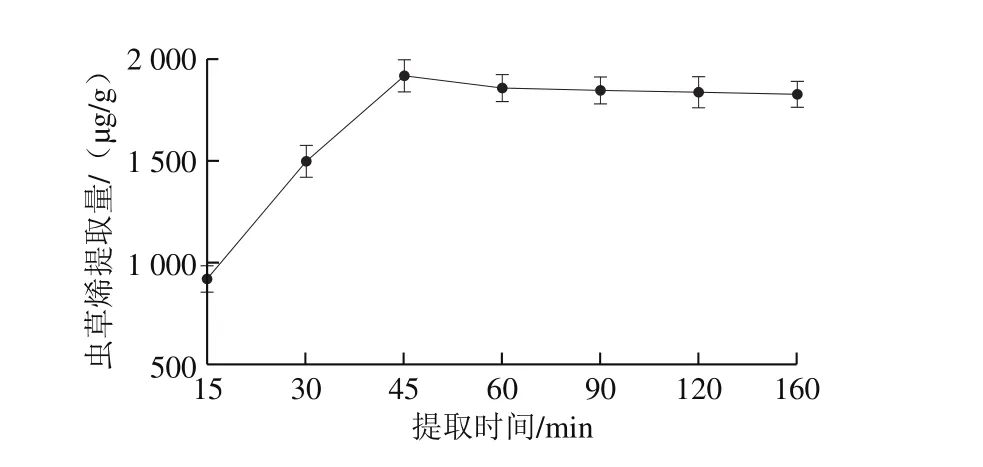
图7 提取时间对虫草烯提取量的影响Fig. 7 Effect of extraction time on the extraction efficiency of cordycepene
在提取溶剂60%乙醇溶液、提取温度40 ℃、料液比1∶20条件下,测定不同提取时间对虫草烯提取量的影响。由图7可知,随着提取时间的延长,虫草烯提取量不断增加,当时间超过45 min,提取量趋于降低。提取45 min时,提取溶剂中虫草烯提取量趋向饱和状态,提取量达到(1 915.95±65.98)μg/g,时间不再成为影响提取量的重要因素。但随着提取时间的延长,40 ℃乙醇容易混发,减少的乙醇导致提取量缓慢降低[35-36]。
2.5 响应面试验设计与结果
2.5.1 响应面试验结果与回归方程拟合
利用Design-Expert V8.0.6软件,对实验结果进行多项式回归分析,结果见表2。经拟合回归,得到综合得率Y对自变量A、B、C的回归方程Y=2 212.08-438.49A+152.21B+179.90C+60.57AB-112.06AC+5.91BC-967.37A2-248.90B2-317.68C2。

表2 响应面试验设计与结果Table 2 Box-Behnken design in terms of coded values with response variable
2.5.2 响应面模型方差及可行度分析

表3 回归模型方差及可信度分析Table 3 Analysis of variance and reliability of regression model
由表3可知,此模型P值小于0.01,表明回归模型达到极显著水平。失拟项P=0.125 4>0.05,模型失拟度不显著,模型相关系数R2为0.983 3,校正决定系数R2Adj为0.961 8表明此模型拟合优度好,实验误差小,可用该模型分析和预测各因素对蛹虫草虫草烯提取量的影响[37-38]。在一次项中,乙醇溶液体积分数、提取时间对蛹虫草虫草烯提取量的影响极显著;提取温度对虫草烯提取量的影响显著。各因素显著性程度依次为乙醇溶液体积分数>提取时间>提取温度。
2.5.3 交互作用分析结果
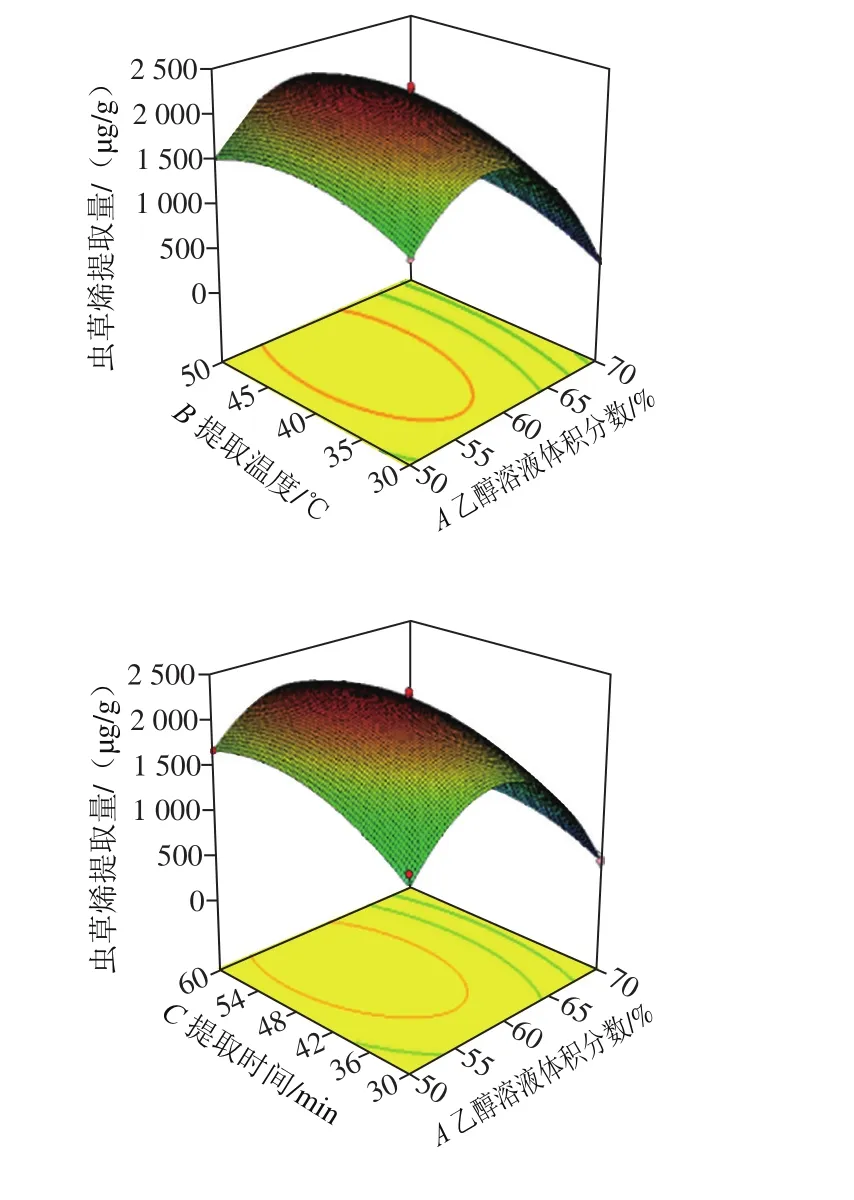

图8 各因素交互作用对虫草烯提取量影响的响应面图Fig. 8 Response surface plots showing the interactive effects of various factors on cordycepene extraction
由图8可知,虫草烯提取量随着乙醇溶液体积分数、提取温度、提取时间的增大呈现先增大后减少的趋势,说明该模型具有极大值。响应面的陡峭程度随乙醇溶液体积分数、提取时间的变化起伏较大,说明乙醇溶液体积分数、提取时间对虫草烯提取量的影响大于提取温度。以上分析与表3的方差分析结论一致。
2.5.4 工艺参数优化验证结果

表4 提取次数对虫草烯提取率的影响Table 4 Effect of number of extraction cycles on the extraction yield of cordycepene
通过软件求解回归方程,最佳蛹虫草虫草烯提取条件为乙醇溶液体积分数57.68%、提取温度44.40 ℃、提取时间52.44 min,预测虫草烯提取量可达到2 299.61 μg/g。在此条件下,测定实际蛹虫草黄色素得率为(2 259.23±83.88)μg/g(表4),与预测值相近,偏差较小,证明了该方程的准确性和实用性。同时,在最佳提取条件下,进行多次提取,确定提取级数和虫草烯在子实体粉末中的最终含量。虫草烯提取量随着提取次数的增加而增大,当提取级数达到第7次时,HPLC已经检测不到虫草烯的存在,此时蛹虫草子实体中虫草烯提取量为(2 780.97±170.38)μg/g(表4)。当提取级数达到第3次时,虫草烯提取率已达到99.88%(表4),为了节省提取时间和减少提取溶剂的使用,故确定提取级数为3 级[39-40]。
3 结 论
本实验利用HPLC、质谱与FTIR相结合的方法,发现一种新型的蛹虫草黄色素,推测其分子结构式为C14H17N1O4。该色素具有与类胡萝卜素相似的紫外-可见光和红外吸收特征,表明该色素具有不饱和共轭多烯结构的特点,故将其命名为虫草烯。
响应面试验结果显示,各因素对虫草烯提取量的显著性程度依次为乙醇溶液体积分数>提取时间>提取温度,确定虫草烯最佳提取工艺条件为乙醇溶液体积分数57.68%、提取温度44.40 ℃、提取时间52.44 min,实际测定虫草烯提取量为(2 259.23±83.88)μg/g。提取级数确定为3 级,此时虫草烯提取率可达99.88%,含量为(2 777.72±170.46)μg/g(表4)。
