婴幼儿牛奶蛋白过敏的临床特点与危险因素分析
2019-12-04韦茹王静杨延萍肖玉联陈力谭美珍
韦茹 王静 杨延萍 肖玉联 陈力 谭美珍
广州市妇女儿童医疗中心儿童保健科(广州510623)
牛奶蛋白过敏(cow′s milk protein allergy,CMPA)指牛奶蛋白引起的异常的或过强的免疫反应,是一种婴幼儿常见的过敏性疾病,也是婴幼儿最常见的食物不良反应。据统计,全球婴幼儿CMPA 的发病率为1.9% ~4.9%[1],我国2 岁以下婴幼儿CMPA 的发病率约为2% ~3%[2],并且近年来呈不断上升的趋势。维生素D 是婴幼儿与儿童生长发育阶段不可或缺的营养素,有证据显示其与过敏性疾病的发生密切相关。研究[3-4]表明,调控体内维生素D 水平的维生素D 受体的基因多态性与儿童哮喘、CMPA 等过敏性疾病相关。但是,维生素D 不足是否与婴幼儿CMPA 的关联,以及是否为婴幼儿CMPA 的危险因素目前仍有争议。为此,笔者进行了一项单中心回顾性临床研究,通过检测分析CMPA 婴幼儿25-羟基维生素D 水平,探讨其与CMPA 的相关性,并确定婴幼儿CMPA 相关临床危险因素,提高婴幼儿CMPA 的防治意识,为临床防治以及后续研究提供一定依据。
1 资料与方法
1.1 一般资料广州市妇女儿童医疗中心儿童保健科拥有较完善的儿童保健管理体系,依托前期科研平台建立了出生研究队列,已建成婴幼儿CMPA 临床数据库。笔者采用回顾性分析方法,选择2017年1月至2018年12月在本院儿童保健科门诊首次就诊、资料完整并且行血清25-羟基维生素D 水平检测的CMPA 患儿93 例,另选取同期排除CMPA 且行血清25-羟基维生素D 水平检测的体检婴幼儿186 例为对照组。
1.2 方法查阅婴幼儿CMPA 临床数据库资料,收集完整的医疗信息包括:患儿特征如性别、年龄、出生情况、喂养史及母亲孕期或婴幼儿是否补充维生素D 等;家族史如家族过敏性疾病史(哮喘、过敏性鼻炎、特应性皮炎或食物过敏者等)、家庭成员吸烟情况;实验室检查如血嗜酸性粒细胞和血清牛奶蛋白特异性sIgE 水平;临床症状及体征、喂养情况及生长发育状况等。
1.3 CMPA 诊断依据及临床症状程度划分CMPA 诊断依据采用《中国婴幼儿牛奶蛋白过敏诊治循证建议》的诊断及临床症状程度划分标准[5]。以口服牛奶激发试验为确诊的依据。CMPA 临床症状程度划分:(1)轻-中度:具有一种或多种下列症状为轻-中度CMPA:①胃肠道:反复反流、呕吐、腹泻、便秘(伴或不伴肛周皮疹)、便血;②皮肤:湿疹样表现、红斑、风团、血管性水肿;③呼吸系统:非感染性流涕、慢性咳嗽及喘息;④一般情况:持续肠痉挛(≥3 h/d,≥3 次/周,持续≥3 周)。(2)重度:具有一种或多种以下表现:①胃肠道:由于拒食、腹泻、呕吐或反流造成生长障碍、中到大量的便血造成血红蛋白下降、蛋白丢失性肠病、内镜或组织学证实的肠病或溃疡性结肠炎;②皮肤:严重渗出性湿疹样表现伴有生长障碍、低蛋白性贫血或缺铁性贫血;③呼吸系统:伴有呼吸困难的急性喉头水肿或支气管阻塞;④严重过敏反应:症状进展迅速、累及两个以上器官系统,尤其是心血管系统,出现如血压下降及心律失常等表现,甚至过敏性休克。
1.4 血清25-羟基维生素D 检测婴幼儿于清晨采集空腹静脉血2 mL,标本静置、离心、分离血清,于-80 ℃储存。由检验科通过酶联免疫吸附试验对血清25-羟基维生素D 水平统一进行检测,试剂盒由英国IDS 公司提供。结果判定标准为血清25-羟基维生素D 水平在37.5 ~50 nmol/L 范围内时定义为维生素D 不足,血清25-羟基维生素D 水平≤37.5 nmol/L 定义为维生素D 缺乏[6]。
1.5 统计学方法所有数据采用Excel 2010 录入,使用SPSS 13.0 软件进行数据分析,计数资料采用频数、率、构成比表示,组间比较采用两配对χ2检验;计量资料采用均数±标准差表示,两组计量资料之间比较采用两独立样本t检验。将单因素分析中P<0.001 的变量纳入多因素分析,应用Logistic 多元逐步回归法(后向)确定最终进入模型的影响因素。以P<0.05 为差异有有统计学意义。
2 结果
2.1 CMPA 组与对照组婴幼儿的一般情况比较CMPA 组 男55 例,女38 例;其 中 新 生 儿8 例(8.6%),1 ~6 个月72 例(77.4%),7 ~12 个月13例(14.0%);性别、年龄与对照组差异无统计学意义(P>0.05)。CMPA 组与对照组婴幼儿比较,剖宫产、纯母乳喂养、部分母乳喂养、人工喂养、维生素D不足、维生素D缺乏、家族过敏性疾病史、血嗜酸性粒细胞增多及血清牛奶蛋白sIgE 阳性有差异统计学意义(P<0.05),见表1。
2.2 婴幼儿CMPA 发生危险因素的Logistic 回归分析通过Logistic 多元逐步回归对婴幼儿CMPA 发生的各因素进行综合分析显示,主要影响其发生的危险因素包括剖宫产、纯母乳喂养、维生素D不足、家族过敏史、血嗜酸性粒细胞增多、血清牛奶蛋白sIgE 阳性等,其中纯母乳喂养为保护因素,其他为高危因素,相关参数见表2。
2.3 轻-中度婴幼儿CMPA 组与重度婴幼儿CMPA 组的一般情况比较与轻-中度婴幼儿CMPA组比较,重度婴幼儿CMPA 组纯母乳喂养、维生素D 缺乏差异有统计学意义(P<0.05),见表3。
2.4 重度婴幼儿CMPA 发生危险因素的Logistic回归分析通过Logistic 多元逐步回归对重度婴幼儿CMPA 发生的各因素进行综合分析显示,影响其发生危险因素的包括纯母乳喂养、维生素D 缺乏等,前者保护因素,后者为高危因素见表4。
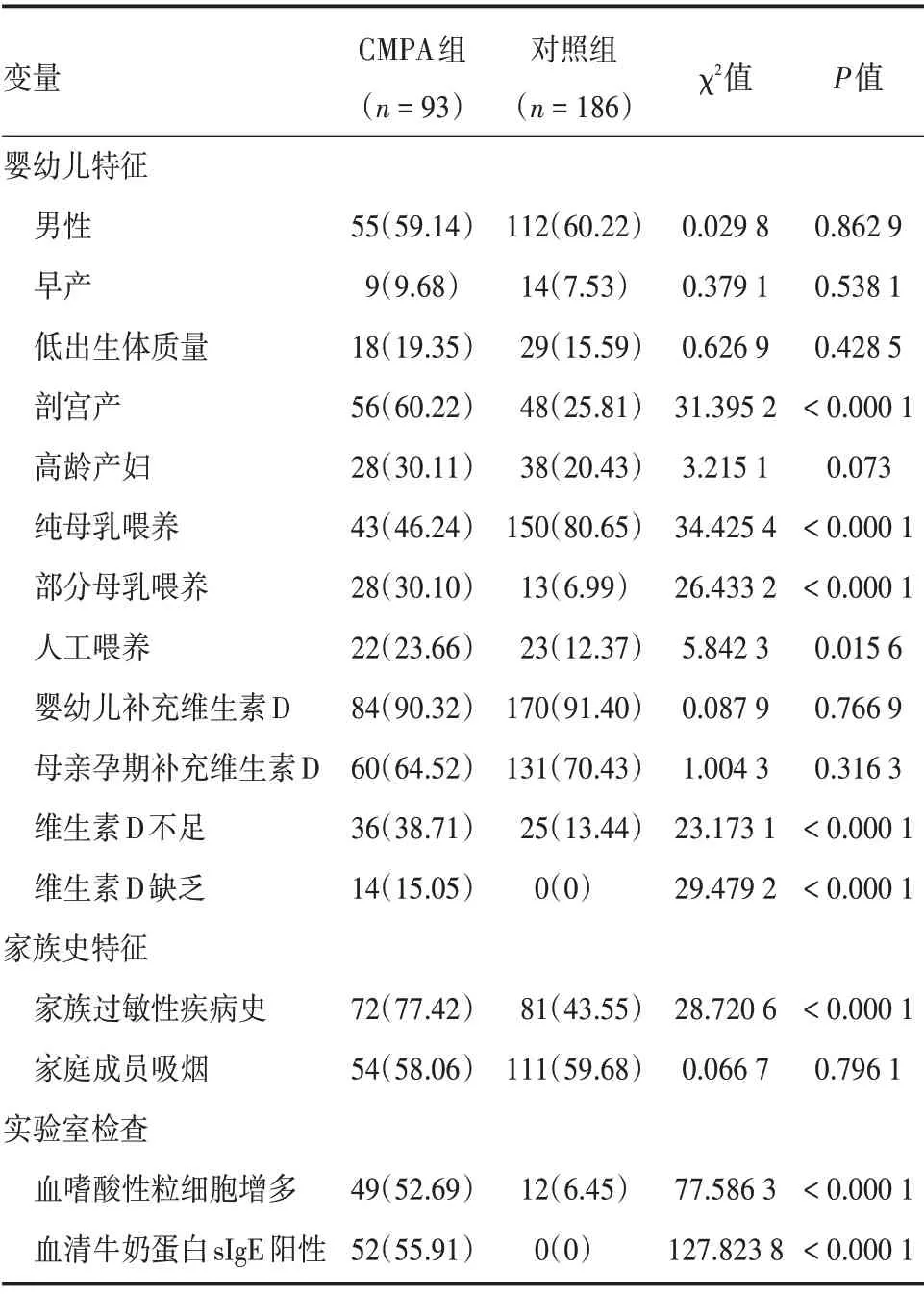
表1 CMPA 组与对照组婴幼儿的一般情况比较Tab.1 General comparison of infants between CMPA group and control group 例(%)
3 讨论
婴幼儿食物过敏以CMPA 最为常见,可累及多器官多系统,例如皮肤、胃肠道及呼吸系统等,病情严重者可导致营养不良,并影响婴幼儿的生长发育,诊治不当可严重影响患儿预后。更严重的是婴幼儿CMPA 随年龄的增长可演变成其他过敏性疾病如过敏性鼻炎、哮喘甚至过敏性紫癜等[7-9]。可见,婴幼儿CMPA 危害极大。虽然CMPA 很常见,但其临床表现却无特异性,因此容易造成误诊、漏诊,家庭与社会相关医疗负担庞大。因此,识别婴幼儿CMPA 危险因素,探讨其可能发病机制与防治手段,有着非常积极、重要的意义。
本研究发现,CMPA 组婴幼儿的剖宫产率显著高于对照组,剖宫产是婴幼儿CMPA 的危险因素。剖宫产与过敏性疾病包括CMPA 之间的关联既往已有不少研究证实,其可能的原因在于经阴道分娩的婴幼儿更容易获得母体的肠道菌群从而建立正常的肠道微生态[10]。本研究还发现CMPA 组儿童的家族过敏史的比例显著高于对照组,并且是婴幼儿CMPA 的危险因素。目前普遍认为,家族遗传背景因素在CMPA 发病中起一定作用,这也与既往类似研究相吻合[3]。本研究提示纯母乳喂养是婴幼儿CMPA 以及重度婴幼儿CMPA 的保护因素,这可能与母乳喂养有助于婴幼儿正常免疫环境、肠道微生态的建立有关。多个研究提示[11-13],在正常的母乳喂养婴幼儿肠道菌群中双歧杆菌属占主导地位,而在配方奶粉喂养的婴幼儿,则类杆菌属和梭状芽孢杆菌和肠杆菌占主导,这种菌群失调与过敏性疾病包括婴幼儿CMPA 的疾病的风险增加有关。
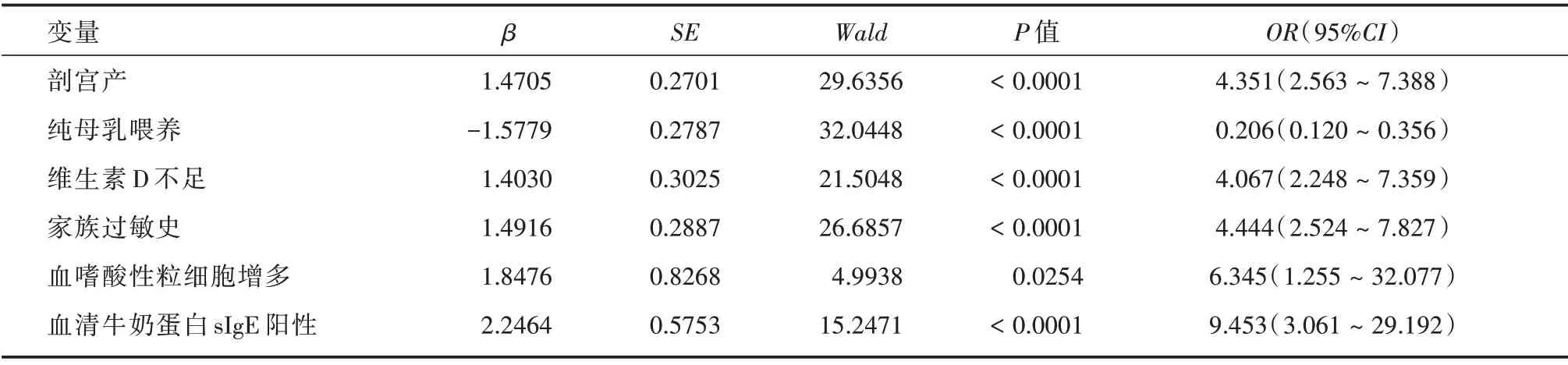
表2 婴幼儿CMPA 发生危险因素的Logistic 回归分析Tab.2 Logistic regression analysis of risk factors in infants with CMPA
CMPA 可由IgE 介导与非IgE 介导的免疫反应所引起,其发病机制及危险因素复杂且尚未完全明了。一般认为,CMPA 的发病机制主要是1 型与2 型调节T 细胞之间不平衡,并且可能合并了对免疫应答起抑制作用的调节T 细胞数量的减少或者功能异常。其中IgE 介导的CMPA 主要是2 型调节T 细胞相关因子大量分泌,IgE 抗体产生并介导细胞信号的级联放大,最终产生过敏炎症反应的瀑布效应,导致多系统多器官的过敏反应[14-15]。本研究结果也显示血清牛奶蛋白sIgE 阳性是婴幼儿CMPA 发生的危险因素,印证了这一发病机制,并提示临床检测血清牛奶蛋白sIgE 仍然具有一定价值。此外,研究还显示血嗜酸性粒细胞增多是婴幼儿CMPA 发生的危险因素。嗜酸性粒细胞增多在婴幼儿常见于湿疹、支气管哮喘、食物过敏及寄生虫感染等,尽管其诊断CMPA 的敏感性及特异性均有所不足,但结合其它检测项目和临床表现,仍然有一定意义。
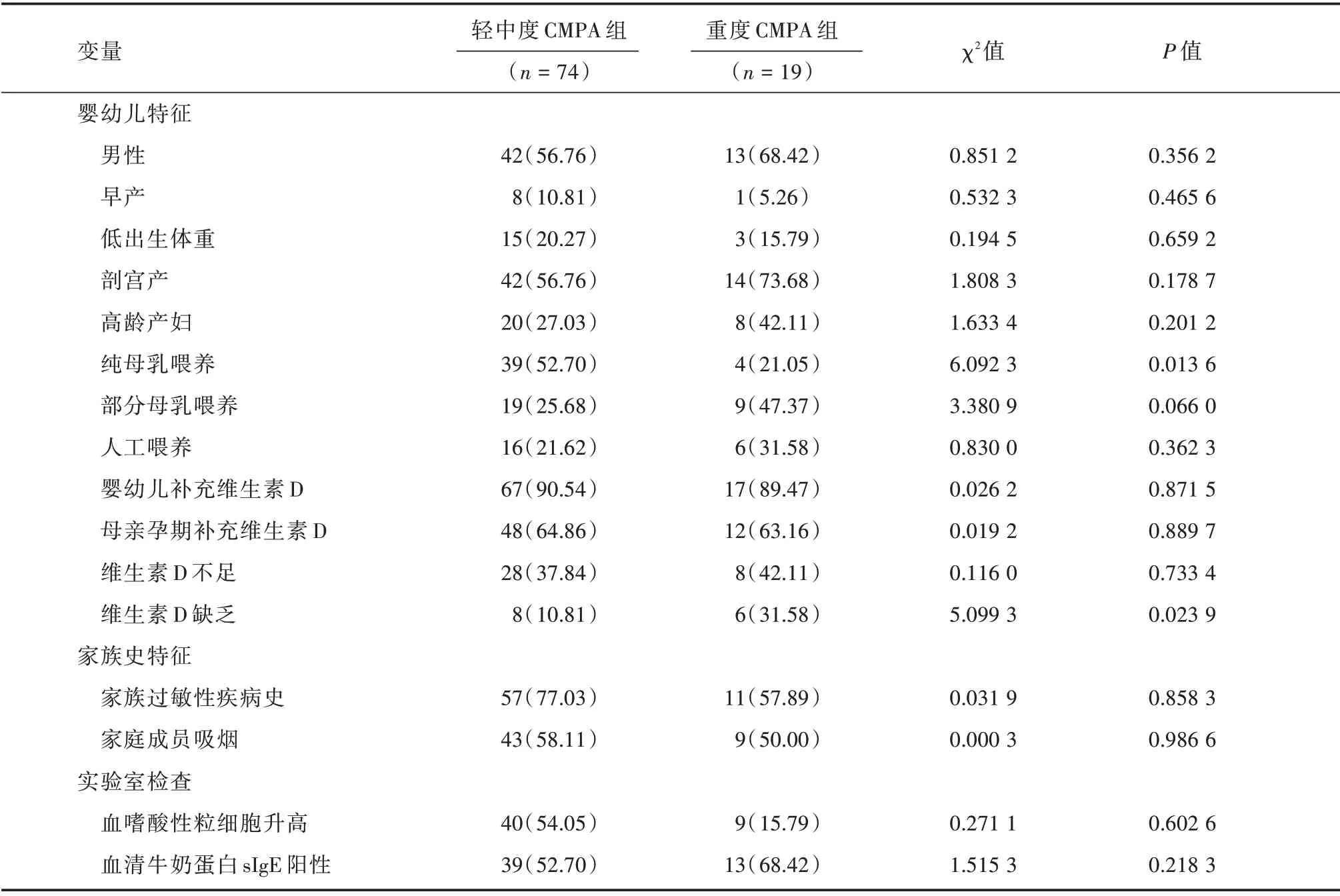
表3 轻-中度婴幼儿CMPA 组与重度婴幼儿CMPA 组的一般情况比较Tab.3 General comparison of infants between mild-moderate CMPA group and severe CMPA group 例(%)
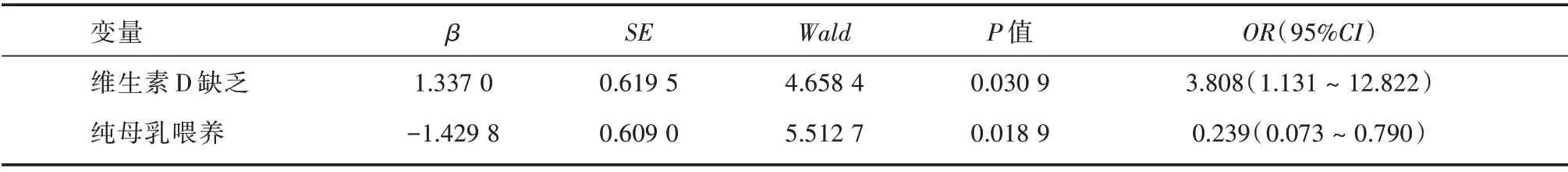
表4 重度婴幼儿CMPA 发生危险因素的Logistic 回归分析Tab.4 Logistic regression analysis of risk factors in infants with severe CMPA
血清25-羟基维生素D 是人体循环中维生素D最丰富和稳定的形式,通常被用于直接代表血清维生素D 水平,因此在本研究被选择进行检测并代表婴幼儿的维生素D 水平。本研究提示,CMPA与维生素D 不足或缺乏存在关联。维生素D 是儿童生长发育的必需营养素,目前认为维生素D 的活性代谢产物除对骨骼和钙代谢有作用外,还有免疫调控作用,且维生素D 不足或缺乏被认为是促进过敏性疾病发生的高危因素之一。ALLEN等[16]研究表明,维生素D 不足是食物过敏的危险因素。与SILVA 等[17]的研究一致,本研究表明维生素D 不足是婴幼儿CMPA 的危险因素,维生素D 缺乏是重度婴幼儿CMPA 的危险因素。影响维生素D 水平的因素除光照、膳食补充外,还与维生素D 受体基因的调控有关。有儿童的病例对照研究显示,TMPRSS6 rs855791 TT 基因型可能为CMPA 的易感基因型,而维生素D 受体基因Fok I rs2228570 多态性与CMPA 不相关,这对下一步的干预有重要提示作用。即在高危人群,应考虑排查是否携带CMPA 的易感基因,对于易感人群,应及时干预。有研究[18]认为25-羟基维生素D 对IgE介导的食物过敏导致的过敏性疾病通过免疫调节发挥保护作用,并且25-羟基维生素D缺乏可能与特应性皮炎的严重程度有关。意大利的一项随机对照研究[19]发现,通过人为补充维生素D,患儿特应性皮炎的严重程度下降并且1 型与2 型调节T细胞分泌的免疫因子趋于正常水平。另外,有研究[20]显示炎症介质与儿童过敏性疾病关系密切。这些都对婴幼儿CMPA 的干预研究提供了思路。人体所需维生素D 主要是阳光照射皮肤而产生,也有一部分可通过食物如动物肝脏、蛋黄、鱼肝油等获取,但天然食物(包括母乳)维生素D 含量少。因此,合理的干预措施包括补充适量维生素D 制剂、加强户外活动、增加日光照晒等。
本研究的新颖之处在于明晰了婴幼儿CMPA的危险因素,为后续临床干预研究提供了一定依据。本文的缺点除回顾性研究本身固有的缺陷之外,还包括如下其他几点不足。首先,本研究纳入的婴幼儿均来自我院儿童保健科门诊的就诊患儿,不具有广泛的代表性;其次,维生素D 检测不是婴幼儿CMPA 或婴幼儿体检的常规检测项目,可能增加了研究的偏倚;再者,作为回顾性观察研究,很多混杂因素如维生素D 的补充情况、日照时间等无法收集并进行统计分析;最后,限于病例数有限,对维生素D 不足或缺乏未能进一步细分亚组,也是缺陷之一。尽管如此,本研究的数据来源于前期研究建立的数据库,数据收集相对详实,且样本量也相对较大,因此仍然有一定参考价值。笔者计划设计良好的多中心、大样本、前瞻性观察性研究进一步验证本文结论。
综上所述,剖宫产、纯母乳喂养、维生素D 不足、家族过敏史、血嗜酸性粒细胞增多、血清牛奶蛋白sIgE 阳性是婴幼儿CMPA 危险因素;纯母乳喂养、维生素D 缺乏是重度婴幼儿CMPA 危险因素,对危险因素的干预可能有助改善患儿病情。
