鲣鱼黄嘌呤氧化酶抑制肽酶法制备工艺优化
2019-12-04邹琳杭妙佳李阳杜鹃冯凤琴
邹琳,杭妙佳,李阳,杜鹃,冯凤琴*
(1.浙江大学生物系统工程与食品科学学院,杭州310058;2.杭州康源食品科技有限公司,杭州310003)
高尿酸血症是由嘌呤类物质代谢紊乱或尿酸排泄减少引起的血尿酸升高的一种疾病[1]。长期尿酸过高对血管、心、肾均会产生一系列不良影响,增加了患高血压、糖尿病、心脑血管疾病及肾脏疾病等的风险[2-4]。目前,治疗高尿酸血症最常见的方法是服用化学合成的药物,但长期服用易产生过敏、胃肠道反应、骨髓抑制、肝功能损害等毒副作用[5-6],因而开发食品来源的、低毒副作用的降尿酸物质具有重要的临床意义。
有研究发现,芹菜素[7]、木犀草素[8]、槲皮素[9]等黄酮类物质,茶多酚[10]、白藜芦醇[11]等酚酸类物质及莲碱[12]、甜菜碱[13]等生物碱类物质,具有较好的降尿酸作用。蛋白来源的小分子降尿酸肽具有制备成本低、安全性高、易吸收等特点,已引起研究者的关注,成为降尿酸研究领域的热点[14]。
目前,国内外降尿酸活性研究聚焦于黄嘌呤氧化酶(xanthine oxidase,XOD)抑制剂的筛选。XOD是体内尿酸生成环节中的关键酶[15]。以XOD 为靶点的抑制剂能够直接与钼蝶呤催化活性中心结合,阻断尿酸的生成[16]。尿酸生成的同时会伴随产生超氧阴离子和过氧化氢[17],这会引发炎症从而加重高尿酸血症病情。研究表明,由β-丙氨酸和L-组氨酸组成的二肽——肌肽及其类似物鹅肌肽,能清除活性氧及过氧化氢自由基,具有较强的抗氧化作用[18]。鲣鱼(Katsuwonus pelamis),俗称炸弹鱼,属于金枪鱼科[19],具有高蛋白、低脂肪等特点,但由于其肌纤维粗、腥味大而不宜生食,故常加工成罐头,属低值金枪鱼[20]。而鲣鱼肉含有丰富的肌肽及鹅肌肽[21],是制备降尿酸活性肽的良好来源。KUBOMURA等[22]通过人体试食试验发现,含有肌肽及鹅肌肽的鲣鱼提取物能够降低血尿酸水平。而肌肽及鹅肌肽是否通过抑制XOD 活性来发挥降尿酸作用尚不明确[22-23]。此外,由于发挥XOD 抑制活性的成分主要为小分子肽,而生物酶解技术是制备获得小分子肽的有效途径,因此,生物酶解技术可应用于鲣鱼XOD 抑制肽的制备。本研究以水解度、氮回收率、XOD 抑制活性、肌肽和鹅肌肽含量为指标,优化鲣鱼XOD抑制肽的酶法制备工艺,并分析探讨肌肽及鹅肌肽与XOD抑制活性的关系,以期为工业化生产鲣鱼XOD抑制肽提供理论依据。
1 材料与方法
1.1 材料与仪器
材料:鲣鱼由浙江省宁波今日食品有限公司提供,去除鱼头、内脏、鱼骨和鱼尾后,剩下背腹肉,清洗干净并绞碎,于-20 ℃条件下储藏。
试剂:中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、复合蛋白酶及胰酶,购自南宁庞博生物工程有限公司;黄嘌呤、黄嘌呤氧化酶、肌肽、鹅肌肽及乙腈(色谱级),购自美国Sigma公司。
仪器:Infinite M2000酶标仪(瑞士Tecan公司),U3000 高效液相色谱仪[赛默飞世尔科技(中国)有限公司],Anke LXJ-IIB离心机(上海安亭科学仪器厂),FD-1C-50 冷冻干燥机(北京博医康试验仪器有限公司)。
1.2 试验方法
1.2.1 鲣鱼XOD 抑制肽的制备
将料水比1∶3的鲣鱼背腹肉悬浊液在不同酶解条件下进行酶解,结束后经沸水浴灭酶15 min,冷却,离心(5 000 r/min,30 min),收集上清液,测定其水解度及氮回收率;然后,冷冻干燥,于-20 ℃条件下贮藏,备用,测定冻干粉的XOD抑制活性(质量浓度为8.8 mg/mL,以氮计)、肌肽及鹅肌肽含量和分子质量分布。
1.2.2 蛋白酶的筛选
分别用中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、复合蛋白酶、胰酶在其各自推荐的最适pH 和温度条件下对鲣鱼背腹肉进行酶解。设定加酶量1 000 U/g、料水比1∶3、酶解时间5 h。蛋白酶活性、最适温度和pH 见表1。以XOD 抑制活性、氮回收率和水解度为评价指标,筛选出最佳蛋白酶。
1.2.3 单因素试验
以水解度、氮回收率、XOD抑制活性及肌肽、鹅肌肽含量为指标,进一步考察加酶量、酶解温度、酶解pH和酶解时间这4个因素的影响。
1.2.4 响应面试验
根据单因素试验结果设计响应面优化试验,确定酶解制备鲣鱼XOD抑制肽的最佳工艺。
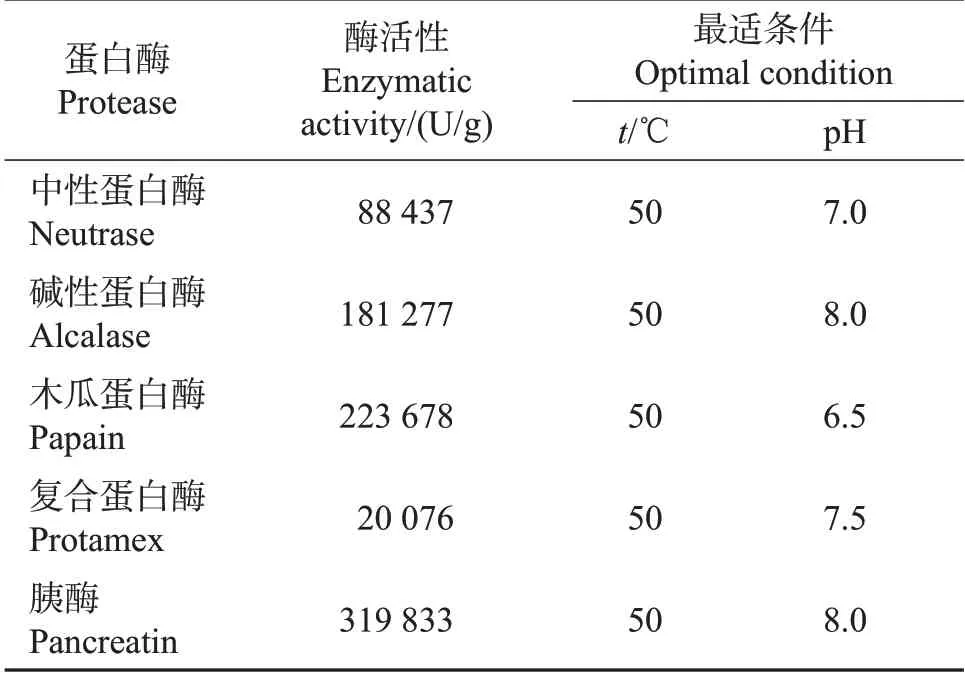
表1 各蛋白酶的最适酶解条件Table 1 Optimal enzymatic hydrolysis conditions of different proteases
1.2.5 水解度测定
参考pH-Stat测定水解度的方法[24]。
1.2.6 氮回收率测定
采用凯氏定氮法(参照GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》)测定鲣鱼背腹肉酶解后上清液中总氮含量。氮回收率计算公式如下:
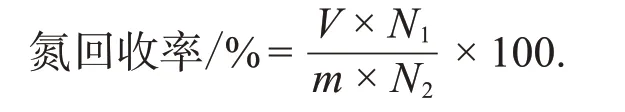
式中:V为上清液体积,mL;N1为上清液中氮元素质量浓度,g/mL;m为酶解时加入鱼糜的质量,g;N2为鱼糜中氮元素质量分数,g/g。
1.2.7 XOD 抑制活性测定
于96 孔板中每孔加入50 μL 待测样品及50 μL浓度为0.02 U/mL 的XOD 溶液,振荡30 s,于25 ℃条件下保温5 min,加入150 μL 0.48 mmol/L 的黄嘌呤溶液,振荡30 s后,于25 ℃条件下保温25 min,测定在290 nm波长处的吸光度值。XOD抑制活性计算公式如下:
XOD抑制率/%=[1-(D1-D2)/(D3-D4)]×100.式中:D1为加酶样品溶液的吸光度值;D2为不加酶样品溶液的吸光度值;D3为用缓冲液代替样品溶液的空白组的吸光度值;D4为不加酶空白组的吸光度值。
1.2.8 肌肽和鹅肌肽含量测定
采用高效液相色谱法测定肌肽和鹅肌肽含量。色谱柱:Sepax HP-amino(4.6 mm×250 mm,5 μm,江苏省苏州赛分科技有限公司)。流动相:V[50 mmol/L 磷酸缓冲溶液(pH 6.8)]∶V(乙腈)=4∶6;进样体积20 μL;流速1 mL/min;柱温25 ℃;检测波长210 nm;运行时间25 min。
1.2.9 分子质量测定
取鲣鱼酶解冻干粉,用流动相稀释至2 mg/mL,采用凝胶色谱法测定肽的分子质量分布。色谱柱:TSK gel 2000 SWXL分析柱(300 mm×7.8 mm,日本东曹株式会社)。流动相:V(乙腈)∶V(水)∶V(三氟乙酸)=450∶550∶1;柱温30 ℃;流速0.5 mL/min;检测波长220 nm;运行时间30 min。
标准肽样品:细胞色素C(12 384 Da)、抑肽酶(6 511.44 Da)、维生素B12(1 355.37 Da)、氧化型谷胱甘肽(612.63 Da)和还原型谷胱甘肽(307.32 Da)。用相对分子质量的对数值与保留时间拟合直线方程:

式中:y 为标准肽样品相对分子质量的对数;x 为保留时间,min。
1.2.10 数据处理
试验数据以均值±标准偏差表示,采用Graphpad Prism 6 软件作图,采用SPSS 22.0、Design Expert 8.0 软件进行方差分析,P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 蛋白酶的筛选结果
用5种蛋白酶分别对鲣鱼背腹肉进行酶解,结果见表2。由于蛋白酶的专一性,不同蛋白酶的酶解位点并不相同,酶解得到的产物结构组成和XOD抑制活性也存在差异。其中,中性蛋白酶的XOD抑制活性、氮回收率和水解度均最高,分别达到了94.99%、97.57%和26.52%。因此,选用中性蛋白酶酶解鲣鱼背腹肉并进一步优化XOD抑制肽的制备工艺。
2.2 单因素试验结果
2.2.1 加酶量对酶解效果的影响
在料水比为1∶3 时,用中性蛋白酶在pH 为7.0和温度为50 ℃条件下酶解鲣鱼背腹肉5 h,考察不同加酶量对水解度、氮回收率、XOD 抑制活性及肌肽、鹅肌肽含量的影响。
由图1可知:随着加酶量的增加,反映鲣鱼蛋白酶酶解程度的水解度逐渐上升,而氮回收率逐渐下降。这是因为水解度衡量蛋白质肽链的断裂程度,而氮回收率则衡量水解对蛋白质的增溶程度,当水解达到一定程度时,发生的酶解反应主要是前阶段蛋白质水解获得的肽进一步转化为小肽和氨基酸,表现为水解度的增大,而氮回收率并不会增加[25],反而有可能因为生成含有较多疏水性氨基酸的肽聚集沉降,导致氮回收率的降低[26]。当加酶量为500 U/g 时,XOD 抑制活性达最大值(64.42%)。而随着加酶量的增加,鹅肌肽和肌肽含量在加酶量为4 000 U/g 时达到最大,与XOD 抑制活性在加酶量为500 U/g时达到最大不一致。考虑成本及氮回收率、XOD抑制活性,选择500 U/g为最佳加酶量。
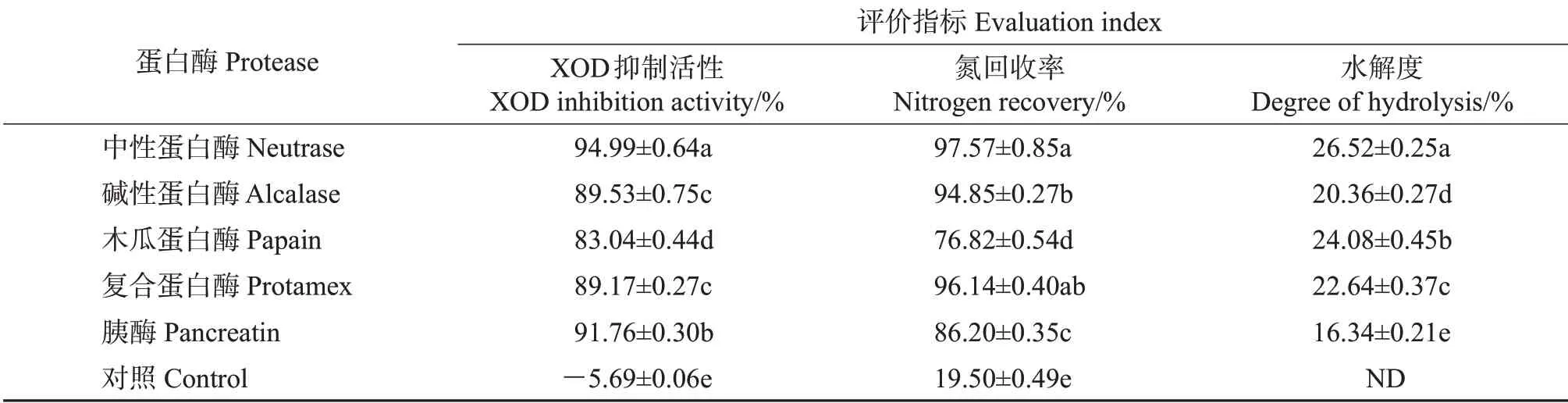
表2 不同蛋白酶对XOD抑制活性、氮回收率和水解度的影响Table 2 Effect of different proteases on XOD inhibition activity,nitrogen recovery and degree of hydrolysis

图1 加酶量对鲣鱼背腹肉酶解效果的影响Fig.1 Effect of enzyme dosages on enzymatic hydrolysis of dorsal and ventral muscle in skipjack tuna
2.2.2 酶解温度对酶解效果的影响
在料水比为1∶3 时,以500 U/g 的加酶量在pH为7.0 条件下酶解鲣鱼背腹肉5 h,考察不同酶解温度对水解度、氮回收率、XOD抑制活性及肌肽、鹅肌肽含量的影响。

图2 酶解温度对鲣鱼背腹肉酶解效果的影响Fig.2 Effect of temperature on enzymatic hydrolysis of dorsal and ventral muscle in skipjack tuna
酶解温度能够影响酶的活性及酶与底物反应的速度。通常,在一定范围内,温度较高,酶促反应速度较快,但酶失活的速度也较快,因此酶促反应有一个适宜的温度[27]。由图2 可知,在45 ℃时酶解液水解度最高(P<0.05),在45 ℃和50 ℃条件下氮回收率最高(P<0.05),但在50 ℃时XOD抑制活性显著高于在45 ℃时的活性(P<0.05),而肌肽和鹅肌肽含量在各酶解温度下无显著性差异(P>0.05),且与XOD 抑制活性的变化无关。综合考虑氮回收率最高及XOD 抑制活性最高,以50 ℃为最佳酶解温度。
2.2.3 酶解pH 对酶解效果的影响
在料水比为1∶3时,以500 U/g的加酶量在温度为50 ℃条件下酶解鲣鱼背腹肉5 h,考察不同pH对水解度、氮回收率、XOD抑制活性及肌肽、鹅肌肽含量的影响。
pH 一方面影响酶的活性中心,另一方面影响底物的解离状态,使酶的空间构象和底物的表面性质发生改变,从而影响酶和底物的特异性结合[28],进而影响特定功能肽段的生成量。中性蛋白酶的适宜pH 为5.5~7.5[29]。由图3 可知:pH 在6.0~7.5范围内,水解度、氮回收率和XOD 抑制活性均先增大后减小,且当pH 为7.0 时,氮回收率和XOD 抑制活性均达到最大值(P<0.05)。而鹅肌肽含量先降低后升高,肌肽含量逐渐升高,与XOD 抑制活性变化规律不一致。综合考虑氮回收率和XOD 抑制活性,选定酶解的最佳pH为7.0。
2.2.4 酶解时间对酶解效果的影响
在料水比为1∶3 时,以500 U/g 的加酶量在pH为7.0 和温度为50 ℃条件下酶解鲣鱼背腹肉,考察不同酶解时间对水解度、氮回收率、XOD 抑制活性及肌肽、鹅肌肽含量的影响。

图3 酶解pH对鲣鱼背腹肉酶解效果的影响Fig.3 Effect of pH on enzymatic hydrolysis of dorsal and ventral muscle in skipjack tuna
由图4 可知:水解度随着酶解时间的延长而先缓慢增大后缓慢减小,4 h时,水解度达最大,酶解反应基本结束,5 h 与4 h 时的水解度之间无显著性差异(P>0.05)。这是由于随着酶解反应的不断进行,蛋白酶酶切位点逐渐减少,同时,酶解产生的肽段会与鱼肉蛋白竞争成为反应底物,降低酶解效率[30]。氮回收率的变化趋势与水解度基本一致,且酶解5 h时达到最大,为82.56%(P<0.05)。对比酶解4 h和5 h结果可知,XOD抑制活性和肌肽、鹅肌肽含量均无显著性差异(P>0.05),且XOD抑制活性在5 h时达到最大,为63.48%。因此,综合考虑氮回收率及XOD抑制活性,最佳酶解时间为5 h。
2.3 响应面优化试验结果
2.3.1 响应面优化模型的建立及方差分析
由单因素试验结果发现,在设定的因素范围内,酶解时间对各指标的影响不明显,加酶量、酶解温度和酶解pH 的影响相对明显。因此,固定酶解时间为5 h,以水解度(Y1)、氮回收率(Y2)、XOD 抑制活性(Y3)及肌肽含量(Y4)、鹅肌肽含量(Y5)为响应值,按照Box-Behnken原理,设计3 因素3 水平的响应面试验。试验设计如表3 所示,试验结果见表4。
用Design Expert 8.0 对试验结果进行多元回归拟合,得到水解度、氮回收率、XOD 抑制活性、肌肽和鹅肌肽含量对于加酶量(A)、酶解温度(B)、酶解pH(C)的二次回归方程:

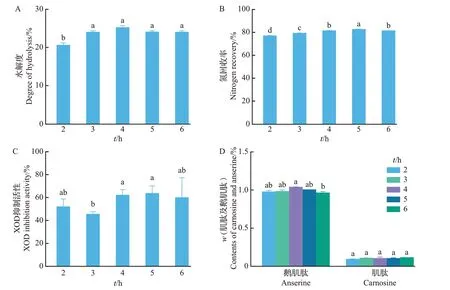
图4 酶解时间对鲣鱼背腹肉酶解效果的影响Fig.4 Effect of time on enzymatic hydrolysis of dorsal and ventral muscle in skipjack tuna

表3 酶解工艺优化的响应面试验因素与水平Table 3 Factors and levels of response surface test for enzymatic hydrolysis optimization
对拟合的回归模型方程进行方差分析。以水解度为考量指标,其回归模型极显著(P=0.000 1<0.01),失拟项不显著(P=0.980 8>0.05),R2=0.972 8,且A、B2、C2为显著性影响因素,各因素对水解度影响强弱顺序为加酶量>酶解温度>酶解pH;氮回收率的回归模型极显著(P=0.000 4<0.01),失拟项不显著(P=0.274 6>0.05),R2=0.959 7,A、C、A2、B2、C2为显著性影响因素,各因素对氮回收率影响强弱顺序为加酶量>酶解pH>酶解温度;XOD抑制活性的回归模型极显著(P<0.001),失拟项不显著(P=0.386 2>0.05),R2=0.992 7,且A、C、BC、A2、B2、C2为显著性影响因素,在各影响因素中,加酶量对XOD 抑制活性的影响最大,其次是酶解pH;肌肽含量的回归模型无显著性(P=0.077 4>0.05),与单因素试验中肌肽含量无明显变化趋势一致;鹅肌肽含量的回归模型极显著(P=0.002 4<0.01),失拟项不显著(P=0.080 1>0.05),R2=0.933 5,且A、C、AC、B2为显著性影响因素,各因素对鹅肌肽含量影响强弱顺序为加酶量>酶解pH>酶解温度。
2.3.2 响应面图分析
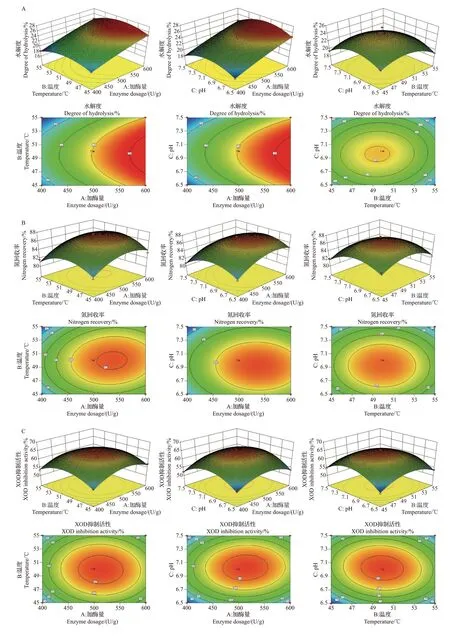
为了更直观考察各因素之间的交互作用对水解度、氮回收率、XOD抑制活性、肌肽及鹅肌肽含量的影响,绘制各因素交互作用的三维(three dimensions,3D)响应面图,结果如图5所示。
等高线的形状可以反映各因素交互作用的显著性,其中:椭圆形代表交互作用显著,圆形代表不显著,三维立体图的陡峭程度反映各因素对响应值的影响[31]。由图5A可知:AB和AC的等高线不呈现椭圆形,BC的等高线变化坡度小,表明加酶量、酶解pH和酶解温度的两两交互作用不显著;由三维立体图可知,在各因素中,加酶量对水解度的影响最为显著,表现为响应曲面坡度陡峭,随着加酶量的增加水解度呈增大的趋势,这与单因素试验结果一致,而酶解温度和酶解pH的影响相对较弱,但其最佳水平都在试验范围内。

表4 酶解工艺优化的响应面试验设计及结果Table 4 Response surface design and experimental results for enzymatic hydrolysis optimization
由图5B可知:加酶量、酶解温度和酶解pH的等高线近似为椭圆形,表明彼此之间均为显著的交互作用;同时根据三维立体图可知,3个因素的最佳水平均在试验范围内。加酶量对氮回收率的影响大于酶解温度和酶解pH对氮回收率的影响,响应曲面坡度陡峭。当酶解温度或酶解pH保持不变时,随着加酶量的增加,氮回收率呈先增大后减小的趋势。
由图5C 可知,鲣鱼背腹肉酶解液的XOD 抑制活性的最大值出现在各因素的中心值处,说明加酶量过大、酶解pH过高、酶解温度过高都不利于制备获得具有较强XOD抑制活性的鲣鱼肽,其原因可能是加酶量过大导致蛋白过度酶解,使有活性的肽段深度降解而失去活性,同时pH 和温度过高影响中性蛋白酶活性,不利于酶解反应的顺利进行。
结合图5D和5E可知,酶解pH、加酶量和酶解温度的交互作用对提高肌肽和鹅肌肽含量不显著,这可能是肌肽和鹅肌肽是以游离的形式存在于细胞中[32],通过酶解可以一定程度裂解细胞,但是释放程度与酶解条件无直接关系,这一结果与单因素试验结果中各因素的变化与肌肽、鹅肌肽含量无直接相关性一致。
2.3.3 肌肽、鹅肌肽含量与XOD 抑制活性的相关性分析
由单因素及响应面试验结果可以发现,肌肽、鹅肌肽含量与XOD抑制活性不存在明显的量效关系。为了进一步研究二者含量与XOD 抑制活性的相关性,对响应面试验数据进行皮尔逊相关性分析。
由表5可知,鲣鱼背腹肉酶解产物的XOD抑制活性与肌肽或鹅肌肽含量无相关性,这表明鲣鱼背腹肉酶解产物中具有XOD 抑制活性的是其他小分子肽。朱俊颖[33]提出,鹅肌肽的降尿酸机制在于它能够激发次黄嘌呤磷酸核糖基转移酶的活性,而这种酶能够再次利用嘌呤,从而减少嘌呤代谢生成尿酸。因此,虽然肌肽或鹅肌肽含量高低不影响酶解产物的XOD抑制活性大小,但产物中含有较多肌肽或鹅肌肽仍然是体内起到良好降尿酸作用所需要的。
2.3.4 酶解最优工艺条件分析
利用Design Expert 8.0 软件,以水解度、氮回收率、XOD 抑制活性、肌肽及鹅肌肽含量为响应值并赋予相同的权重,得出酶解最优条件:加酶量为489.86 U/g,酶解温度为49.5 ℃,酶解pH 为7.08。此时,对应的水解度、氮回收率、XOD 抑制活性、肌肽和鹅肌肽含量(以干基计)的预测值分别为23.69%、86.59%、64.56%、0.38%和1.36%。
基于XOD抑制活性与肌肽、鹅肌肽含量不存在相关性的结论,以水解度、氮回收率及XOD 抑制活性作为响应值并赋予相同的权重,重新优化酶解的最优条件,得到最佳工艺:加酶量为522.78 U/g、酶解pH 为6.98、酶解温度为49.9 ℃。此时,对应的水解度、氮回收率、XOD 抑制活性的预测值分别为24.76 %、87.15%、64.84%。
由于本文重点关注酶解制备获得鲣鱼XOD 抑制肽,因此不考虑水解度、氮回收率时,得到的优化工艺为:加酶量513.22 U/g、酶解pH 7.03、酶解温度49.9 ℃。在此条件下,鲣鱼酶解物XOD抑制活性预测值为64.94%。
综合对比可知,在不同需求下得到的酶解工艺条件差别不大。因此,为验证试验预测结果,按5个响应值的最佳酶解方法条件重复试验3 次,得到实际的水解度为22.38%,氮回收率为83.31%,XOD抑制活性为62.26%(以氮含量计),肌肽和鹅肌肽含量分别为0.05%和2.45%。可见,该回归模型可以较好地预测鲣鱼蛋白的酶解情况。
2.4 肽分子质量分布
利用高效液相色谱法测定最佳条件下制备的鲣鱼背腹肉酶解产物的分子质量分布情况,结果见图6。酶解产物分子质量大于3 000 Da的组分仅占0.17%,超过95%组分的分子质量低于1 000 Da,说明酶解液中发挥XOD 抑制活性的物质主要是小分子的肽段。LI等[34]以核桃粉为原料,通过酶解制备、分离纯化及分析鉴定后得到2个分子质量小于1 000 Da 的肽段,它们均能阻止底物进入XOD 疏水基团通道,从而抑制XOD 活性。MUROTA 等[35]利用碱性水解酶水解鲨鱼软骨得到的XOD 抑制肽是分子质量为686.64 Da 的五肽,与酶解粗提物相比,其XOD抑制活性提高了50倍。HE等[36]从鲣鱼酶解物中分离鉴定出13种具有XOD抑制活性的二肽和三肽,其分子质量均小于1 000 Da。本研究结果与他们的报道相类似。

图6 鲣鱼背腹肉酶解产物分子质量分布情况Fig.6 Molecular mass distribution of hydrolysates of dorsal and ventral muscle in skipjack tuna
3 结论
本研究确定了酶解鲣鱼制备XOD 抑制肽的最佳工艺:采用中性蛋白酶,加酶量为489.86 U/g、酶解pH 为7.08、酶解温度为49.5 ℃,酶解时间为5 h。在此条件下,水解度为22.38%,氮回收率为83.31%,XOD 抑制活性为62.26%(以氮含量计),肌肽和鹅肌肽含量分别为0.05%和2.45%(以干基计),实测结果与预测值基本一致。由本法所得的鲣鱼XOD抑制肽以分子质量低于1 000 Da 的寡肽为主。此外,XOD 抑制活性与肌肽或鹅肌肽含量无相关性,推测鲣鱼背腹肉酶解产物中具有XOD 抑制活性的是其他小分子肽。本研究表明,鲣鱼是制备XOD抑制肽的优质来源,且优化后的酶解工艺条件操作简单,可为工业化生产鲣鱼XOD抑制肽提供理论参考和技术支持。
