蜂王浆蛋白体外消化产物对胃癌细胞SGC-7901增殖和凋亡的影响及其可能机制
2019-12-04王天石王馨梦付莉
王天石,王馨梦,付莉*
(1.锦州医科大学食品科学与工程学院,辽宁 锦州121000;2.锦州医科大学生物化学与分子生物学教研室,辽宁 锦州121000)
胃癌是全球范围内常见的恶性肿瘤,是消化系统疾病中发病率最高的肿瘤之一[1]。目前,临床治疗胃癌的主要手段包括手术切除、放疗、化疗等[2],其中化疗药物主要为小分子药物,具有较高的毒副作用。为降低化疗药物的毒副作用并延长患者生存期,临床上常采用具有抗肿瘤活性的食品进行辅助治疗。因此,开发出具有抑制肿瘤作用的食品,利用食品进行防癌和抗癌更具有实际意义。当今很多国家都投入巨款开发和使用抗肿瘤食品[3],我国也逐渐开始重视该方面的研究。
蜂王浆是由5~15 日龄的成年工蜂上颚腺、咽下腺和脑后腺分泌的一种浆状黏稠物质,是蜂王幼虫整个发育期和雄蜂幼虫发育前期的唯一食物,营养非常丰富[4-5]。蜂王浆主要作为保健食品、膳食补充剂及化妆品的原材料,并有潜力成为治疗药物的原材料[6]。营养学家认为,蜂王浆具有多种生物活性,如抗肿瘤[7]、抗氧化[8]、增强记忆力[9]、调节免疫[10]、抗菌[11]、修复组织损伤[12-13]等。蛋白质是生物生长发育所必需的营养物质,而蜂王浆的重要医疗保健作用和生物学功能如抗肿瘤、抗氧化、抗菌等,可能与其中的蜂王浆蛋白密切相关[14]。JIANG 等[15]通过实验发现,蜂王浆蛋白对人胚肺成纤维细胞具有抗衰老作用;彭瑜等[16]通过实验证实,蜂王浆冻干粉可以提高小鼠脾细胞的增殖能力。
蛋白质作为人体必需的营养物质,进入人体后会被胃蛋白酶、胰蛋白酶、肠肽酶水解,形成多肽、小肽、氨基酸等,其中小肽具有多种生理活性,如抑制细胞变性、激活细胞活性、修复人体变性细胞等,并且具有低毒性、高活性、易吸收、易穿透肿瘤细胞等特点[17]。因此,本文通过体外消化模拟实验,探究蜂王浆蛋白体外消化产物对胃癌细胞的影响作用,为其对抗肿瘤机制研究提供实验依据,为天然抑制肿瘤细胞物质的筛选提供方向。
1 材料与方法
1.1 实验材料
蜂王浆(黑龙江省尚志市密山蜂场);胃癌细胞SGC-7901、肾上皮细胞293T(上海吉凯基因化学技术有限公司);盐酸、氢氧化钠、二甲基亚砜、胃蛋白酶(3 000 U/g)、胰蛋白酶(3 000 U/g)、磷酸盐缓冲液(均为分析纯,购自国药集团化学试剂有限公司);胰酶、改良杜氏伊格尔(DMEM)培养基(美国Hyclone 公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]粉末、胎牛血清(北京鼎国昌盛生物技术有限公司);青霉素、链霉素(北京百奥莱博科技有限公司);p53(53 kDa)抗体、PARP-1(120 kDa)抗体(英国Abcam公司)。
1.2 实验仪器
分析天平,超声波振荡器(KQ3200DB 型,江苏省昆山市超声仪器有限公司),立式高速冷冻离心机(湖南赫西仪器装备有限公司),pH计(PHS-3C型,上海雷磁仪器厂),真空冷冻干燥机(LGJ-18 型,北京松源华兴生物技术有限公司),电热鼓风恒温箱(DHG-9245A型,上海一恒科学仪器有限公司),倒置显微镜(DMI4000B型,德国莱卡光学仪器有限公司),细胞培养箱(德国Heraeus 公司),低速离心机(L500型,湖南湘仪离心机有限公司),酶联免疫检测仪(HBS-1096A 型,南京德铁实验设备有限公司),流式细胞仪(BD FACSCalibur 型,美国Becton Dickinson公司)。
1.3 实验方法
1.3.1 蜂王浆蛋白体外消化产物的制备及其消化率的测定
采用蓝瑞阳等[18]的方法并加以修改:40 g 蜂王浆→碱液浸提(料液体积比1∶8,提取90 min,pH 10,提取温度40 ℃)→离心分离(去沉淀)→调节提取液pH值至等电点4.4,沉淀1 h→离心分离→去上清液,留沉淀→透析→冷冻干燥→蛋白制备物。
采用佟立涛等[19]的方法:用蒸馏水配制一定浓度的蜂王浆蛋白溶液,用1 mol/L HCl 调节溶液pH值为2.0,加入胃蛋白酶,在37 ℃恒温条件下消化酶解2 h。用0.1 mol/L NaHCO3溶液调节pH 值至5.3,于100 ℃、5 min后终止酶反应,加入胰蛋白酶,再用1 mol/L NaOH调节溶液pH值至7.8,在37 ℃恒温条件下消化酶解2 h;于100 ℃、5 min 后终止酶反应,冷却,离心,收集上清液,采用考马斯亮蓝法(Bradford)检测蛋白浓度,然后冷冻,干燥,用0.1%二甲基亚砜(dimethyl sulfoxide,DMSO)溶解剂稀释至适量浓度,测定其对胃癌细胞的影响。
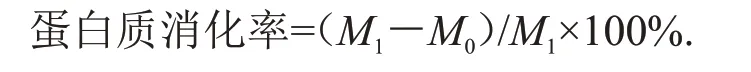
式中:M1为样品的蛋白质总质量,g;M0为水解液中的蛋白质质量,g。
1.3.2 细胞培养
使用含有10%胎牛血清的DMEM培养基(含有100 μg/mL 青霉素和50 μg/mL 链霉素)培养胃癌细胞SGC-7901 和肾上皮细胞293T。培养条件为在含5%CO2细胞培养箱中37 ℃培养。细胞密度达到约80%时进行传代[20]。
1.3.3 细胞形态学观察
将胃癌细胞SGC-7901 和肾上皮细胞293T 接种于6 孔板中,调整细胞密度约为2.5×105个/孔,置于37 ℃、5%CO2细胞培养箱中培养过夜,当细胞密度达到70%~80%时,在胃癌细胞中加入不同质量浓度(0.05、0.1、0.2 mg/mL)的蜂王浆蛋白体外消化产物进行诱导,在肾上皮细胞中加入0.2 mg/mL 的蜂王浆蛋白体外消化产物进行诱导。48 h 后,在倒置显微镜下观察细胞形态变化并拍照记录[21]。
1.3.4 集落形成实验
将胃癌细胞SGC-7901 和肾上皮细胞293T 按1 000个/孔接种于6孔板中,在胃癌细胞中分别加入0.05、0.1、0.2 mg/mL蜂王浆蛋白体外消化产物进行诱导,在肾上皮细胞中加入0.2 mg/mL 的蜂王浆蛋白体外消化产物进行诱导。连续培养7~10 d 后,当培养孔中出现肉眼可见的克隆时,停止培养。吸弃上清液,用磷酸盐缓冲溶液(phosphate buffered solution,PBS)清洗2~3次。加入4%多聚甲醛固定10 min,吸弃多聚甲醛,用PBS冲洗2~3次,最后每孔用结晶紫染色液染色15 min,吸弃染色液,用PBS清洗2次后,用相机拍照观察集落形成实验结果[22]。
1.3.5 MTT 实验
收集处于对数生长期的胃癌细胞SGC-7901,调整细胞浓度,使用96 孔板进行实验,每孔加入100 μL 细胞悬液,细胞浓度约为2 000 个/孔。于37 ℃、5%CO2细胞培养箱中孵育,待细胞贴壁后,加入不同质量浓度(0.05、0.1、0.2 mg/mL)的蜂王浆蛋白体外消化产物,另设DMSO 空白对照组,孵育24~48 h后,在倒置显微镜下观察。然后,每孔加入15 μL MTT 溶液(质量浓度为5 mg/mL),继续培养4 h后,加入150 μL DMSO,置于摇床上振荡10 min,使结晶物充分溶解。最后在酶联免疫检测仪上于570 nm 处测量各孔的吸光度。同时,设置调零孔(培养基、MTT、DMSO)。

1.3.6 细胞周期的流式细胞术检测
取对数生长期的胃癌细胞SGC-7901,接种于6孔板中,每孔2 mL,于37 ℃、含5%CO2培养箱中培养过夜,弃去孔内旧培养基,加入含有不同质量浓度(0.05、0.1、0.2 mg/mL)蜂王浆蛋白体外消化产物的新鲜培养基溶液,每孔2 mL,于37 ℃、5%CO2培养箱中培养48 h。收集细胞,1 000 r/min离心5 min,弃去上清液,加PBS 重悬、润洗1 次,再1 000 r/min离心5 min,弃去上清液,加入1 mL 预冷的70%乙醇,轻轻混匀,4 ℃固定至少20 min,接着1 000 r/min离心5 min,用预冷的PBS 润洗2 次,弃去PBS,加1 mL 碘化丙啶(PI)染液,37 ℃水浴30 min,最后3 000 r/min离心30 s,去掉部分上清液,与沉淀混匀后用流式细胞仪检测[23]。
1.3.7 细胞凋亡的流式细胞术检测
取对数生长期的胃癌细胞SGC-7901,接种到6孔板中,每孔2 mL,培养24 h后,加入不同质量浓度的蜂王浆蛋白体外消化产物,培养48 h后收集各组细胞,用预冷的PBS洗涤1次,然后加入1 mL结合缓冲液(1×)吹打混匀,离心10 min,弃上清液,再加入1 mL 结合缓冲液(1×)混匀,调整细胞浓度至1×106mL-1。每管取100 μL 悬液,加5 μL 膜联蛋白V-PE(细胞凋亡检测试剂盒)轻轻混匀,室温避光孵育10 min,再加5 mL 7-氨基放线菌素D(7-AAD)染液轻轻混匀,室温避光孵育5 min,加入500 μL PBS混匀,1 h内用流式细胞仪检测[24]。
1.3.8 蛋白表达的蛋白质印迹法检测
收集经不同质量浓度蜂王浆蛋白体外消化产物诱导后的胃癌细胞SGC-7901,用PBS清洗,加入细胞裂解液,在冰上裂解30 min,1.2×104r/min 离心20 min 后收集上清液,进行蛋白定量,然后加入5×上样缓冲液煮样5 min,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。将蛋白转移至聚偏二氟乙烯(polyviny-lidene fluoride, PVDF)膜上,室温封闭2 h,与一抗(1∶5 000 p53、1∶5 000 PARP-1和1∶1×104actin)4 ℃孵育16~18 h,用含吐温的Tris缓冲盐水(Tris buffered saline with Tween,TBST)洗膜3次,每次5 min,与二抗室温孵育2 h,取出PVDF膜,用TBST 洗3 次,每次5 min。最后一次洗膜后,留少量TBST,将增强化学发光(enhanced chemiluminescence,ECL)试剂盒内的A 液与B 液等体积混合后,均匀滴在PVDF膜上,反应适当时间并分析[25]。采用Image J 软件计算蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/肌动蛋白(actin)条带灰度值。
1.3.9 统计分析
采用SPSS 22.0 统计软件进行数据处理,计量资料符合正态分布,以平均值±标准差表示,多组比较采用单因素方差分析,组间比较采用t检验,每组实验重复3次。
2 结果与分析
2.1 提取的蜂王浆蛋白消化产物的消化率
体外消化模拟实验可以准确模拟体内消化生理过程,操作简单且重复性好。经检测,样品中蛋白质总量为2 g,经过胃蛋白酶和胰蛋白酶酶解作用后,水解液中可溶性蛋白质质量为0.57 g,蜂王浆蛋白的体外消化率达到71.5%。从此结果可以得知,蜂王浆蛋白是一种易消化的物质,适用于人体的消化吸收。
2.2 蜂王浆蛋白体外消化产物对细胞形态学的影响
如图1 所示:与DMSO 对照组相比,蜂王浆蛋白体外消化产物对肾上皮细胞293T 形态、密度均无可见影响;DMSO 对照组胃癌细胞SGC-7901 形态饱满,排列紧密,而经过蜂王浆蛋白体外消化产物干预48 h 后的胃癌细胞发生明显皱缩,密度降低,数目减少。且在蜂王浆蛋白体外消化产物质量浓度为0.2 mg/mL 时,胃癌细胞数目最少,皱缩最为明显,0.1 mg/mL 质量浓度的影响次之。由此得出,在诱导时间相同情况下,蜂王浆蛋白体外消化产物对胃癌细胞形态的影响具有浓度依赖趋势,对正常细胞可能未产生影响,而对胃癌细胞具有抑制作用,且抑制效果与蜂王浆蛋白浓度呈正相关。
2.3 蜂王浆蛋白体外消化产物对细胞集落形成能力的影响
如图2~3 所示,在诱导时间相同条件下,与DMSO对照组相比,蜂王浆蛋白体外消化产物对肾上皮细胞293T的集落形成能力没有抑制效果,反而有促进作用,而对胃癌细胞SGC-7901 的集落形成能力具有明显抑制效果,其中在蜂王浆蛋白体外消化产物质量浓度为0.2 mg/mL 时,抑制效果最为明显,质量浓度为0.1 mg/mL时效果次之。由此得知,蜂王浆蛋白体外消化产物对胃癌细胞的集落形成能力具有抑制作用,且具有浓度依赖趋势。
2.4 蜂王浆蛋白体外消化产物对胃癌细胞增殖的影响

图1 不同质量浓度蜂王浆蛋白体外消化产物对细胞形态的影响Fig.1 Effect of different concentrations of royal jelly protein in vitro digestion products on cell morphology

图2 不同质量浓度蜂王浆蛋白体外消化产物对细胞集落形成能力的影响Fig.2 Effect of different concentrations of royal jelly protein in vitro digestion products on cell colony forming ability

图3 不同质量浓度蜂王浆蛋白体外消化产物对细胞集落形成数目的影响Fig.3 Effect of different concentrations of royal jelly proteinin vitro digestion products on cell number
由表1可知,与DMSO对照组相比,蜂王浆蛋白体外消化产物对胃癌细胞的增殖具有显著抑制作用,抑制率随浓度的增加和时间的延长逐渐增加,其中,在质量浓度为0.2 mg/mL时,经24 h和48 h培养后蜂王浆蛋白体外消化产物对胃癌细胞抑制率最高,分别达到(57.58±3.48)%和(62.84±1.98)%。由此表明,蜂王浆蛋白体外消化产物对胃癌细胞的增殖抑制能力具有时间和浓度依赖性。
2.5 蜂王浆蛋白体外消化产物对胃癌细胞周期的影响
本实验采用流式细胞术对经蜂王浆蛋白体外消化产物干预后的细胞周期分布进行了检测。如图4及表2所示,与DMSO空白对照组相比,随着蜂王浆蛋白质量浓度的升高,胃癌细胞SGC-7901 中G1期细胞占比升高,S期细胞占比降低,差异具有统计学意义(P<0.05)。这表明蜂王浆蛋白作用于SGC-7901 细胞48 h 后,DNA 合成受阻,细胞减少,细胞增殖受到抑制。
2.6 蜂王浆蛋白体外消化产物对胃癌细胞凋亡的影响
本实验采用7-AAD和PE双染法检测细胞凋亡率,结果如图5 所示。添加蜂王浆蛋白体外消化产物进行诱导后,与空白对照组相比,各组早期凋亡率和晚期凋亡率均有增加;当蜂王浆蛋白体外消化产物质量浓度为0.2 mg/mL时,凋亡率最高。SGC-7901 细胞凋亡率随蛋白体外消化产物质量浓度升高而逐渐增加,表明蜂王浆蛋白体外消化产物可以促进胃癌细胞SGC-7901的凋亡,且具有剂量-效应关系。

表1 不同质量浓度蜂王浆蛋白体外消化产物对胃癌细胞增殖抑制率的影响Table 1 Effect of different concentrations of royal jelly protein in vitro digestion products on proliferation inhibition rate of gastric cancer cells

表2 不同质量浓度蜂王浆蛋白体外消化产物诱导48 h后对胃癌细胞周期的影响Table 2 Effects of different concentrations of royal jelly protein in vitro digestion products on cycle of gastric cancer cells induced for 48 h

图4 不同质量浓度蜂王浆蛋白体外消化产物诱导48 h后胃癌细胞的流式细胞周期图Fig.4 Cycles of gastric cancer cells induced by different concentrations of royal jelly protein in vitro digestion products for 48 h by flow cytometry

图5 不同质量浓度蜂王浆蛋白体外消化产物诱导胃癌细胞48 h后的流式细胞凋亡图Fig.5 Apoptosis of gastric cancer cells induced by different concentrations of royal jelly protein in vitro digestion products for 48 h by flow cytometry
2.7 蜂王浆蛋白体外消化产物对胃癌细胞SGC-7901 信号通路蛋白p53 和PARP-1 的影响
如图6 所示:0.1 mg/mL 的蜂王浆蛋白体外消化产物能显著激活p53 蛋白的表达(P<0.05),且随着蛋白消化产物质量浓度的升高,p53 蛋白表达量增加。0.05 mg/mL 的蜂王浆蛋白体外消化产物能显著下调PARP-1 蛋白的表达(P<0.05),且随着蛋白体外消化产物质量浓度的增加,PARP-1 蛋白表达量减少。此结果从蜂王浆蛋白对胃癌细胞SGC-7901 的作用方面进行了进一步验证,表明蜂王浆蛋白体外消化产物对胃癌细胞的增殖确实具有抑制作用,说明蜂王浆蛋白具有成为一种新型抗胃癌食品添加剂的潜力。
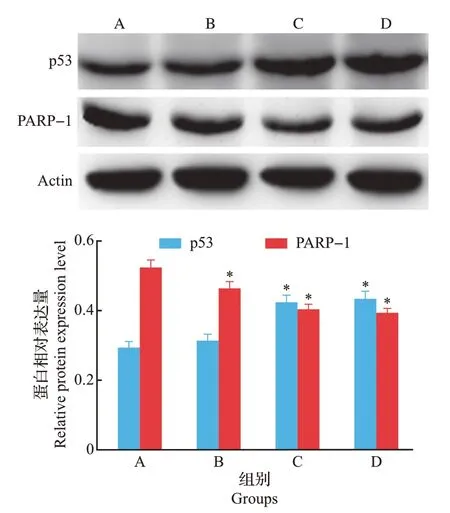
图6 不同质量浓度蜂王浆蛋白体外消化产物对胃癌细胞中p53和PARP-1表达的影响Fig.6 Effect of different concentrations of royal jelly protein in vitro digestion products on expression levels of p53 and PARP-1 in gastric cancer cells
3 讨论
胃癌是临床上威胁人类健康最常见的消化系统恶性肿瘤之一,其发病率和病死率位于所有肿瘤的第6位,严重威胁着人类健康[26]。在食品领域,已有采用黑茶藨子(黑加仑)、绿豆、猕猴桃等多种天然产物来探究对胃癌细胞影响的研究。本实验中,以蜂王浆蛋白为原料,采用体外消化模拟实验制备蜂王浆蛋白体外消化产物,通过细胞学形态观察和集落形成实验发现,蜂王浆蛋白体外消化产物对肾上皮细胞293T的形态没有造成影响,而对胃癌细胞SGC-7901的形态和集落形成能力具有明显抑制效果。通过MTT实验发现,蜂王浆蛋白体外消化物对SGC-7901 的生长增殖具有明显的抑制作用,且具有时间、剂量依赖性,与王勇姿等[27]通过实验得出蜂王浆蛋白对肝癌细胞增殖的影响效果一致。采用流式细胞术检测细胞周期及凋亡过程发现,经蜂王浆蛋白体外消化产物诱导后,胃癌细胞SGC-7901中G1期细胞占比升高,S 期细胞占比降低,DNA 合成受阻,引发细胞凋亡增多。这与陈立军等[28]通过实验得出蜂王浆在体内抑制肿瘤的机制与其促进肿瘤组织坏死和细胞凋亡有关的结论一致。
p53蛋白被称为基因组的守护者,当DNA发生损伤时,p53 在DNA 的损伤修复中起着重要作用,是肿瘤的抑制基因[29]。PARP-1 是聚腺苷二磷酸核糖聚合酶家族中的一员,其催化活性约占家族酶活性的90%以上[30],在多种癌细胞及组织中呈现高表达。本实验中,蜂王浆蛋白显著上调了SGC-7901细胞中p53 蛋白的表达,同时,下调了PARP-1 蛋白的表达,且蛋白表达水平与蜂王浆浓度相关。
4 结论
本实验表明蜂王浆蛋白体外消化产物可以抑制胃癌细胞的增殖并引起凋亡,其机制可能与p53蛋白表达上调、PARP-1蛋白表达下调密切相关,为胃癌的药物治疗提供了实验依据。因此,蜂王浆蛋白体外消化产物作为新一代抗肿瘤天然食品具有广阔的开发应用前景。
