纳米氧化石墨烯诱导人类支气管上皮细胞DNA氧化与甲基化的实验研究
2019-12-03彭长凤柯跃斌
彭长凤,谢 杏,柯跃斌*
(深圳市疾病预防控制中心,广东 深圳 518020)
纳米氧化石墨烯(nano-graphene oxide,NGO)是一类应用广泛的新兴非金属纳米材料,是一种由碳原子组成的六角形蜂巢晶格的二维结构材料。石墨烯具有独特的电学机械性能、良好的导热导电性、超大的比表面积以及潜在的生物相容性,被广泛应用于材料、电子、能源、光学以及生物医学等领域,如电化学设备、能源存储、细胞成像、药物输送和生物传感器等[1-2]。随着石墨烯大规模生产和广泛应用,其生物安全性问题也越来越受到关注。近期研究发现,NGO可能具有表观遗传毒性[3-4]。
呼吸系统是石墨烯的直接作用系统,石墨烯诱发肺损伤是石墨烯毒性的主要症状[5-6]。人体吸入的绝大多数石墨烯纳米颗粒会穿过上呼吸道进入到肺部,在肺部沉积,呼吸道检测到的石墨烯纳米颗粒沉积率约为4%[1-3,7-8]。石墨烯的粒径大小与氧化程度直接影响其细胞毒性,且存在明显的浓度依赖性,但现有针对NGO致支气管上皮细胞损伤的实验研究较少,且作用机制尚不清楚[9-10]。因此,本研究观察特定粒径和剂量的NGO在人类支气管上皮细胞(16HBE)中产生的DNA氧化与甲基化作用,从而评估NGO所致的表观遗传修饰作用,为纳米氧化石墨烯遗传毒性效应研究、机制探讨以及安全性评价提供参考依据。
1 材料与方法
1.1 试剂和仪器
薄层NGO购于美国Cheap Tubes公司;ROS检测试剂盒购于上海酶联生物;DMEM培养基、MEM培养基和10%胎牛血清购于美国Gibco公司;人支气管上皮16HBE细胞购于美国ATCC公司;脱氧胞苷、5-甲基脱氧胞苷标准品均由Sigma公司提供。其他试剂包括:胰蛋白酶冻干粉(美国Sigma公司);基因组DNA纯化试剂盒(美国Tiangen公司);DNA甲基化定量试剂盒(美国Epigentek公司);DNA羟甲基化定量试剂盒(美国Zymo Research公司);三羟甲基氨基甲烷(Tris)乙二胺四乙酸(EDTA)缓冲液(TE缓冲液,美国Sigma公司);WB试剂盒(日本Wako公司);10%小牛血清(美国Hyclone公司);核酸酶P1(日本Yamasa公司);离子交换树脂(日本Muromachi Kagaku公司)。实验中使用的主要仪器有:Ultrafree-Probind滤器(美国Millipore公司);电泳仪(美国BIO-RAD公司);高效液相色谱柱(美国Beckman Ultrasphere-ODS公司);电化学检测器(Coulochem II,美国ESA Inc公司);透射电子显微镜(TEM,日立H-7650)。
1.2 石墨烯纳米材料的表征
1.2.1 NGO表征NGO粉剂,加入蒸馏水超声稀释为1 000 mg/L的储备液备用。纳米材料的表征通过TEM和拉曼光谱鉴定,观察NGO的表面形貌结构及粒径分布。
1.2.2 粒径分布及纯度使用NICOMP 380ZLS Submicron Particle Sizer测定NGO溶液的有效粒径分布和Zeta电位(30 mg/L,pH=7.4)。并使用激光粒度分布仪检测NGO与MEM培养基混合24 h后的中位粒径(D50),以检测用于染毒细胞时的有效粒径。
使用ICP-MS Thermo Elemental X7检测NGO化学纯度,包括重金属元素等。检测结果显示,样品纯度达到99.99%以上,该纳米NGO符合实验要求。
1.3 细胞培养及NGO染毒实验分组
1.3.1 细胞培养16HBE细胞,复苏后按每孔1.25×106个培养于6孔板中。采用DMEM培养液,含10%小牛血清,100 IU/mL青霉素和100 μg/mL链霉素,但不含有酚红,以避免实验中因酚红而产生的氧化效应的干扰。置于37℃、CO2体积分数为5%的培养箱中培养,0.25%胰蛋白酶消化传代。
1.3.2 NGO染毒实验分组每组设3个平行样孔,根据既往的细胞毒性试验确定细胞暴露浓度。阳性对照组以3 μmol/L DNA甲基转移酶抑制剂5-氮杂-2′-脱氧胞苷(5-aza-2′-deoxycytidine,DAC)预处理24 h,并标记为DAC组;以溶剂平行处理16HBE细胞24 h为阴性对照组。同步培养16HBE细胞至约铺满50%孔底面积时,分别用1.25、2.5、5和10 μg/mL的NGO染毒24 h。染毒完成后检测细胞DNA中8-羟基脱氧鸟嘌呤核苷(8-hydroxydeoxyguanosine,8-OHdG)和 5-甲基胞嘧啶(5-methylcytosine,5-mC)的比例,分析NGO致细胞DNA氧化、甲基化的剂量-效应关系。
1.4 高效液相色谱法检测细胞DNA中8-OHdG比例
16HBE细胞DNA的8-OHdG水平检测方法参考文献[11]。应用WB试剂盒提取细胞DNA,再用核酸酶P1消化DNA,获得核苷形式的8-OHdG,并以Muramac离子交换树脂处理。采用Ultrafree-Probind滤器过滤核苷溶液,并注射入高效液相色谱柱(5 μm,4.6 mm×25 cm)中,用电化学检测器进行操作,流速为1.0 mL/min。流动相包含10 mmol/L Na2HPO4,8%甲醇。DNA中8-OHdG比例用8-OHdG/105dG表示[11]。
1.5 高效毛细管电泳法检测DNA整体甲基化水平
1.5.1 样品处理样品处理和高效毛细管电泳按参考文献[12]并略作修改,样品处理步骤如下:取10 μg DNA,37℃条件下RNAase A消化1 h;用3 mol/L NaAc(pH=5.2)和无水乙醇沉淀DNA。DNA溶于10 μL ddH2O中,沸水中水浴5 min,冰上冷却。在30 mmol/L 的 NaAc中加入 1.5 μL ZnSO4(10 mmol/L)和1.5 μL核酸酶P1(200 U/mL),37 ℃下孵育18 h。在2.5 mol/L 的(NH4)2SO4中加入 1.25 μL Tris(0.5 mol/L,pH=8.3)和0.75 μL碱性磷酸酶(50 U/mL),37 ℃下孵育2 h。10 000 r/min离心5 min,4℃保存待分析。
1.5.2 高效毛细管电泳毛细管电泳仪正极进样,汞灯,紫外检测波长为254 nm;采用70 cm×75 μm的毛细管,有效分离长度为65 cm;电泳缓冲液由48 mmol/L NaHCO3(pH=9.6)及60 mmol/L SDS组成,电泳条件25℃、15 kV,紫外检测波长254 nm;电泳系统先用1.0及0.1 mol/L NaOH平衡3 min,电泳缓冲液用48 mmol/L的NaHCO3(pH=9.6)和60 mmol/L的SDS平衡3 min;采用10 cm高度重力进样30 s。在dA、dT和dG(均为0.50 mmol/L)的混合标准品中逐渐增加dC的量和减少5-mdC的量,以得到5-mdC系列百分比。选择已知dC和5-mdC本底浓度的实际DNA样品各9份,在样品中分别加入0.010、0.015和0.020 mmol/L的3种不同浓度的标准品dC和5-mdC后,再次测定样品中dC和5-mdC的浓度,每种浓度水平重复测3次,计算加标回收率。如图1所示,出峰图基线稳定,两个目的峰dC和5-mdC分离效果很好。由于样品中5-mdC/(5-mdC+dC)的比值非常低,且5-mdC的含量在0.01 mmol/L左右,如果直接测定dC与5-mdC会产生较大误差;本实验中,以5-mdC/(5-mdC+dC)的浓度比值为横坐标,以A5-mdC/(A5-mdC+AdC)峰面积的比值为纵坐标进行定量分析[12],可以直接准确得到样品中DNA整体甲基化的水平结果。

图1 高效毛细管电泳法检测基因组DNA甲基化水平
1.6 数据分析处理
采用SPSS 21.0软件进行统计分析,数据以均数±标准差表示。计量资料组间均数的比较用单因素方差分析,进一步的两两比较采用Dunnett's t检验,检验水准为α=0.05。DNA氧化与DNA甲基化作用的关联性分析采用Pearson相关分析。
2 结果
2.1 NGO纳米颗粒的表征
使用TEM对不同粒径(500 nm和3 μm)的NGO进行直接表征观察和拉曼光谱鉴定。结果显示,本实验材料表征显示NGO符合实验要求,如图2所示。

图2 NGO颗粒的透射电镜分析图
为了确定暴露过程中的真实粒径,将NGO用含血清的MEM培养基稀释到最大的工作浓度,37℃放置24 h,测其有效中位粒径D50为(6.65±0.40)μm。接近厂商标注值。
2.2 NGO染毒对16HBE细胞DNA中8-OHdG比例的影响
预实验研究表明,NGO对16HBE细胞的IC50值为25 μg/mL。16HBE细胞经不同浓度NGO染毒24 h后DNA中8-OHdG的比例如图3所示,在NGO为2.5~10 μg/mL时,试验组细胞DNA中8-OHdG比例显著高于对照组(P<0.05 或 P<0.01),以 10 μg/mL 浓度时为最高。

图3 不同组别16HBE细胞DNA中8-OHdG的比例
2.3 NGO染毒对16HBE细胞DNA总体甲基化水平的影响
经NGO染毒处理24 h后,用HPCE电泳检测16HBE细胞DNA的总体甲基化水平。实验结果如图4,显示NGO可引起16HBE细胞DNA甲基化程度降低,与对照组细胞相比,2.5、5和10 μg/mL NGO组分别降低37.1%、49.7%和46.3%,与对照组间的差异均有统计学意义(P<0.05或P<0.01)。阳性对照组5-aza-dC处理后使16HBE细胞甲基化程度减少53.8%(P<0.01)。
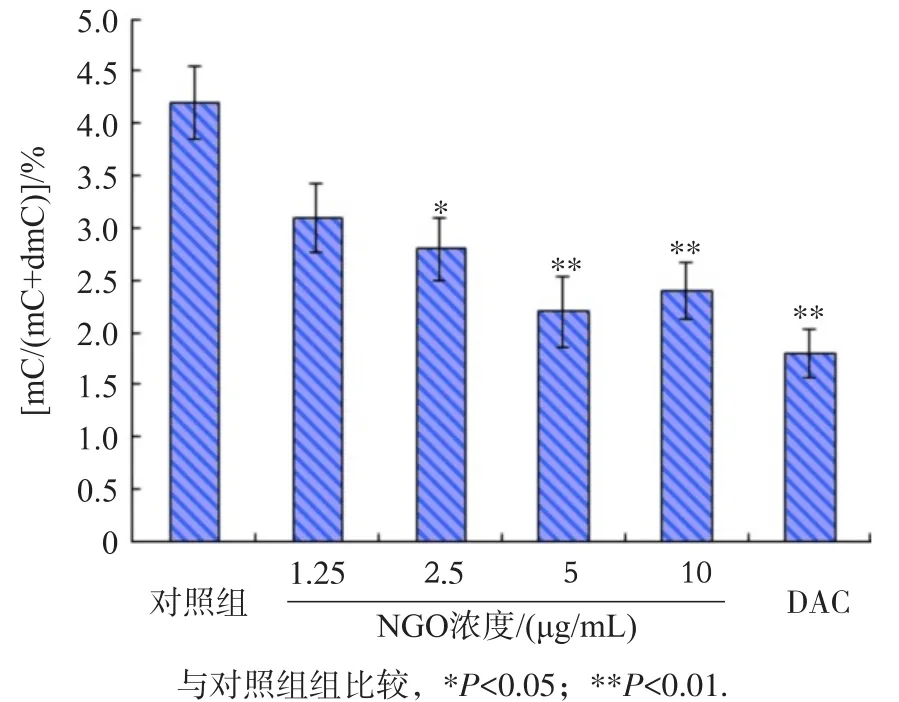
图4 NGO对16HBE细胞DNA总体甲基化水平的影响
2.4 NGO染毒对DNA氧化与DNA甲基化影响的关联性分析
NGO在1.25~10 μg/mL范围染毒后,试验组细胞DNA中8-OHdG比例与细胞基因组总体DNA甲基化水平的潜在关联性,用Pearson相关分析,结果显示此剂量范围内NGO处理后,DNA氧化与DNA甲基化作用间呈负相关(r=-0.69,P<0.01)。
3 讨论
DNA氧化是指机体细胞在内源性和外源性活性氧自由基的作用下,其DNA被氧化生成8-OHdG,它在复制过程中可以与C以外的其它碱基配对形成点突变,8-OHdG已普遍被作为DNA氧化损伤的敏感标志物[11-14]。衰老、癌症、心脑血管疾病等的发生与该损伤有关[11,15]。NGO与细胞相互作用产生过量的ROS是产生急性肺损伤、炎性反应、细胞凋亡、DNA损伤等的主要原因[1]。本次研究发现NGO染毒使16HBE细胞DNA中8-OHdG比例增加,可能是ROS氧化链式反应的结果。据报道,SOD和GSH的活性随着NGO暴露时间和暴露剂量的增加而降低[16]。石墨烯处理细胞后,由ROS介导的MAPK(JNK、ERK、p38)以及TGF-β信号转导通路,以及与凋亡相关信号(bcl-2、caspase-3)及下游基因PARP等被激活[17]。
表观遗传分子机制包括DNA甲基化、RNA干扰、基因沉默、组蛋白修饰等,DNA甲基化是目前研究最多的表观遗传修饰方式。DNA甲基化是哺乳动物细胞最为常见的表观遗传修饰方式,其引起的基因转录沉默与哺乳动物生长发育、避免遗传损伤、基因印记、X染色体静息,以及衰老、癌症的过程之间有密不可分的关系[15,18-19]。
最新研究表明,NGO暴露通过上调甲基转移酶DNMT3B基因改变全基因组甲基化水平[20]。单层石墨烯和少数层石墨烯引起的全基因组甲基化具有剂量依赖性,不同石墨烯衍生物引起的甲基化水平为:羧化石墨烯>胺化石墨烯>石墨烯[4]。本次研究发现纳米NGO引起16HBE细胞甲基化程度降低,与相关研究结果一致。
本研究首次报道了DNA氧化和DNA甲基化作用的关联性,发现DNA氧化与DNA甲基化作用间呈负相关关系,反映出生命现象的复杂性,提示DNA氧化可能是与DNA甲基化密切相关的两个重要的早期分子事件。
然而,造成基因组DNA甲基化水平随NGO剂量增大而降低的机制仍不清楚。有研究表明在CpG二核苷酸序列中出现的8-OHdG对相邻近的胞嘧啶残基的甲基化有很强的抑制作用,并且还能够干扰限制性内切酶对DNA酶切作用[21]。还有研究提示氧化损伤可造成DNA甲基化模式异常,8-OHdG加和物取代正常鸟嘌呤后,可以与甲基化酶结合而竞争性抑制邻近胞嘧啶的甲基化,特别是在新合成的DNA子链中甲基化水平被极度抑制。如果甲醛介导氧化损伤所形成的8-OHdG未被DNA修复系统纠正,就可能破坏固有的甲基化模式,以被动去甲基化的形式,通过DNA的半保留复制造成甲基化的丢失[22-23]。
目前有关石墨烯哺乳动物毒性的研究已在逐步深入,但目前尚缺乏石墨烯与DNA、蛋白质、酶等生物大分子相互作用方式和机制的研究。鉴于目前已经开展了石墨烯对人和小鼠等哺乳动物的毒性研究,今后石墨烯对植物等其他生物的毒性作用也应成为生物安全性评估的内容。
总之,本研究发现DNA氧化与DNA甲基化作用间呈负相关关系,提示DNA氧化可能是与DNA甲基化密切相关的两个重要的早期分子事件。DNA氧化可能导致细胞DNA甲基化水平降低,在化学致突变过程中,DNA氧化可能是影响细胞甲基化的调控路径之一,而DNA甲基化如何反过来影响DNA氧化、二者的时间-剂量-效应关系尚需进一步研究。
