外源H2O2对盐胁迫下小白菜种子萌发和幼苗生理特性的影响
2019-12-03任艳芳何俊瑜韦愿娟
任艳芳, 何俊瑜,*, 杨 军, 韦愿娟
1 常州大学环境与安全工程学院, 常州 213164 2 贵州大学农学院, 贵阳 550025
土壤盐渍化已成为当前全球极其重要的农业与环境问题,有报道表明全球有20%的耕地和33%的灌溉农田受到土壤盐分的影响,且农业生产中不合理的灌溉和过度施肥将进一步加剧土壤次生盐渍化[1]。已有研究表明,盐渍条件下,植物体内会发生渗透胁迫,同时,会造成离子平衡失调或离子毒害、植物体内活性氧的产生与清除代谢紊乱,造成细胞氧化损伤,进而对膜系统造成伤害,叶绿素降解、光合能力下降、营养亏缺等现象[2- 5],从而影响植物正常的生长发育,造成作物产量和品质的下降,严重时甚至导致死亡,阻碍了农业的可持续发展和生态环境建设[6- 7]。因此,探寻提高植物耐盐途径成为国内外的研究热点。
利用外源物质诱导植物产生抗逆性是提高植物抵御不良环境的有效方法。过氧化氢(Hydrogen peroxide, H2O2)是生物体内的一种活性氧分子,也是生物细胞应答逆境胁迫的重要信号分子,广泛参与植物的抗性反应[8- 10],且表现为保护和毒害双重作用,即低浓度H2O2则会诱导植物对逆境胁迫的抗性反应,提高植物的抗逆性,而高浓度H2O2会加速植物细胞的氧化损伤和细胞壁结构蛋白交联,甚至诱导程序性死亡[8, 11- 12]。研究表明外源H2O2处理可以明显缓解铝毒对小麦幼苗根生长的抑制作用[12],调节脯氨酸代谢,增强甜玉米幼苗对铜胁迫的抗性[13]。外源H2O2处理种子可促进淹水胁迫下大豆幼苗体内抗氧化酶活性,降低活性氧对细胞膜的损伤,提高植株的气孔导度、净光合速率和生物量[14]。H2O2叶面喷施处理明显增强干旱胁迫下黄瓜幼苗植株体内的抗氧化能力和渗透调节能力,有效缓解细胞膜脂过氧化程度[15]。较低浓度H2O2预处理可以明显提高盐胁迫下人参植株的株高、光合色素含量以及干物质量,而高浓度H2O2处理则会严重抑制人参植株生长[11]。此外,适宜浓度的H2O2预处理可明显提高盐胁迫下小麦幼苗中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)活性,增加谷胱甘肽和类胡萝卜素含量[16];提高绿豆幼苗体内的抗坏血酸和谷胱甘肽含量,降低丙二醛(MDA)含量和超氧阴离子产生速率,提高植株的耐盐性[17]。也有研究表明H2O2处理可明显增强盐胁迫下草莓植株叶片中抗氧化酶、抗坏血酸和谷胱甘肽合成酶的表达水平,明显提高光合能力[18]。我们的研究表明适宜浓度的H2O2可以提高水稻幼苗抗氧化能力,缓解Cd胁迫伤害[8]。
小白菜(BrassicachinensisL.)是深受人们喜爱的蔬菜之一。近年来随着土壤盐渍化程度的加重,使小白菜的萌发和生长受到明显抑制,产量和品质降低[19]。种子萌发期是小白菜生长周期的开始,在小白菜生长过程中至关重要,影响到后续幼苗的生长发育,而缓解盐胁迫对小白菜种子在萌发过程中的伤害,有利于提高其产量和品质。目前有关H2O2在小白菜耐盐方面的研究还未见报道。为此,本研究探讨盐胁迫下不同浓度的外源H2O2浸种处理对小白菜种子萌发、幼苗生长、膜脂过氧化、活性氧积累、抗氧化酶、渗透调节物质及幼苗Na+和K+选择性吸收的影响,旨在探索利用外源H2O2来缓解盐胁迫对作物的毒害,为农业生产中使用化学调控手段提高作物对盐胁迫的耐受性提供理论依据和实践指导。
1 材料与方法
1.1 材料
供试小白菜品种为甜脆青(BrassicachinensisL. )F1 代,购于贵州贵丰种业有限公司。过氧化氢(30%)购自国药集团化学试剂有限公司。
1.2 试验设计与处理
1.2.1NaCl浓度的筛选
精选大小均一、籽粒饱满的小白菜种子,0.5%的NaClO溶液消毒10 min,蒸馏水反复冲洗干净,蒸馏水浸种2 h后,将浸种催芽后的种子分别播于铺有双层滤纸、含有不同浓度NaCl(0、50、100、150、200、250 mmol/L)的培养皿中,每皿播50粒种子。共6个盐胁迫处理,每个处理5次重复。将种子统一置于(25±1)℃、相对湿度85%—90%的恒温培养箱培养7 d。种子培养期间,每天统计发芽种子数,定时补充相应的NaCl溶液,于培养7 d后计算其发芽势、发芽率、发芽指数和活力指数,测定根长。
1.2.2H2O2浸种处理
根据1.2.1实验结果,选用100 mmol/L NaCl溶液处理小白菜种子。精选均一饱满的健康小白菜种子,0.5%的NaClO溶液消毒10 min,蒸馏水反复冲洗干净后,用滤纸小心的将小白菜种子表面水分吸干,分别用5、10、25、50和100 mmol/L H2O2溶液浸种2 h,同时以蒸馏水浸种处理2 h为浸种对照。将浸好的小白菜种子用蒸馏水冲洗3—5次后,用滤纸轻轻吸干种子上的残留水分,然后将种子分别均匀播于铺有两层滤纸、含有100 mmol/L NaCl的培养皿中,每皿播50粒种子。以蒸馏水为对照,共7个处理,分别为:蒸馏水浸种非NaCl胁迫处理(CK)、蒸馏水浸种NaCl胁迫处理(NaCl)、5 mmol/L H2O2浸种NaCl胁迫处理(T1)、10 mmol/L H2O2浸种NaCl胁迫处理(T2)、25 mmol/L H2O2浸种NaCl胁迫处理(T3)、50 mmol/L H2O2浸种NaCl胁迫处理(T4)和100 mmol/L H2O2浸种NaCl胁迫处理(T5),每个处理重复5次。将种子统一置于相对湿度为85%—90%、温度为(25±1)℃的恒温培养箱中萌发培养7 d。种子培养期间,每天观察记录发芽数,定时补充NaCl溶液。种子培养7 d后,计算每个处理种子的发芽势、发芽率、发芽指数和活力指数,测定每个处理中小白菜幼苗的胚根和胚芽的长度和鲜重。此外,各处理另设12个重复于培养7 d后取小白菜根和芽样品用于相关生理指标测定。
1.3 测定项目与方法
1.3.1种子萌发指标测定
种子发芽以胚根长2 mm作为发芽标准,小白菜种子的发芽率、发芽势、发芽指数和活力指数计算参考杨波等[8],耐性指数和相对盐害率参考李志萍等[20],公式如下:
发芽率(%)=(第7天发芽种子数/供试种子总数)×100%
发芽势(%)=(第3天的发芽种子数/供试种子总数)×100%
发芽指数= ∑(t天的发芽数/相应的发芽天数)
活力指数=根长度×发芽指数
耐性指数(%)=活力指数处理/活力指数对照×100
根长相对盐害率(%)=(对照根长-处理根长)/对照根长×100
1.3.2生长指标测定
萌发试验结束后,从每个处理中随机选取15株幼苗,用游标卡尺分别测定根和芽长度,计算平均长度,以cm表示;然后分别切取根和芽,采用万分之一天平称量鲜重,计算平均值,表示为mg/株。
1.3.3MDA含量测定
采用硫代巴比妥酸法测定[21]。取0.1 g样品,加入10% TCA迅速研磨,12000 g离心10 min后,取上清和10% TCA各2 mL于另一空离心管中,加盖煮沸15 min,冰浴冷却后再次3000 r/min离心10 min,取上清测定532、600 nm处的吸光值。
1.3.4H2O2含量和超氧阴离子产生速率
H2O2含量测定参照邹琦的方法[21],并稍作改动。取0.2 g样品,加入2 mL预冷丙酮,充分研磨匀浆后,10000 r/min离心10 min,取1 mL上清液加入5%硫酸钛和浓氨水,5000 r/min离心10 min 后,将沉淀溶于3 mL 1 mol/L的硫酸中,410 nm下测定吸光度。
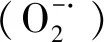
1.3.5抗氧化酶活性测定
酶液的提取:取0.1 g样品,放入预冷的研钵中,加适量预冷的50 mmol/L磷酸缓冲液(含1% PVP、100 μmol/L EDTA、5 mmol/L DTT,pH 7.0),冰浴研磨成匀浆,在4℃下,12000×g 离心20 min。上清液即为酶待测液。
SOD(superoxide dismutase)采用氮蓝四唑(NBT)光还原法的测定[22],以抑制氯化硝基四氮唑蓝光化还原50%为一个酶活性单位表示。POD(peroxidase)的测定采用愈创木酚比色法,以每1 min内A470变化0.01为一个过氧化物酶活性单位[22]。CAT(catalase)的测定采用紫外吸收法,以1 min内A240减少0.1的酶量为一个酶活性单位[22]。APX(ascorbate peroxidase)的测定采用紫外吸收法法,以1 min内A290减少0.01的酶量为一个酶活性单位[22]。
1.3.6脯氨酸和可溶性糖含量
采用酸性茚三酮显色法测定[22]。取0.1 g样品,加入3%磺基水杨酸研磨,沸水浴浸提10 min,冷却后上清液即为脯氨酸的提取液,取2 mL上清液,加2 mL冰乙酸和3 mL 2.5%的酸性茚三酮,沸水浴显色40 min,冷却,加5 mL甲苯,振荡30 s,静置萃取,取上层溶液在520 nm处测定吸光度。
可溶性糖含量测定采用蒽酮比色法[22]。取0.2 g样品,用80%酒精水浴中提取30 min,冷却至室温后4000 r/min 下离心10 min,上清液转入至25 mL 容量瓶,反复浸提3次,合并上清液,定容至25 mL。取浸提液1 mL试液于试管,加入5 mL 蒽酮硫酸试剂,90℃水浴10 min,冷却后在620 nm处测定吸光度。
1.3.7Na+和K+含量
Na+和K+含量的测定采用火焰光度计法测定。取0.1 g烘干样品,加5 mL硫酸,沙浴2 h,然后用电热板进行消煮,每隔30 min 加入1 mL H2O2,直至混合液无色透明,然后用蒸馏水定容至50 mL,用火焰光度计法测定Na+和K+含量。
1.4 数据处理
试验数据统计分析采用Microsoft Excel 2010进行原始数据处理,用SPSS 16.0分析软件进行单因素方差分析,采用Duncan方法进行多重比较及差异显著性检验(α=0.05),图表中数据为平均值±标准误。
2 结果与分析
2.1 NaCl胁迫对小白菜种子萌发的影响
从表1可以看出,小白菜种子的发芽率、发芽势、发芽指数、活力指数和根长均随着NaCl胁迫浓度的升高而逐渐降低。与对照相比,高于150 mmol/L NaCl胁迫下,小白菜种子的发芽率明显降低(P<0.05);高于100 mmol/L NaCl胁迫显著抑制小白菜种子的发芽势和发芽指数(P<0.05)。不同浓度NaCl胁迫明显抑制小白菜种子的活力指数和萌发幼苗的根长(P<0.05),与对照相比,在50、100、150、200和300 mmol/L NaCl处理下小白菜种子的活力指数分别降低了30.45%、54.26%、67.79%、79.89%和89.17%,根长分别降低了28.09%、47.12%、58.41%、68.58%和78.32%。综合来看,100 mmol/L NaCl胁迫显著抑制小白菜种子的发芽率、发芽势、发芽指数和活力指数,且对活力指数和根长的抑制程度约为50%,因此本试验选用100 mmol/L NaCl溶液作为小白菜种子盐处理的胁迫浓度。
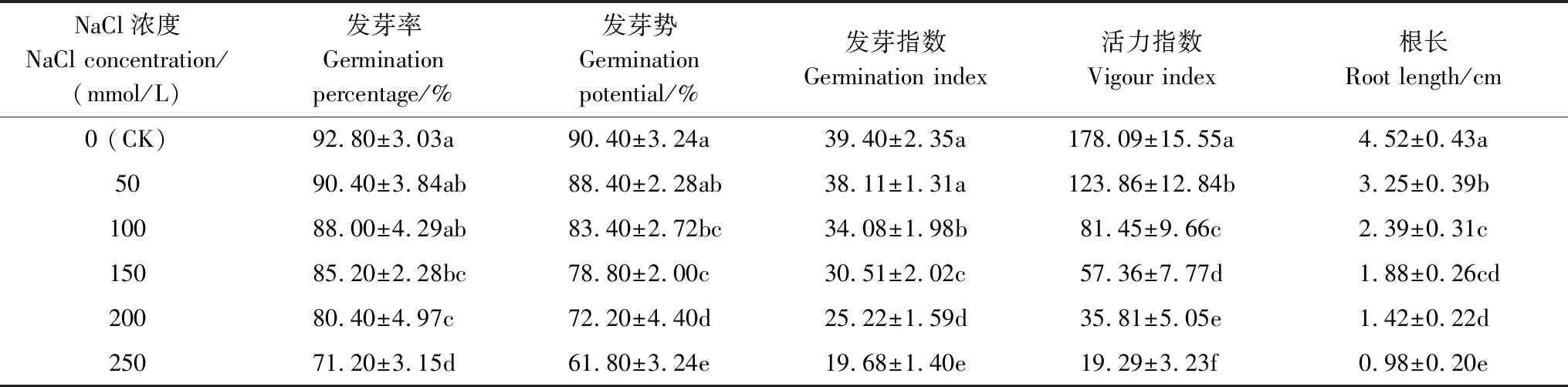
表1 不同浓度NaCl胁迫对小白菜种子萌发状况的影响
表中数据为平均值±标准误;同列不同小写字母表示差异性显著(P<0.05)
2.2 H2O2对NaCl胁迫下小白菜种子萌发的影响
由表2可以看出,单独100 mmol/L NaCl处理对小白菜种子萌发率无明显抑制作用(P>0.05),但明显降低了小白菜种子的发芽势、发芽指数和活力指数(P<0.05),分别较对照降低了7.74%、13.50%和54.26%。T1—T5处理均提高了NaCl胁迫下小白菜种子的发芽势、发芽指数和活力指数,其中以T2处理的缓解NaCl胁迫效果最显著(P<0.05),其发芽势、发芽指数和活力指数比单独NaCl处理分别提高了7.91%、14.67%和78.19%。由T1到T5处理,随着H2O2处理浓度的增加,其对NaCl胁迫下小白菜种子萌发的缓解作用呈先增强后减弱的趋势,虽然T4和T5处理也提高了NaCl胁迫下小白菜种子的发芽势、发芽指数和活力指数,然而与单独NaCl处理相比并未达到差异显著水平(P>0.05)。这些结果表明,H2O2可有效缓解NaCl胁迫对小白菜种子萌发的抑制作用,且存在浓度效应,T2处理缓解效果最为明显(表2)。
表2 H2O2对NaCl胁迫下小白菜种子发芽率、发芽势、发芽指数和活力指数的影响
Table 2 Effects of H2O2on germination percentage, germination potential, germination index and vigour index of pakchoi seeds under NaCl stress
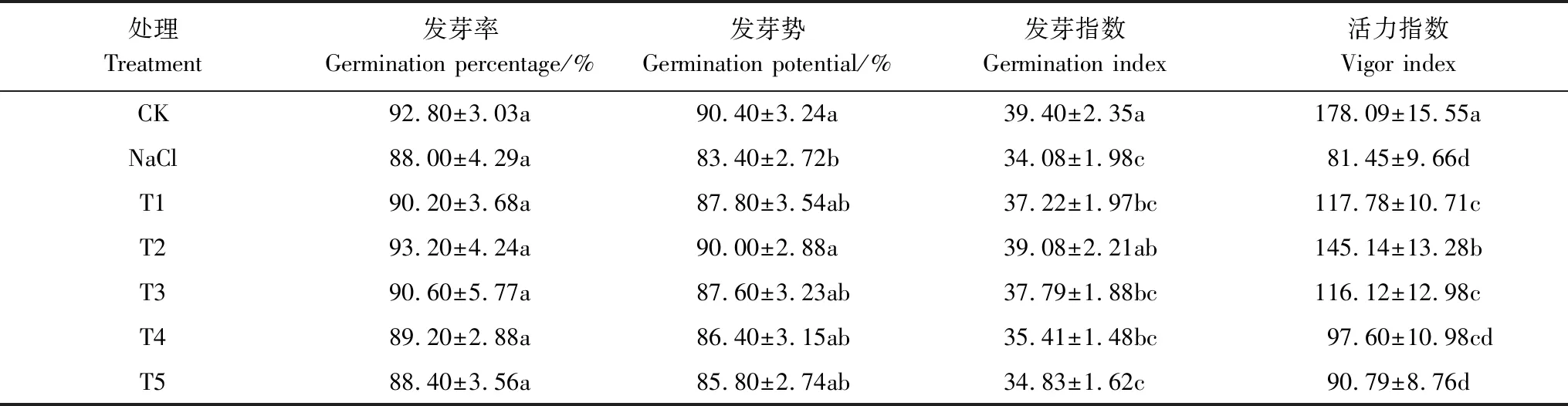
处理Treatment发芽率Germination percentage/%发芽势 Germination potential/%发芽指数Germination index 活力指数Vigor indexCK92.80±3.03a90.40±3.24a39.40±2.35a178.09±15.55aNaCl88.00±4.29a83.40±2.72b34.08±1.98c81.45±9.66dT190.20±3.68a87.80±3.54ab37.22±1.97bc117.78±10.71cT293.20±4.24a90.00±2.88a39.08±2.21ab145.14±13.28bT390.60±5.77a87.60±3.23ab37.79±1.88bc116.12±12.98cT489.20±2.88a86.40±3.15ab35.41±1.48bc97.60±10.98cdT588.40±3.56a85.80±2.74ab34.83±1.62c90.79±8.76d
CK:蒸馏水对照,Control;NaCl:100 mmol/L NaCl;T1:100 mmol/L NaCl+5 mmol/L H2O2; T2:100 mmol/L NaCl+10 mmol/L H2O2;T3:100 mmol/L NaCl+25 mmol/L H2O2;T4:100 mmol/L NaCl+50 mmol/L H2O2;T5:100 mmol/L NaCl+100 mmol/L H2O2
2.3 H2O2对NaCl胁迫下小白菜幼苗根和芽生长的影响
图1结果表明单独NaCl胁迫明显降低了小白菜幼苗根的生长,根长仅为对照的52.88%(P<0.05)。与单独NaCl处理相比,T1—T3处理明显缓解了NaCl胁迫对根长的抑制,且根长表现为先增加后降低的趋势,其中以T2处理缓解效果最好,其根长比单独NaCl处理高出55.23%(P<0.05),但仍明显低于对照(P<0.05),仅为对照的82.08%。然而T4和T5处理的根长与单独NaCl处理相比,无明显差异(P>0.05)。单独NaCl胁迫明显抑制小白菜幼苗芽长(P<0.05);与单独NaCl处理相比,T1—T4处理不同程度的提高了NaCl胁迫下小白菜幼苗的芽长,其中以T2处理下芽长最大,比单独NaCl处理高出18.53%(P<0.05),仍略低于对照。
单独NaCl胁迫明显降低了小白菜幼苗根和芽的鲜重(P<0.05)(图1),根和芽鲜重仅为对照的65.55%和82.58%。与单独NaCl处理相比,T1—T3处理明显促进了NaCl胁迫下小白菜根和芽鲜重的增加,其中以T2处理增加幅度最大,为单独NaCl处理的1.34倍(P<0.05)和1.18倍(P<0.05)。T4和T5处理根和芽鲜重与单独NaCl处理相比,无显著差异(P>0.05)。
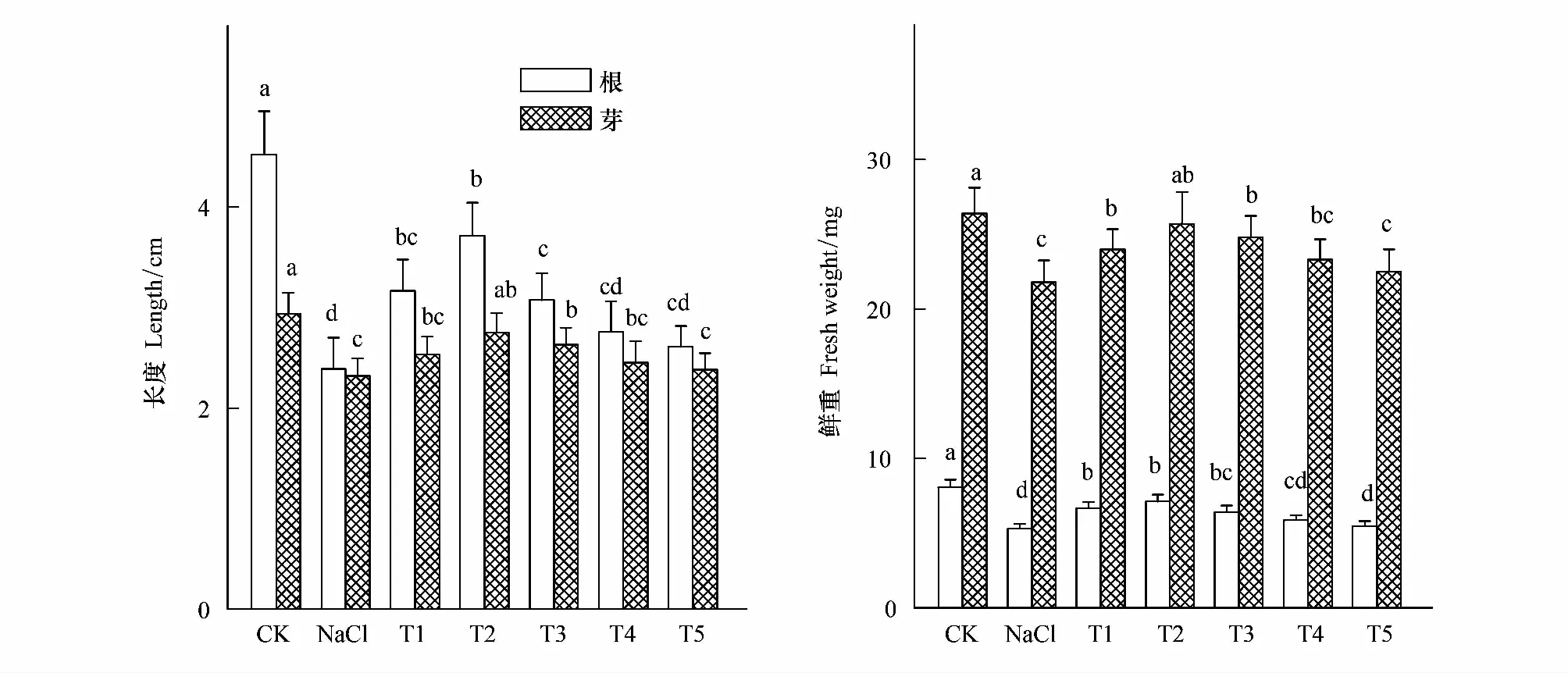
图1 H2O2对NaCl胁迫下小白菜幼苗根长、芽长、根鲜重与芽鲜重的影响Fig.1 Effects of H2O2 on length and fresh weight of root and shoot of pakchoi seedlings under NaCl stress不同小写字母表示同一部位不同处理间差异显著(P<0.05),下同;CK:蒸馏水对照,Control;NaCl:100 mmol/L NaCl;T1:100 mmol/L NaCl+5 mmol/L H2O2; T2:100 mmol/L NaCl+10 mmol/L H2O2;T3:100 mmol/L NaCl+25 mmol/L H2O2;T4:100 mmol/L NaCl+50 mmol/L H2O2;T5:100 mmol/L NaCl+100 mmol/L H2O2
2.4 H2O2对NaCl胁迫下小白菜耐盐指数和相对盐害率的影响
耐盐指数反映种子萌发对盐胁迫的耐受程度,根长相对盐害率反映萌发后幼苗受胁迫的伤害程度[20]。从表3 中看出,100 mmol/L NaCl胁迫下,相对盐害率最大,为47.12。由T1到T5处理,相对盐害率呈现先下降后增加的趋势,且均低于单独NaCl胁迫处理,并以T2处理的相对盐害率最低,较单独NaCl胁迫处理降低了62.16%,差异达显著水平(P<0.05)。与相对盐害率相反,T1—T5处理不同程度的提高了NaCl胁迫下小白菜种子的耐盐指数,且T2处理提高幅度最大,是单独NaCl胁迫处理的1.78倍,差异达显著水平(P<0.05)。
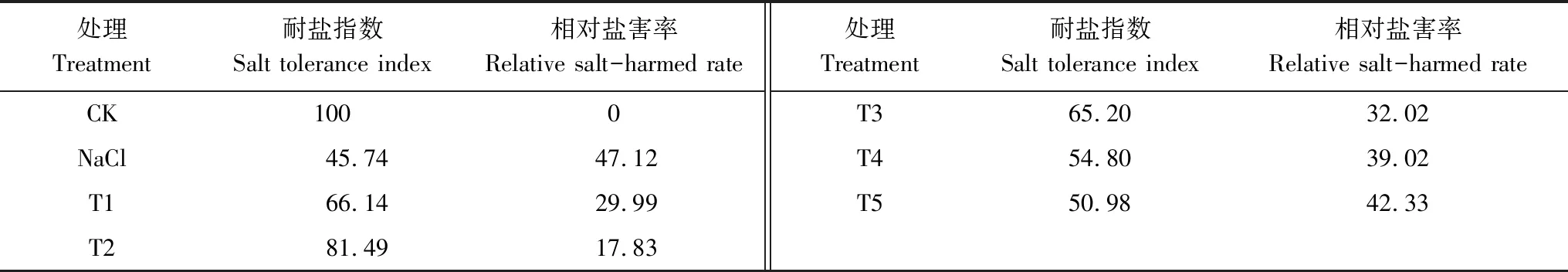
表3 H2O2处理对NaCl胁迫下小白菜种子耐盐指数和相对盐害率的影响
2.5 H2O2对NaCl胁迫下小白菜幼苗MDA含量的影响
MDA是膜脂过氧化的主要产物,其含量可以反映植物在逆境胁迫下受伤害的程度。图2结果表明,单独NaCl胁迫导致小白菜幼苗根和芽中MDA含量明显增加(P<0.05),且幼根中的MDA 含量大于幼芽,分别为对照的1.76倍和1.29倍。H2O2浸种处理降低了NaCl胁迫下根和芽中MDA含量,且随着H2O2处理浓度的增加,根和芽中MDA含量呈现先降低后增加的变化。各H2O2处理相比,以T2处理中MDA含量最低,其根和芽中MDA含量比单独NaCl处理分别降低了33.72%(P<0.05)和18.48%(P<0.05),但仍高于对照。
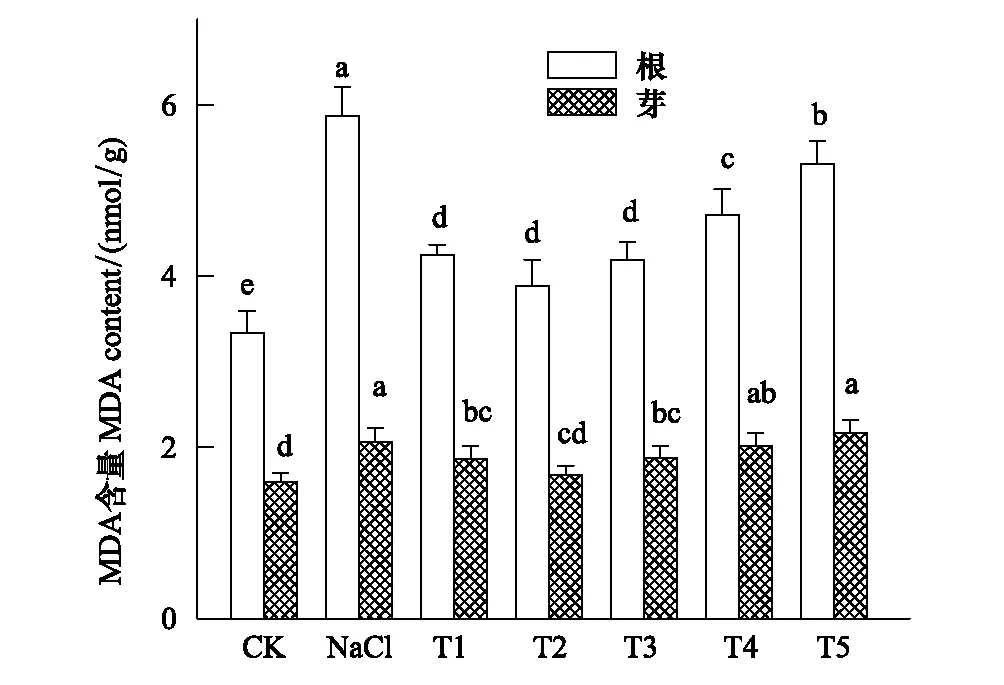
图2 H2O2对NaCl胁迫下小白菜幼苗根和芽中MDA含量的影响Fig.2 Effect of H2O2 on MDA content in root and shoot of pakchoi seedlings under NaCl stressMDA:丙二醛,Malonaldehyde
2.6 H2O2对NaCl胁迫下小白菜幼苗活性氧积累的影响
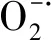

图3 H2O2对NaCl胁迫下小白菜幼苗根和芽中H2O2含量和产生速率的影响Fig.3 Effects of H2O2 on the H2O2 content and production rate in the seedlings of pakchoi under NaCl stressH2O2:过氧化氢,Hydrogen 超氧阴离子自由基,Superoxide anion free radical
2.7 H2O2对NaCl胁迫下小白菜幼苗抗氧化酶活性的影响
图4结果表明,NaCl胁迫明显提高了小白菜幼苗根和芽中SOD、POD和APX活性(P<0.05)。T1—T4处理进一步提高了NaCl胁迫下小白菜根和芽中SOD和APX活性,其中T2处理下SOD和APX活性增幅最大,根和芽中SOD、APX活性分别较单独NaCl处理增加了30.41%和32.68%、49.41%和30.92%。与SOD和APX活性相反,T1—T4处理明显降低了NaCl胁迫下小白菜根和芽中POD活性(P<0.05),特别是T2处理,但均高于对照(P<0.05)。
NaCl胁迫明显抑制了小白菜幼苗根和芽中CAT活性(P<0.05)。但T1—T4处理明显提高了NaCl胁迫下小白菜根中CAT活性(P<0.05),与单独NaCl处理相比,根中CAT活性增加了18.43%—49.41%;T1—T3处理明显提高了NaCl胁迫下小白菜芽中CAT活性(P<0.05),与单独NaCl处理相比,芽中CAT活性增加了16.46%—28.10%。
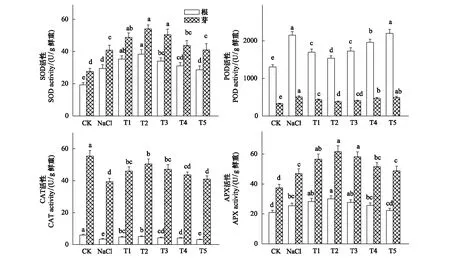
图4 H2O2对NaCl胁迫下小白菜幼苗根和芽中SOD、POD、CAT和APX活性的影响Fig.4 Effects of H2O2 on activities of SOD、POD、CAT and APX in root and shoot of pakchoi seedlings under NaCl stressSOD:超氧化物歧化酶,Superoxide dismutase;POD:过氧化物酶,Peroxidase;CAT:过氧化酶,Catalase;APX:抗坏血酸过氧化物酶,Ascorbate peroxidase
2.8 H2O2对NaCl胁迫下小白菜幼苗渗透调节物质含量的影响
脯氨酸和可溶性糖是植物体内重要的渗透调节剂,能降低细胞的渗透势,提高植物组织的持水力,保持细胞膜结构,其含量的高低与植物的抗逆性密切相关[23]。图5结果表明,NaCl胁迫下,小白菜幼苗根和芽中脯氨酸和可溶性糖含量均明显增加(P<0.05),其中根中脯氨酸和可溶性糖含量的增加幅度较芽中大。T1—T4处理促进了小白菜幼苗根和芽中脯氨酸和可溶性糖含量的进一步增加(P<0.05),其中以T2处理下小白菜幼苗根和芽中脯氨酸和可溶性糖含量增加最大,分别比单独NaCl处理高出24.85%和20.96%、24.01%和19.45%。
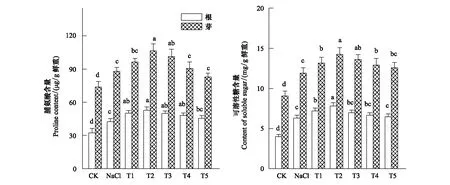
图5 H2O2对NaCl胁迫下小白菜幼苗根和芽中脯氨酸和可溶性糖含量的影响Fig.5 Effects of H2O2 on the content of proline and soluble sugar in root and shoot of pakchoi seedlings under NaCl stress
2.9 外源H2O2对NaCl胁迫下小白菜幼苗根和芽中Na+、K+含量及K+/Na+的影响
由图6可知,100 mmol/L NaCl胁迫下,小白菜幼苗根和芽中Na+含量明显增加(P<0.05),伴随着Na+含量的增加,K+含量及K+/Na+显著下降(P<0.05)。T1—T4处理明显降低了小白菜幼苗根和芽中Na+含量,而明显增加了K+含量,同时提高了K+/Na+,特别是T2处理,小白菜幼苗根和芽中Na+含量较单独NaCl胁迫分别降低了17.75%和18.82%,根和芽中K+含量分别提高了19.84%和31.98%,K+/Na+分别提高了44.28%和62.57%,差异显著(P<0.05)。由此可知,一定浓度的H2O2可提高NaCl胁迫下小白菜体内K+含量,降低Na+含量,进而提高小白菜幼苗根和芽中K+/Na+,从而提高植物的耐盐性。
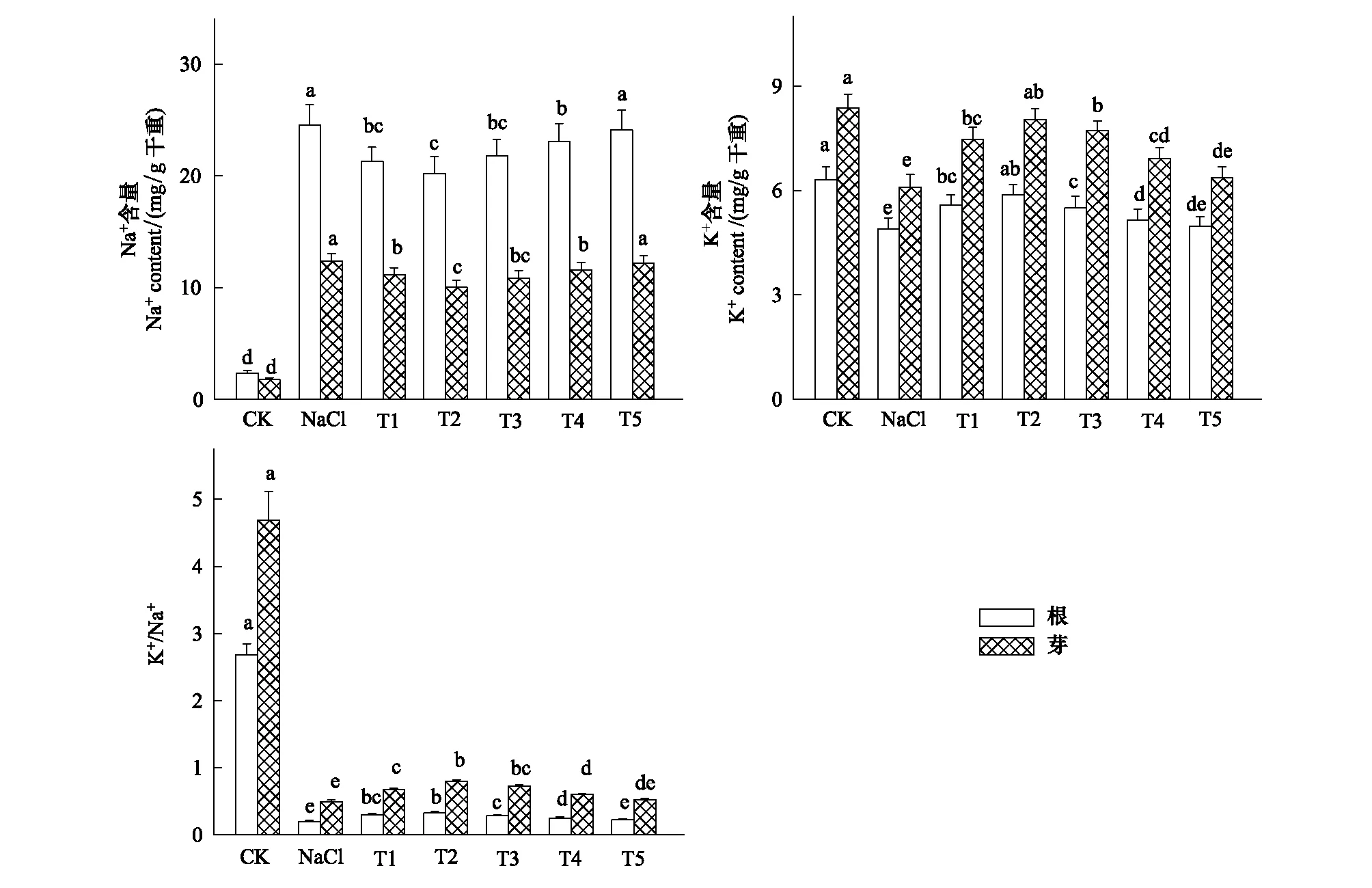
图6 H2O2对NaCl胁迫下小白菜幼苗根和芽中Na+、K+含量和K+/Na+的影响Fig.6 Effects of H2O2 on the Na+ and K+ contents and K+/Na+ in root and shoot of pakchoi seedlings under NaCl stress
3 讨论
盐胁迫是制约植物生长发育的主要非生物胁迫之一,也是当今制约农作物生产的严峻环境问题[1],它可直接或间接通过影响植物的代谢活动,如细胞活性氧代谢失衡、生物大分子损伤、抑制光合和呼吸代谢等,进而影响植物的生长发育及最终产量[2, 11]。种子萌发及幼苗生长是植物生命周期的开始阶段,盐胁迫会使种子活力受到严重的影响[6]。本研究表明,不同浓度的NaCl胁迫不同程度的抑制了小白菜种子萌发特性(表1)。100 mmol/L的NaCl胁迫下小白菜的萌发虽然未受明显影响,但种子的发芽势、发芽指数和活力指数明显受到抑制(表1)。这与NaCl胁迫对番茄[24]和油菜[25]的影响结果相一致。此外,NaCl胁迫下小白菜根长明显受到抑制(表1),可能与NaCl胁迫减少植物对水分的可利用性、离子毒害、抑制细胞的生长和分裂有关[2, 26]。
H2O2是活性氧信号转导途径中的一个重要内源信号分子,具有多种生理功能,在植物抵抗逆境胁迫起着重要作用。已有研究表明,H2O2预处理可以促进盐胁迫下小麦[16, 27]、燕麦[28]和羽衣甘蓝[29]的生长。然而由于作物种类和处理方式的不同,缓解盐胁迫的最适H2O2浓度也不同。本研究采用不同浓度外源H2O2处理种子,在100 mmol/L NaCl胁迫下小白菜种子的发芽势、发芽指数、活力指数及根和芽的生长均有所提高(表2、图1),且均表现为随着H2O2处理浓度的提高先增加后降低的趋势,有效缓解了NaCl胁迫对小白菜种子萌发和幼苗产生的伤害,提高种子和幼苗的耐盐能力(表3),其中10 mmol/L H2O2缓解作用最为明显。
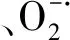
在盐胁迫下,植物细胞会发生渗透胁迫,植物通过积累各种有机渗透调节物质含量来维持渗透平衡,保护细胞结构,提高自身耐受性[20]。脯氨酸是一种重要的细胞渗透调节物质,具有多种生物功能,参与渗透调节、蛋白质构成、保护细胞膜完整性、稳定酶和蛋白质以及清除自由基[13, 15]。可溶性糖既是渗透调节剂,也是合成其他有机溶质的碳架和能量的来源,还可在细胞内无机离子浓度高时起保护酶类的作用。有研究表明盐胁迫可以诱导番茄[10]、油菜[25]植物体内脯氨酸和可溶性糖含量的增加。Sun等研究表明H2O2处理可以提高干旱胁迫下黄瓜幼苗体内脯氨酸和可溶性糖含量,提高其抗干旱能力[15]。Wen等研究表明外源H2O2处理提高了Cu胁迫下玉米幼苗叶片中脯氨酸和可溶性糖含量,从而提高CuCl2胁迫下甜玉米幼苗根和芽的生长[13]。刘建新等研究发现外源H2O2通过活化脯氨酸合成的谷氨酸途径和鸟氨酸途径,抑制脯氨酸的降解,促进混合盐碱胁迫下燕麦幼苗脯氨酸的积累[31]。本研究结果表明,在NaCl胁迫下,适宜浓度的H2O2浸种处理可以进一步诱导小白菜根和芽中脯氨酸和可溶性糖含量的增加(图5)。脯氨酸和可溶性糖含量增加可提高细胞的渗透调节能力,从而提高小白菜幼苗的耐盐能力。
许多研究表明H2O2作为一种活性氧,在参与调节植物生理代谢和抗性反应中具有明显的浓度效应。有研究表明1—5 mmol/L H2O2促进盐胁迫下水稻幼苗根系中APX、SOD和CAT活性的增加,但是10 mmol/L H2O2则降低其对抗氧化酶的促进作用[30]。低浓度 H2O2处理促进了盐胁迫下人参根长、干物质重、叶绿素和类胡萝卜素含量,然而高浓度则产生明显的抑制作用[11]。本研究发现H2O2通过提高小白菜幼苗体内抗氧化酶活性和游离脯氨酸含量,降低细胞膜质过氧化作用,促进萌发种子胚根和胚芽的生长。随着H2O2处理浓度的增加,则缓解作用先增强后降低,以10 mmol/L的H2O2效果最好。
保持植物体及细胞内的离子平衡对植物正常的生长至关重要。在盐胁迫下植物通常吸收Na+的同时抑制K+吸收[32- 33]。本研究发现,NaCl胁迫下小白菜幼苗根和芽中K+含量显著降低,Na+含量显著增加,K+/Na+明显低于对照(图6)。研究认为,植物耐盐能力的强弱与Na+、K+的选择性吸收密切相关,限制Na+进入体内,选择性的吸收K+,才能提高其耐盐能力[34]。本研究结果表明,外源H2O2可不同程度的提高NaCl胁迫下小白菜幼苗根和芽中K+含量,降低Na+含量,K+/Na+显著增加(图6)。K+/Na+离子平衡可能与H2O2处理提高盐胁迫下小白菜幼苗抗氧化能力,减轻了细胞质膜的损伤,维持了细胞膜的完整性,保护膜上转运蛋白有关[6],从而提高了幼苗对Na+、K+选择性吸收能力[33]。该结果有待进一步验证。
综上所述,NaCl胁迫下外源H2O2浸种通过提高抗氧化酶活性和渗透调节物质含量,降低活性氧的积累及膜脂过氧化,维持K+/Na+离子平衡,缓解NaCl胁迫对小白菜幼苗细胞的伤害,促进NaCl胁迫下小白菜种子萌发和幼苗生长,其中10 mmol/L的H2O2效果最好。
