浅表层水稻土N2O消耗能力及其与N2O还原微生物的耦合关系
2019-12-03宋雅琦李兆华
王 玲,李 昆,宋雅琦,公 勤,李兆华,*
1 湖北大学资源环境学院,武汉 430062 2 湖北省农村安全饮用水工程技术研究中心,武汉 430062
土壤是大气氧化亚氮(N2O)排放的重要来源之一,由土壤微生物介导的硝化、反硝化作用是产生N2O的主要过程[1,2]。然而常规静态箱法监测到的N2O排放量仅是土壤中N2O产生与消耗过程综合作用后的动态结果[3]。由于土壤水、土壤孔隙等非生物因素的截留作用以及土壤微生物的还原作用,土壤剖面中产生的N2O量并不能完全迁移出土壤表面而贡献排放[4,5]。近年来水稻土研究结果显示,无论是淹水状态还是落干过程,N2O排放可能主要来源于距离土表更近的0—5 cm深度的水稻土层[6- 8]。但同时Wang等研究发现0—5 cm深度土层产生的N2O气体并不能完全排放,高达90%的N2O产生量以不同途径消耗损失了[9],因此0—5 cm深度土壤N2O消耗能力值得关注。此外,越来越多的研究监测到土壤N2O负排放量,在温带和热带区域的自然和耕作生态系统中,N2O净消纳率在<-1.0 μg N m-2h-1至-207 μg N m-2h-1范围波动[10,11]。全球每年通过土壤作用消耗的N2O总量不可忽视,土壤消耗N2O已经成为很重要的一种降低大气N2O浓度的途径,值得深入探究。
水稻土是一种长期处于淹水缺氧状态中的人工水成土,土壤环境极有利于其反硝化脱氮和N2O充分还原[12,13]。但目前关于水稻土壤消耗N2O过程及其微生物调控机制的系统研究较为缺乏。为揭示0—5 cm深度水稻土层N2O消纳量与N2O还原微生物之间的耦合关系,本研究拟通过微宇宙培养方法对浅表层(0—5 cm)原状水稻土外源添加N2O气体,测定N2O迁移通过土柱的动态过程以及无机养分和氧化亚氮还原酶基因(nosZⅠ和nosZⅡ)丰度变化。研究结果将为水稻田温室气体减排提供重要的科学参考。
1 材料与方法
1.1 土样采集与预处理
土样采集自湖南益阳水稻丰产节水节肥试验田(29°08′N, 112°27′E),为多年种植双季稻土壤,土壤类型为河流冲积物母质发育的潮土(土壤质密,可有效防止气体从土壤裂缝泄漏)。采集时间为2016年4月(翻耕前2周),此时田间土壤处于休耕渍水状态。采用随机多点采样法,尽量避免残留主根区域,用自制PVC管(d=17 cm,h=8 cm)采集多个深度为0—5 cm的原状水稻土柱。标注方向后用保鲜膜包裹紧实,带回实验室做后续处理。同时在田间分别多点随机采集0—5 cm土样,混匀后带回实验室测定基础理化性质,结果见表1。

表1 供试土样基础理化性质

图1 培养装置模型图Fig.1 Schematic diagram of incubation device
用小PVC管(d=5 cm,h=7 cm)在取回的原状土柱上以环刀法采集小土柱(d=5 cm,h=5 cm),每大土柱可取2个小土柱。然后在底部安装相同尺寸PVC管(d=5 cm,h=3 cm)制的通气底座并密封边缘。通气底座上端用均匀打孔的PVC板覆盖后,在PVC板下再覆盖一层透气不透水的硅胶片并密封边缘,通气底座下端直接用PVC板覆盖并密封边缘。确保每个边缘密封完好后将整套装置置于培养用塑料杯(d=9 cm,h=13 cm)中,用三通阀连接通气底座与塑料杯外壁,用于外源气体的添加。培养装置如图1所示。
从原状土柱表面缓慢加入双水使土表水层约1 cm左右,放置在25±1 ℃温室预培养10 d后待用,预培养期间注意补充水分使水层厚度保持不变。预培养结束后将安装了三通阀的塑料杯盖盖起并完全密封,用浸水法确定整体密封效果。之后用注射器连接塑料杯三通阀置换装置内气体为高纯He气,反复置换5次后保证内外气压平衡。
2.2 试验处理
每土层均设置3个N2O含量添加处理,分别为1 mL(N1)、5 mL(N5)、10 mL(N10) 99.99%纯度N2O/盆(相当于880、4404、8808 μg N2O-N/盆),每处理3个重复。为降低土壤异质性对后续分析的影响,每处理0h和172h土样样品分别为同一大土柱取出的2个小土柱。塑料杯内气体置换完成后,用注射器连接通气底座三通阀,分别抽出1、5、10 mL气体后通入设定量的N2O气体,随后将整套装置置于无氧培养装置中(真空压缩袋制,抽真空后通入高纯He气),开始培养计时,培养时间共计172 h。
2.3 样品采集
气体样品采集:用注射器分别在密闭培养的0、33、82、125、172 h采集通气底座内气体,并在0、5、 10、 21、 28、 33、44、57、69、82、94、107、125、144、172 h采集塑料杯内气体样品1 mL于12 mL真空血清瓶中,充入29 mL高纯He使气瓶内气体维持高压,用于N2O含量的测定。每次采集气体样品前用注射器反复抽打空间内气体15—20次使空间气体混匀,气体样品采集后立即补入等量高纯He保证装置内各空间气压平衡。
2.4 氧化亚氮浓度,无机氮和DOC测定
N2O浓度采用温室气体气相色谱仪(GC 7890A)测定。以高纯N2作为色谱柱载气,气流速度28 psi,检测器温度为300 ℃,柱箱温度为50 ℃,检测器为微池电子捕获器63Ni-ECD。
无机氮及DOC含量测定采用硫酸钾共提法浸提。称取约10 g土样,置于 100 mL 塑料振荡瓶中,加入 50 mL 0.5 mol L-1K2SO4溶液浸提,在振荡机上振荡 1 h后用滤纸过滤悬浊液,澄清滤液分别采用连续流动分析仪 (Flastar 5000 Analyzer) 和C/N分析仪测定硝态氮、铵态氮含量和DOC含量。
2.5 氧化亚氮还原酶基因丰度测定
土壤样品的DNA提取方法主要参考Chen等[14]的方法。提取的DNA由Nanodrop ND- 1000UV-Vis分光光度计测定DNA浓度和质量系数,并通过1% 凝胶电泳检测DNA完整度,满足条件后用于qPCR分析。
氧化亚氮还原酶基因PCR分析用引物分别为nosZI- 1126F(5′-GGG CTB GGG CCR TTG CA- 3′)和nosZI- 1381R(5′- GAA GCG RTC CTT SGA RAA CTT G - 3′),以及nosZII-F(5′-CTI GGI CCI YTK CAY AC- 3′)和nosZII-R(5′- GCI GAR CAR AAI TCB GTR C - 3′)。实时 PCR 扩增所用的仪器为 ABI PRISM 7900 (Applied Biosystems),实现荧光检测和样品浓度测定。标准曲线用含nosZI和nosZII基因的质粒为模板,以10倍梯度稀释法配制nosZ基因PCR扩增反应体系为(10 μL):上下游引物各0.2 μL,SYBRGreen(TaKaRa)5 μL,Rox 0.2 μL,DNA模板5 ng(1 μL),补水至10 μL。nosZI基因qPCR程序为:95 ℃ 30 s预变性;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 10 s,40个循环;95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s校正溶解曲线。nosZII基因qPCR程序为:95 ℃ 30 s预变性;95 ℃ 15s,54 ℃ 30s,72 ℃ 30 s,45个循环;95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s校正溶解曲线。所有样品重复3次并设置阴性对照,溶解曲线分析和琼脂糖凝胶电泳鉴定产物的特异性。
2.6 数据分析处理
数据的统计分析均采用SPSS 13.0 软件进行分析。N2O浓度、无机养分浓度以及功能基因丰度处理间的差异性分析采用单向方差分析(One Way ANOVE,LSD 检验)。N2O浓度与消耗速率的关系采用线性回归分析拟合。图形制作采用Orgin Pro 9.0和Excel 2010软件完成。
3 结果与分析
3.1 淹水水稻土柱N2O消纳动态
由于N1、N5、N10处理实际N2O充入量分别为705.48、10645.77、20200.19 μg N2O-N,与预设处理浓度稍有误差,后续以实测量为基础进行计算和分析。
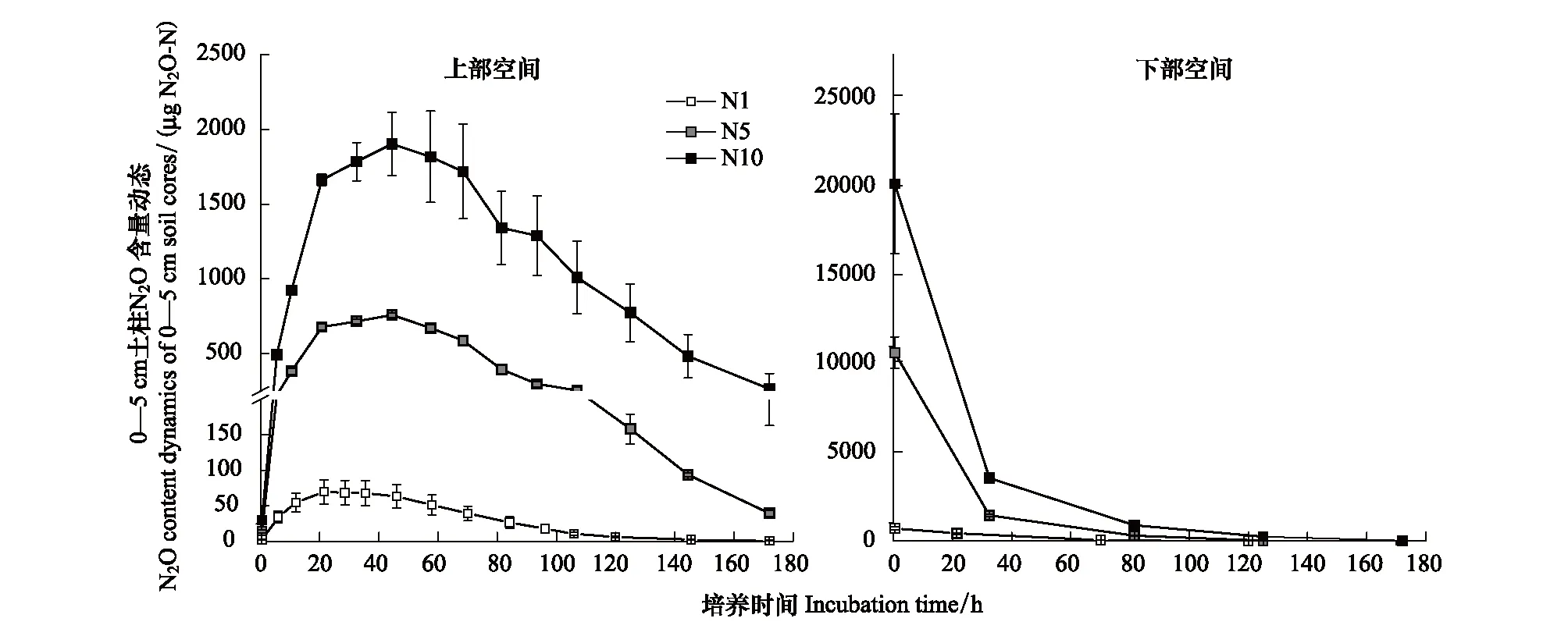
图2 浅表层水稻土柱上部N2O释放动态与土柱底部N2O消减动态Fig.2 Dynamics of inputting N2O content in the headspace and bottom space of 0—5 cm soil layer during flooding incubation
图2显示,土柱底部添加的外源N2O气体量均随培养时间延长而呈指数形式迅速降低。在培养172 h后,所有处理中的底部N2O含量值均接近于0,表明外源添加的N2O气体已全部扩散、迁移进了原状土柱。三个N2O浓度处理上部空间N2O量随时间的变化趋势基本一致,均呈现先增后降的动态变化,但高峰时间略有差别。N5、N10处理的土柱上部空间N2O气体量在培养第45 h左右达到最高峰,分别占气体添加总量的7.17%、9.76%,N1处理在培养第22小时即达到峰值,N2O量占气体添加总量的9.80%,说明5 cm浅表层水稻土在淹水状态下对N2O气体的截留率极高。随后上部空间逸出的N2O量持续降低,进一步说明土体对上层空间N2O有吸收作用,随着时间延长外源N2O几乎可被全部吸收。
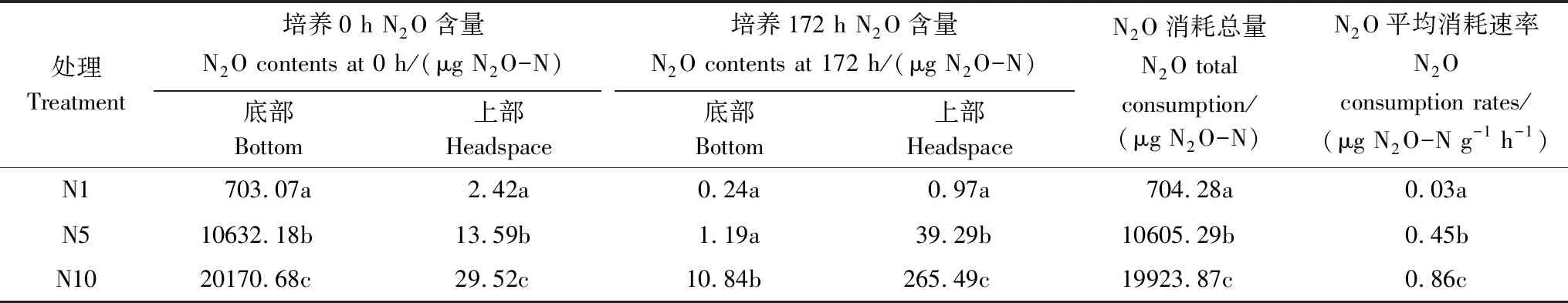
表2 不同处理水稻土柱淹水培养期N2O消耗量差异
不同小写字母代表N2O添加处理间差异显著(P<0.05)
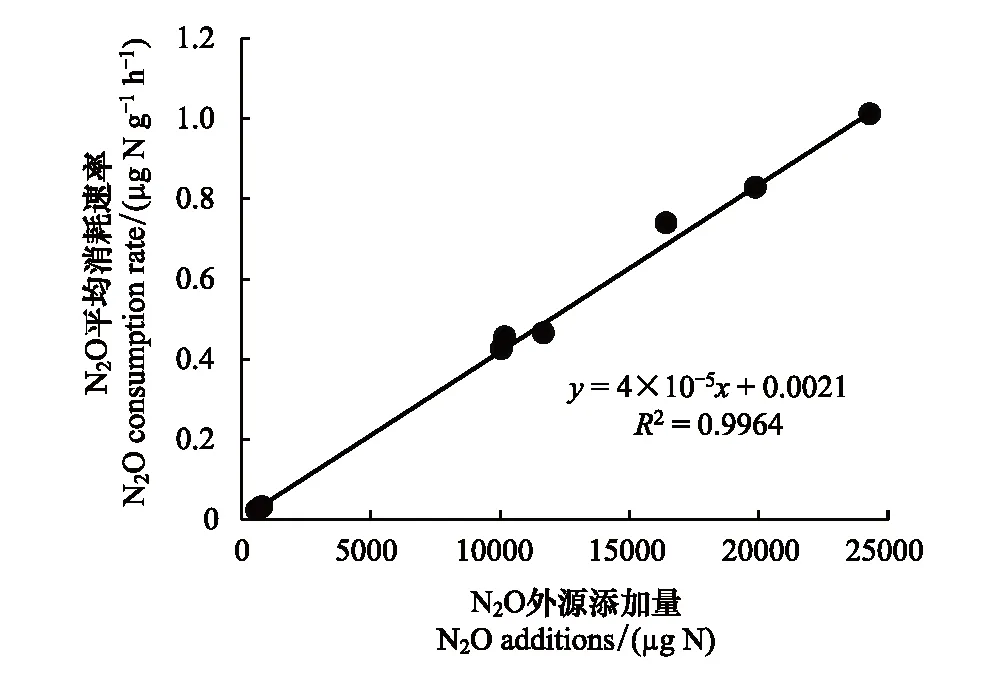
图3 浅表层水稻土柱N2O平均消耗速率与底部添加N2O量的线性关系Fig.3 Linear relationship of N2O average consumption rate and N2O addition of surface paddy soil layer
培养期内N2O消耗总量通过培养起始点(0 h)与结束点(172 h)装置内N2O量(上、下空间之和)的差值表示(表2)。结果显示尽管N1、N5、N10处理N2O气体添加量在培养起始点存在显著差异(P<0.05),但经过172 h密闭淹水培养,三处理N2O消耗总量占初始N2O添加总量的97.11%—99.55%,说明浅表层土壤对N2O的消耗能力很强,且无论外源加入N2O量多少,均能够被土壤基本消耗完全。而N1、N5、N10处理N2O平均消耗速率存在显著差异(P<0.05)。N2O平均消耗速率随N2O外源添加量的增加而增加,通过线性拟合分析发现(图3),N2O平均消耗速率(Y)与外源N2O添加量(X)成显著线性关系(P<0.01),表明浅表层水稻土柱N2O消耗能力会受到外源N2O添加量的刺激而显著增强。
3.2 土壤含量变化
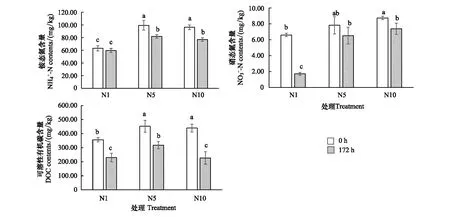
图4 浅表层水稻土含量,含量和DOC含量在培养期内的变化动态Fig.4 Dynamics of concentration, and DOC concentration at 0h and 172 h of surface paddy soil layer不同小写字母代表处理间差异显著(P<0.05)
可溶性有机碳结果(图4)显示表层水稻土柱中DOC含量在培养起始点均高于350 mg/kg,表明可利用的碳含量较为丰富。经过淹水厌氧培养172 h后,各处理土壤DOC含量均被显著消耗,N1、N5、N10处理DOC消耗量分别为126.38、134.50、212.33 mg/kg,消耗比例分别为35.60%、29.68%、48.61%。高浓度的N2O添加处理(N10)消耗了最多的DOC,由于DOC是供给微生物活动的直接C源,侧面反映高浓度N2O添加刺激了较多的微生物响应。
3.3 氧化亚氮还原酶基因丰度变化
土壤细菌氧化亚氮还原酶基因丰度结果(图5)显示,培养起始点三处理土壤nosZI基因拷贝数量平均为1.20×109copies/g干土,而nosZII基因丰度则为nosZI基因丰度的2倍以上。此外,nosZI和nosZII基因拷贝数在淹水厌氧培养172 h后变化趋势明显不同。不同浓度外源N2O添加均引起了nosZI基因丰度的显著增加,N1、N5、N10处理nosZI基因拷贝数分别增加了4.46×108、5.91×108、9.91×108。nosZI基因拷贝数增幅基本上随N2O添加量增加而增加,表明外源N2O的添加刺激了含nosZI基因微生物数量的增长。而nosZII基因数量对不同N2O添加浓度的响应存在差异,N1处理低浓度N2O添加促进了nosZII基因拷贝数的增长(增长幅度约为32.35%),N5、N10处理nosZII基因丰度无显著变化,表明添加的高浓度N2O对含nosZII基因的微生物生长无明显激发作用。

图5 浅表层水稻土细菌nosZ基因丰度在培养期内的变化动态Fig.5 Dynamics of nosZ gene abundance at at 0 h and 172 h of surface paddy soil layer不同小写字母代表nosZI处理间差异显著(P<0.05), 不同大写字母代表nosZII处理间差异显著(P<0.05)
3.4 浅表层水稻土N2O氧化亚氮消耗速率与相关土壤因子关系
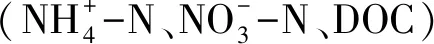
表3 浅表层水稻土N2O消耗速率与N2O添加量及相关土壤因子相关系数
Table 3 Pearson′s correlation coefficients for relationships between N2O consumption rates and N2O addition, relative soil variables of surface paddy soil layer

N2O添加量N2O additionsN2O平均消耗速率N2O consumption ratesNH+4-N消耗量NH+4-N consumptionNO-3-N消耗量NO-3-N consumptionDOC消耗量DOC consumptionnosZI基因增加量nosZI gene copies incrementnosZII基因增加量nosZII gene copies incrementN2O添加量N2O additions1.00N2O平均消耗速率N2O consumption rates0.98∗∗1.00NH+4-N消耗量NH+4-N consumption0.83∗∗0.83∗∗1.00NO-3-N消耗量NO-3-N consumption-0.82∗∗-0.86∗∗-0.91∗∗1.00DOC消耗量DOC consumption0.87∗∗0.79∗0.50-0.501.00nosZI基因增加量nosZI gene copies increment0.93∗∗0.86∗∗0.68∗-0.620.92∗∗1.00nosZII基因增加量nosZII gene copies increment-0.84∗∗-0.86∗∗-0.95∗∗0.88∗∗-0.53-0.67∗1.00
** 相关性在0.01水平上显著; * 相关性在0.05水平上显著
4 讨论
农业土壤是大气N2O排放的重要来源之一,土壤中的N2O主要是通过一系列土壤微生物作用驱动产生的。而后N2O气体在土壤剖面内迁移扩散,部分被土壤反硝化微生物利用进一步转化为分子氮(N2),部分被截留在土壤水、土壤孔隙中,剩余部分才能以N2O形式排出土壤表面[3]。土壤体截留、消耗一部分N2O后,土表N2O排放量并不总是与土壤剖面中累积的N2O产生量直接相关。Gao等通过野外监测发现频繁淹水的河岸带土壤剖面中N2O含量升高的同时,土表N2O排放量并未显著变化,推测可能是在持续厌氧的淹水环境下土壤中累积的N2O在迁移至土表前已被大量消耗[5]。本研究采用从0—5 cm土柱底部外源添加N2O气体的方法,模拟了累积在5 cm土壤深度的N2O气体迁移通过土柱后的排放动态。结果显示底部外源添加的三个浓度的N2O气体量均迅速降低,迁移扩散进了水稻土柱,但通过土柱后排放出的N2O量最高值也仅占添加总量的7.17%—9.80%,暗示0—5 cm表层水稻土在淹水厌氧状态下可截留、消耗5 cm深度N2O积累量的90%以上。Wang等通过对0—20 cm原状水稻土柱剖面N2O含量和土表N2O排放量动态耦合关系研究发现,0—5 cm土层产生的N2O大量损失,每天的N2O排放量仅占总损失量的10%左右,约90%的N2O以其他途径消耗损失[9]。这部分N2O损失途径可能是被还原转化为N2、溶解于土壤水中或是停留在土壤孔隙中[15],因此持续淹水条件下稻田土壤N2O排放量很低,甚至会出现N2O负排放的现象[16,17]。


5 结论

