低氧预处理和七氟醚预处理对短暂性全脑缺血成年大鼠的保护作用及作用机制
2019-12-03王道合赵秀丽拜承萍
王道合,赵秀丽,拜承萍
(1.青海大学医学院;2.青海大学附属医院)
对缺血性脑卒中的治疗原则是早期恢复脑灌注。随着该治疗方法的应用,脑缺血再灌注损伤(Cerebral ischemia reperfusion injury,CIR)的发生率也随之上升。大量证据表明,亚致死预处理可以提供神经保护,提高缺血耐受性[1],这个流程被称为预处理或缺血耐受。预处理有利于识别潜在的内源性保护信号级联,在目标允许治疗下,启动增强脑缺血中的内源性保护机制,并可能在缺血的情况下激活大脑的保护状态[2]。
七氟醚可在体内外诱导缺血耐受[3,4]。最近的研究表明,1.24%的七氟醚在体内和体外均能有效预防鼠类CIR[5]。
即刻早基因(IEGs)是一类异质基因,它能被大量的刺激因素(包括环境因素)迅速而短暂地激活[6],可以编码具有不同功能的蛋白,如转录因子JunB。IEGs的诱导是介导细胞对外界刺激反应的最早的细胞内机制之一[7],因而IEGs诱导被认为是近期的一种活动性标志物。
本研究应用两种预处理方法,研究不同时间点(T1、T2、T3)海马神经元的坏死情况以及即刻早基因Jun-B mRAN在I/R组、Hyp组、Sev组之间的表达情况,初步探讨其机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂
TRIZOL(Invitrogen,10296028),DEPC水(北京百奥思科生物医学技术有限公司MDL,md911875),ULtraPureAgarose(ABI-invitrogen,16500100),SuperScript III RT反转录kit(ABI-invitrogen,11752050),Sybr qpcr mix(ABI-invitrogen,4472920)。
1.1.2 主要仪器
正置荧光显微镜(Leica,DM3000),台式高速冷冻离心机(THERMO,LEGEND MICRO 21R),核酸浓度测定仪(THERMO,Nanodrop little),qPCR仪[Applied biosystems(USA),7900 Fast ],电泳仪(biorad EPS,300),凝胶成像仪(biorad,2500)。
1.1.3 实验动物与模型
动物:
成年健康Sprague-Dawley(SD)大鼠(SPF级;体重240~250g)由斯贝福(北京)生物技术公司提供(动物合格证号:11401500040906)。将大鼠分成全脑缺血再灌注损伤组(I/R组)、低氧预处理组(Hyp组)、七氟醚预处理组(Sev组)。每组12只(使用了40只,其中4只在造模后死亡)。
模型:
I/R组模型:按照 Pulsinelli经典的大鼠四血管闭塞法[8]制作tGCI动物模型。用10%水合氯醛(350mg/kg,i.p.)麻醉。行颈部正中横切口,分离两侧颈总动脉(约1cm)后用硅胶管系于颈总动脉周围并将其穿过聚乙烯纽扣的两个小孔,再穿过一个2 cm长的塑胶圆筒打结(避免血管受压和血流受阻),简易缝合切口。将大鼠固定于定位仪上,于枕部做纵切口,暴露第一颈椎板及横突板上的翼小孔,用双极电凝针电凝双侧翼小孔内的椎动脉,缝合切口。待动物完全苏醒后将其移至笼内饲养,夜间禁食,此时动物行为正常,没有明显的脑损伤。24 h后在大鼠完全清醒的状态下,夹闭双侧颈总动脉。大鼠在缺血30~60 s内昏迷(翻正反射消失,双侧瞳孔放大,痛觉反射消失,这些症状持续于整个缺血过程中,凡未出现以上症状或这些症状未能持续整个缺血过程的大鼠弃用)。缺血10 min后恢复脑血流,大鼠恢复知觉开始活动,未见明显障碍(凡缺血后有癫痫、偏瘫、惊厥等症状的大鼠均弃用)。
Hyp组模型:用低压氧舱预处理大鼠。将低压氧仓(XF-2CL)氧气浓度设定为8%(模拟海拔4000m),关闭箱门排气1 min后,将大鼠放入箱内,每天1 h(同一时间,连续5d)。
Sev组模型:用七氟醚预处理大鼠。将大鼠放置在密闭的麻醉箱内,接受2.4%七氟醚与100%氧气混合气体的预处理,每天1 h(同一时间,连续5d)。
各组在缺血10 min后恢复血流灌注,于对应时间点[4h(T1)、24h(T2)、168h(T3)]断头取材(海马组织),部分置于20%蔗糖中固定用于FJB染色;部分置于-70 ℃冰箱保存用于Qpcr检测。
1.2 实验方法
1.2.1 FJB染色
将海马组织用20%蔗糖固定过夜后行冰冻切片(25μm);切片用0.1 M的磷酸盐缓冲液轻轻冲洗后覆盖2%的明胶,在50 ℃的烘箱中烘干(至少半小时)。将烘干的切片依次浸入含1%NaOH的80%乙醇(将20mL 5% NaOH加入80mL无水乙醇中)内5 min,然后浸入70%乙醇中,最后置于双蒸水中(2min)。从双蒸水中将切片转移至0.06%的高锰酸钾溶液10 min后在ddH2O中冲洗2 min。
准备0.01%的FJB储存液,将10 mg的染料粉末加到100 mL的ddH2O中,充分混合。准备100 mL的0.0004% FJB染色溶液,加入4 mL的FJB储存液到96 mL的0.1%醋酸溶液中。
将切片置于染色溶液中20 min后用ddH2O冲洗(1min×3times)。
1.2.2 Qpcr检测
1.2.2.1 RNA提取
将样本分别用液氮冷冻后研磨粉碎,加1 mL Trizol(invitrogen)到1.5 mL EP管中,加入500 μL酚氯仿,振荡混匀,静置5 min后离心(4℃,12000r/min)10 min,小心吸取上层上清液加入700 μL异丙醇,混匀后离心(4℃,12000r/min)10 min,小心去上清液,用75%乙醇洗涤一次,晾干,溶于50 μL DEPC处理液中,溶解沉淀。
1.2.2.2 反转录
按照以下方法建立10 μL反应体系(RNA200ng、MDL Oligo-dT1μL、MDL Random 1μL):混匀,离心(65℃,12000r/min)5 min,结束后置于冰上。
在上述反应体系中加入下列反应液:10 mmd/L dNTP(1μL,MDL )、0.1 M DTT(2μL)、5×Buffer(4μL)、RT酶(1μL,ABI)。混匀,离心,水浴(42℃,60min)。取出后继续水浴(85℃,10min),以灭活逆转录酶。反应结束后置-20 ℃冰箱待用。
1.2.3 扩增
每个样本分别用待检测基因和内参基因引物扩增,每个反应重复3遍,按照以下体系建立扩增体系(20μL):cDNA(2μL),qPCR mix(10μL),primer F(1μL),primer R(1μL),ddH2O(6μL)。于qPCR(ABI 7900)仪上,按照以下反应条件实验(40个循环):95 ℃(2min)、94 ℃(20s)、60 ℃(20s)、72 ℃(30s)。
1.3 统计学方法
2 结果
2.1 各组大鼠海马神经元坏死情况
结果显示,三组不同时间点脑组织海马坏死神经元数目不同:与I/R组相比,在T1、T2、T3点,各组FJB阳性细胞显著减少(P<0.01)。见表1、图1。
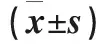

Table 1 Necrosis of hippocampal neurons in different groups
*:与I/R组比较,P<0.01
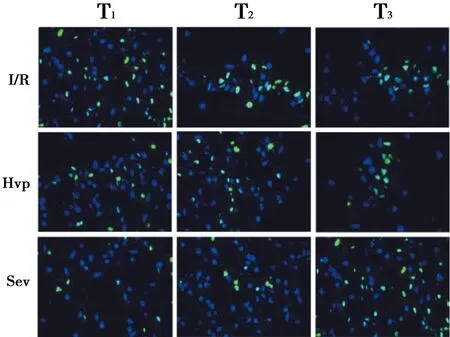
绿色荧光表示海马中FJB阳性细胞
2.2 不同时间点脑组织海马Jun-B mRAN表达情况
三组不同时间点脑组织海马Jun-B mRAN表达含量不同:(1)与I/R组相比,在T1、T2、T3点,各组海马Jun-B mRAN表达量均有显著较少(P<0.01)。见表2。
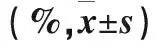

Table 2 Contents of Jun-B mRAN
*:与I/R组比较,P< 0.01
3 讨论
缺血性中风是死亡的第二大原因,也是长期致残的最常见原因[9],其发生与代谢紊乱、兴奋性氨基酸释放、钙超载、自由基损伤、炎症反应等因素有关[10]。脑缺血主要有三种病理类型:(1)缺血性卒中;(2)原发性脑出血;(3)蛛网膜下腔出血[11]。然而,目前针对缺血性卒中有效的临床治疗方法很少[12]。缺血早期再灌注对缺血脑组织血流的迅速恢复至关重要[13]。但在某些情况下,再灌注的使用并不利于大脑功能的恢复,反而会进一步加剧缺血引起的功能障碍和结构损伤,即CIR[14]。作为对缺血缺氧最敏感的神经元细胞,在脑CIR过程中神经元遭受CIR损伤产生再灌注预后不良现象[15]。显然,针对CIR的保护策略对缺血性脑卒中的治疗具有重要意义,而目前针对缺血性脑卒中的保护策略仍然不足,需要探究更多的方法。低氧预处理(HPC)可增强缺氧缺血性损伤的耐受性,通过特定的机制提供神经保护,减少细胞损伤凋亡[16,17];麻醉预处理在体内外均对脑缺血具有神经保护作用[18],七氟醚预处理通过减少细胞损伤和抑制神经元凋亡发挥神经保护作用[19]。此外,七氟醚亦被证明可以通过减少梗死周围区域的神经元凋亡和炎症来保护受损的神经元[20]。JunB属激活蛋白-1(AP-1)蛋白亚家族JUN成员,而AP-1是一种二聚体转录因子,由Jun(c-Jun、JunB、JunD)、Fos(c-Fos、FosB、Fra1、Fra2)和活化转录因子蛋白家族等蛋白组成。AP-1转录因子家族通过不同的刺激,如炎症因子、应激诱导因子或病原体等激活,此外此信号传导还可以控制多种细胞活动过程(包括增殖、分化、迁移、生存或死亡[21,22]),通过MAP激酶(MAPK)为基础的级联反应参与c-Jun n -末端激酶(JNKs)或细胞外信号调节激酶激活AP-1复合物的信号[23,24]。
本研究结果提示:
(1)FJB染色检测中:Hyp组、Sev组坏死神经元比I/R组显著降低(P<0.01);(2)Qpcr检测中:Hyp组、Sev组Jun-B mRAN表达含量比I/R组显著降低(P<0.01),说明以上两种预处理方法对tGCI大鼠有明显的保护作用,且此保护作用是通过调控Jun-B表达来实现的。
综上所述,本实验研究发现,低氧预处理、七氟醚预处理是通过调控JunB 发挥脑保护作用的。虽然其具体机制还有待研究,但已明确的具体调控因子为临床CIR防治提供了新策略。
