TRPV4 过表达载体转染促进骨髓间充质干细胞向神经细胞分化的相关研究
2019-12-03董小群李晓飞杨骐宁
董小群,李晓飞,杨骐宁
(金华市中心医院,浙江 金华321000)
神经系统的损伤具有创伤大、危险系数高、康复难的特点。 如何促进神经系统的快速恢复也是目前我国康复医学面临的巨大挑战[1-2]。 目前,神经系统疾病尚无可靠的治疗方案,主要依靠针灸、药物等辅助治疗方法[3]。 干细胞领域对于此类损伤的治疗具有潜在的应用价值[4]。而骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BMSCs)具有多向分化潜能,在特定环境下可以分化成人体内的各种细胞。 有研究报道,BMSCs 可定向分化为神经细胞[5]。 但是,干细胞具有来源少、分化能力低的特点[6]。应用基因工程原理,增强BMSCs 的分化能力可以有效解决这一问题, 本研究提取兔BMSCs,利用流式细胞仪进行鉴定,检测骨髓间充质干细胞CD 分子表达,探究其生物学行为。 瞬时感受器电位离子通道香草素受体亚家族4(TRPV4) 是瞬时感受器电位离子通道家族(Transient Receptor Potential, TRP) 中的亚类,与真核生物细胞的生物学行为密切相关[7]。 有研究报道,脊髓损伤小鼠背根神经元修复过程中可以检测到TRPV4 蛋白的过表达[8]。 立足于此,本研究利用shRNA 技术构建TRPV4 的过表达载体,通过慢病毒介导转染BMSCs, 以神经细胞标志物外周蛋白Peripherin 和神经元特异性烯醇化酶 (NSE) 为指标,观察TRPV4 的过表达载体促进BMSCs 向神经细胞分化的能力,为干细胞促进神经损伤修复提供新的思路与方法。
1 材料与方法
1.1 材料 1640 细胞培养基和PBS 溶液购自北京碧云天公司;胎牛血清购自以色列BI 公司;2.5g/L胰酶细胞消化液购自上海博谷生物科技有限公司;Trizol 试剂、 逆转录PCR 试剂盒和荧光定量PCR试剂盒均购自日本TAKARA 公司;TRPV4、神经细胞标志物Peripherin 和NSE、山羊抗兔一抗、鼠抗山羊HRP 二抗均购自美国Abcam 公司。
1.2 实验方法
1.2.1 兔源骨髓间充质干细胞的培养和鉴定 成年新西兰大白兔5 只, 购自济南实验动物中心,均为SPF 级,体质量(9.90±0.45)kg,均为雄性。腹腔注射0.5%水合氯醛麻醉后股骨去毛备皮, 常规消毒铺巾,穿刺针取骨髓组织,加入5mL 含20% FBS 的1640 培养液, 置入37℃、5%CO2培养箱中培养,3天换1 次液, 倒置光学显微镜观察细胞生长状态。利用流式细胞仪检测骨髓间充质干细胞CD 分子表达,从而鉴定原代BMSCs。
1.2.2 TRPV4 过表达载体构建 利用Pubmed 基因库筛选TRPV4 的基因序列,确定兔源TRPV4 位于第12 染色体, 基因序号为NC_005111.4。 利用shRNA 技术,扩增TRPV4 的基因,将扩增基因片段整合入环状RNA 质粒,稳定基因表达,同时酶切慢病毒载体,利用慢病毒进行转染筛选,抽提慢病毒以备用。
1.2.3 实验分组 根据实验方案, 将BMSCs 细胞分成三组,即空白对照组、阴性对照组和过表达载体组。空白对照组BMSCs 细胞未做任何处理,阴性对照组BMSCs 细胞给予随机基因序列质粒慢病毒转染,过表达载体组BMSCs 细胞给予TRPV4 基因过表达载体质粒慢病毒转染。
1.2.4 Peripherin 和NSE 的mRNA 相对表达水平采用荧光定量PCR 检测TRPV4。慢病毒转染72 小时后,加入2mL 2.5g/L 胰酶细胞消化液收集上述三组BMSCs 细胞,加入1mL Trizol 试剂,充分混合后提取细胞总RNA,室温条件下根据逆转录试剂盒说明书配置20μL 的逆转录体系, 加入总RNA,37℃水浴箱孵育30 分钟,将总RNA 逆转录为cDNA,-20℃低温冰箱保存。 然后根据荧光定量PCR 试剂盒说明书配置50μL 的荧光定量PCR 反应体系,加入cDNA、TRPV4 和神经细胞标志物Peripherin、NSE 的引物模板, 置于Applied Biosystems PCR 仪进行反应,设置条件按照说明书。 统计并记录样本CT 值,利用2-△△CT方法计算目的基因相对表达量。

表1 引物序列
1.2.5 Peripherin 和NSE 的相对表达水平 采用Western blot 检测TRPV4。 神经细胞标志物慢病毒转染72 小时后收集上述三组BMSCs 细胞,丢弃掉培养基PBS 清洗后加入2mL RIPA 细胞裂解液,冰上孵育45 分钟,细胞刮收集细胞碎片,加入PE 管中, 预冷高速离心机,4℃12000rpm/min, 收集总蛋白,加入10μmL LPMSF,100℃煮沸,BAD 试剂盒测定蛋白的分子量。 按照说明书配置10%分离胶和4%浓缩胶,加入50ng 蛋白量,1×SDS 上样缓冲液浸没胶板,40V 电泳2 小时后转染到硝酸纤维素膜,TBST 洗膜后过夜孵育TRPV4、Peripherin 和NSE 的蛋白一抗,TBST 液洗膜,常温孵育鼠抗山羊HRP 二抗30 分钟,DAB 显影,Image J 软件分析蛋白条带。
1.3 统计学处理 采用SPSS 20.0 软件进行统计分析,计量资料用(±s)表示,空白对照组、阴性对照组和过表达载体组的RT-PCR 和Western blot 数据结果比较采用单因素方差分析,组间比较采用q 检验。
2 结果
2.1 兔源骨髓间充质干细胞的培养和鉴定 原代BMSCs 为贴壁细胞;P2 代BMSCs 细胞呈旋涡状生长。流式细胞仪结果显示,P2 代BMSCs 的CD44 和CD29 表达量为60.2%和58.3%;CD34 和CD45 表达量为3.4%和2.6%,详见图1。
2.2 TRPV4 过表达载体质粒的构建和慢病毒转染转染效率=绿色荧光细胞数/白色荧光细胞数×100%,慢病毒转染效率较高,在90%以上,详见图2。
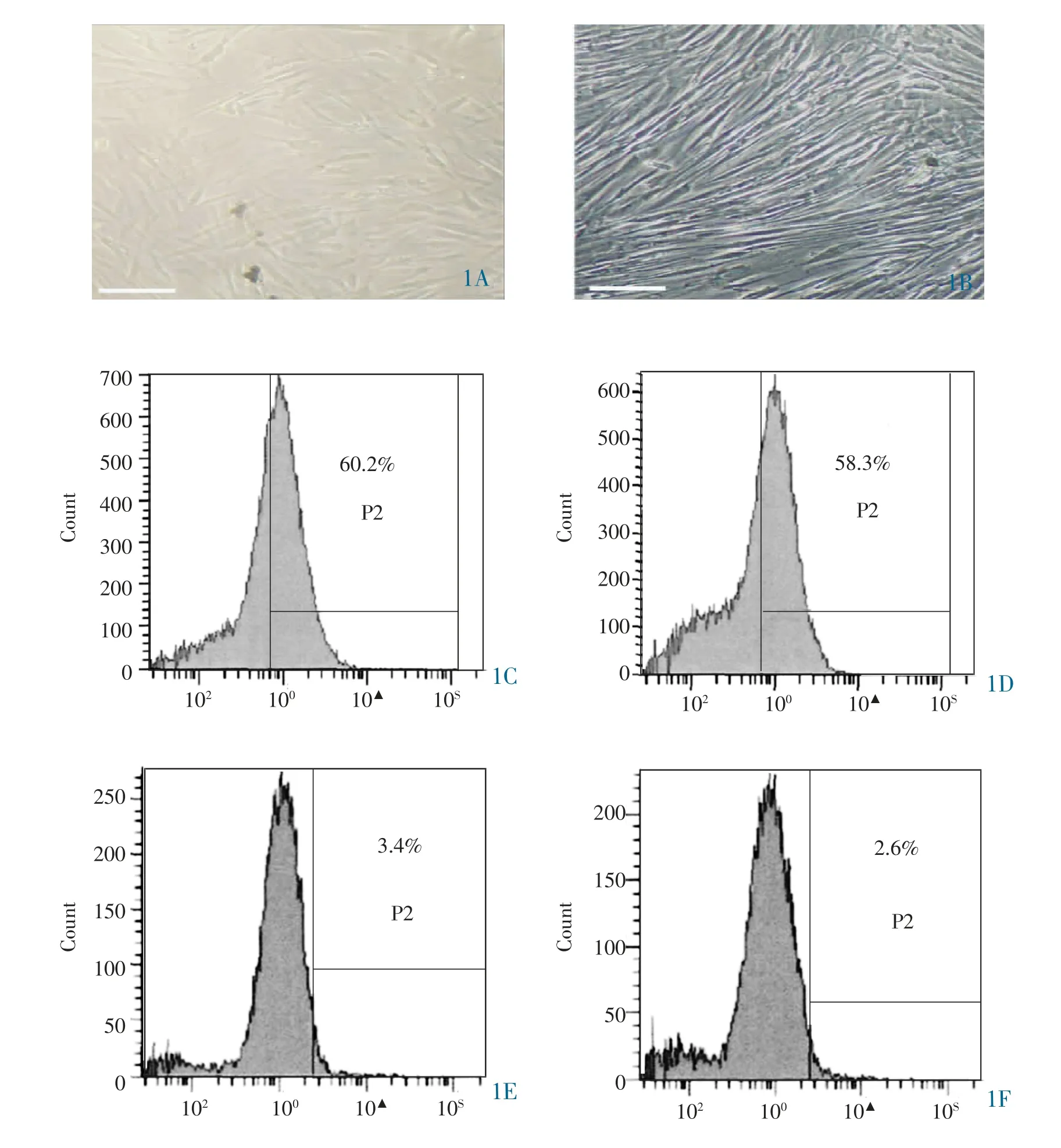
图1 人BMSCs 的培养和鉴定。 1A:原代BMSCs(×200,标尺为1mm);1B:P2 代BMSCs(×200,标尺为1mm);1C:P2 代BMSCs 表面蛋白CD44 的表达量为60.2%;1D:P2 代BMSCs 表面蛋白CD29 的表达量为58.3%;1E:P2 代BMSCs 表面蛋白CD34 的表达量为3.4%;1F:P2 代BMSCs 表面蛋白CD45 的表达量为2.6%。

图2 慢病毒转染BMSCs(×200,标尺为1mm)。 2A:白光视野下BMSCs;2B:荧光视野下BMSCs。
2.3 TRPV4、Peripherin 和NSE 的mRNA 相对表达水平 空白对照组、 阴性对照组和过表达载体组TRPV4 的mRNA 相对表达量比较差异具有统计学意义(F=9.004,P<0.05),空白对照组和阴性对照组比较差异无统计学意义(q=2.897,P>0.05),过表达载体组TRPV4 的mRNA 相对表达量要明显高于空白对照组和阴性对照组 (q=2.897,q=3.001;P<0.05)。 空白对照组、 阴性对照组和过表达载体组Peripherin 的mRNA 相对表达量比较差异具有统计学意义(F=11.275,P<0.01),空白对照组和阴性对照组比较差异无统计学意义(q=2.461,P<0.05),过表达载体组Peripherin 的mRNA 相对表达量明显高于空白对照组和阴性对照组 (q=2.631,q=2.671;P<0.05)。 空白对照组、阴性对照组和过表达载体组NSE 的mRNA 相对表达量比较差异具有统计学意义(F=13.997,P<0.01),空白对照组和阴性对照组比较差异无统计学意义(q=2.674,P<0.05),过表达载体组NSE 的mRNA 相对表达量明显高于空白对照组和阴性对照组 (q=2.017,q=3.211;P<0.05)。 详见表2。

表2 TRPV4、Peripherin 和NSE 的mRNA 相对表达水平(2-△△CT)
2.4 TRPV4、Peripherin 和NSE 的蛋白相对表达水平 如图3 所示,空白对照组、阴性对照组和过表达载体组TRPV4 的蛋白含量比较差异具有统计学意义(F=9.764,P<0.05),空白对照组和阴性对照组比较差异无统计学意义(q=2.871,P>0.05),过表达载体组TRPV4 的蛋白含量明显高于空白对照组和阴性对照组(q=2.001,q=3.658;P<0.05)。 空白对照组、阴性对照组和过表达载体组Peripherin 的蛋白含量比较具有统计学意义(F=9.977,P<0.05),空白对照组和阴性对照组比较差异无统计学意义 (q=3.221,P<0.05),过表达载体组Peripherin 的mRNA相对表达量明显高于空白对照组和阴性对照组(q=2.002,q=2.451;P<0.05)。 空白对照组、阴性对照组和过表达载体组NSE 的mRNA 相对表达量比较差异具有统计学意义(F=7.468,P<0.05),空白对照组和阴性对照组比较差异无统计学意义(q=2.897,P<0.05),过表达载体组NSE 的mRNA 相对表达量明显高于空白对照组和阴性对照组 (q=2.761,q=2.116;P<0.05)。

图3 TRPV4、Peripherin 和NSE 的蛋白相对表达水平。3A:TRPV4、Peripherin 和NSE 的蛋白条带;3B:蛋白灰度值的统计分析。
3 讨论
神经损伤修复较慢, 并且术后康复效果不佳,单纯依靠药物和物理治疗效果甚微[9],干细胞的多分化潜能为神经细胞的修复提供新的思路。 但是干细胞来源少、分化程度低,且易老化、易凋亡的特点限制了其应用。 既往学者通过各种途径诱导骨髓间充质干细胞向神经细胞分化,比如利用中药成分人参皂甙Rb[10]、丹酚酸B[11]、龟板提取物[12]等。本研究利用基因工程原理, 通过shRNA 技术构建TRPV4 基因过表达载体,旨在提高干细胞的分化水平,从而提供足够的可定向分化的细胞。 结果表明,TRPV4 基因过表达载体可以促进骨髓间充质干细胞向神经细胞分化,与既往学者研究相同,可以得到较多数量的神经细胞。 TRPV4 是一种机械激活离子通道,可以广泛表达于脊髓背根元细胞中,并且与小鼠脊髓背根神经元损伤的神经疼痛密切相关[13]。 本研究着眼于TRPV4 的神经诱导作用, 通过shRNA 技术构建TRPV4 的过表达载体,慢病毒转染BMSCs,观察其促神经分化作用。 结果表明,TRPV4 的过表达载体可以促进骨髓间充质干细胞向神经细胞分化,充分说明TRPV4 的过表达载体可以促进干细胞的分化,可以解决干细胞分化能力低的问题,为干细胞的应用前景提供新的思路。
Peripherin 和NSE 均是外周神经元的特异性标记物[14]。既往研究表明,螺旋神经元细胞可见外周蛋白Peripherin 的表达, 并且参与神经细胞的成熟过程[15]。 NSE 参与外周神经元和中枢神经元的修复过程,与中枢性脑梗死功能的恢复和认知功能密切相关[16]。 本研究选择Peripherin 和NSE 作为神经分化的标志物, 通过RT-PCR 和Western blot 检测TRPV4 的过表达载体对骨髓间充质干细胞的分化诱导作用。 结果表明,过表达载体组细胞的Peripherin和NSE mRNA 和蛋白的表达水平均高于空白对照组和阴性对照组, 说明TRPV4 的过表达载体可以促进骨髓间充质干细胞向神经细胞分化。
然而, 本研究没有明确TRPV4 的过表达载体促进骨髓间充质干细胞向神经细胞分化的具体作用机制及信号通路,需作进一步的研究。
