悬铃木球果总黄酮提取及其抗氧化活性研究
2019-12-02孙平向泽栋董丹华高鹏
孙平 向泽栋 董丹华 高鹏

摘 要: 以悬铃木成熟的球果为原料,通过单因素和正交试验对超声波辅助提取悬铃木总黄酮的工艺进行优化;并通过考察总黄酮对DPPH自由基和ABTS自由基的清除率来评价其抗氧化活性。结果表明,悬铃木总黄酮的最佳提取条件如下:乙醇体积分数为60%,料液比为1∶25(g/mL),超声时间30 min,超声温度60 ℃,在此优化条件下,总黄酮的含量为21.82 mg/g。总黄酮质量浓度为20 μg/mL时,具有较强的清除自由基能力,清除DPPH自由基和ABTS自由基为85.38%和98.84%。
关 键 词:悬铃木;球果;超声辅助提取;总黄酮;抗氧化活性
中图分类号:R284.2 文献标识码: A 文章编号: 1671-0460(2019)10-2214-05
Abstract: Using the mature cones of Platanus as raw material, on the basis of single factor tests, the optimum conditions of ultrasonic-assisted extraction of total flavonoids were optimized by orthogonal tests. Meanwhile, the antioxidant activity of total flavonoids from Platanus was evaluated by DPPH and ABTS+ scavenging capacity. The results showed that the optimal extraction conditions of total flavonoids were as follows: the ethanol volume 60%, the ratio of water to raw material 1:25(g/mL),the ultrasonic temperature 60 ℃, the time 30 min. Under these conditions, the total flavonoids content was 21.82 mg/g. When the total concentration of flavonoids was 20 μg/mL, the scavenging rate of total flavonoids on DPPH and ABTS+ were 85.38% and 98.84%, which indicated that the total flavonoids of Platanus had strong antioxidant activity.
Key words: Platanus; Cones; Ultrasonic-assisted extraction; Total flavonoids; Antioxidant activity
悬铃木为悬铃木科(Platanaceae)落叶大乔木,亚洲、欧洲和北美洲为其主要栽种地区[1]。我国引入栽培主要是一球、二球和三球悬铃木三种,其中杂交种二球悬铃木[2]是我国的主要栽培品种。悬铃木被称为“行道树之王”,可以净化空气微小颗粒、隔音防噪和降低地面温度,并且在民间还使用树皮治疗腹泻、牙痛[3]等疾病。经现代研究发现,悬铃木拥有多种化学成分,如黄酮、多酚、三萜、糖苷、有机酸及其衍生物等[4-6],并且分离出新型骨架成分[7]。
此外还从悬铃木的不同组织器官中提取分离出具有抗氧化、抗炎、细胞毒性、抑菌活性、抑制小鼠妊娠、抗肿瘤、抗HIV、保护肝肾、解偶联[4,8-13]等生物活性物质。但在4-6月份,悬铃木成熟球果开始脱落,在外力作用下果毛四处飞散,造成过敏和炎症[14]和环境污染。目前对悬铃木的研究主要集中在树皮和叶子上,对球果尤其是成熟的球果研究较少。因此,通过超声辅助溶剂提取法提取悬铃木中的总黄酮成分,并应用单因素和正交试验优化提取工艺,探究悬铃木总黄酮对DPPH自由基和ABTS+自由基的清除能力。根据提取工艺优化结果和抗氧化能力分析,可以为悬铃木总黄酮的开发应用提供理论依据,还为其活性成分和药理作用的进一步研究奠定基础。
1 实验部分
1.1 实验材料
悬铃木球果 采自山东中医药大学校内;芦丁对照品(纯度≥98%) 购自上海源叶生物;DPPH、ABTS 购自上海麦克林公司;乙醇 购自天津市四通化工厂;维生素C(Vc) 购自国药集团;其他试剂 均为国产分析纯。
1.2 实验仪器
KQ-500E型超声波清洗机 昆山市超声仪器有限公司;DFY-600C高速粉碎机 无锡久平仪器有限公司;XS105DU电子天平 梅特勒-托利多集团;752型紫外可见分光光度计 上海舜宇恒平科学仪器有限公司。
2 实验方法
2.1 懸铃木总黄酮提取
悬铃木球果干燥后粉碎并过24目筛。取约1.0 g样品,精密称定,置于具塞锥形瓶中,按照不同的考察因素对总黄酮进行超声辅助溶剂提取,离心取得上清液,制得总黄酮提取液。
2.2 芦丁标准曲线绘制
采用硝酸钠-亚硝酸铝比色法测定悬铃木总黄酮含量,精密称定20 mg芦丁对照品,用60%乙醇配置成0.20 mg/mL的芦丁标准品溶液。准确吸取0.0、2.5、5.0、7.5、10.0、12.5 mL的标准品溶液于25 mL量瓶中,加入1.0 mL 5 %亚硝酸钠溶液、1.0 mL 10%硝酸铝溶液,震荡均匀后放置5 min,再加10.0 mL 4%氢氧化钠溶液,用60%乙醇加至刻度线,震荡均匀后放置15 min[15]。以芦丁试剂空白作为参比液,在505 nm波长下测吸光度,根据芦丁浓度和吸光度绘制标准曲线。
2.3 单因素试验
采用2.1下法提取悬铃木总黄酮,提取条件为:料液比1∶20 g/mL、超声时间30 min、超声温度60 ℃、使用不同乙醇体积分数(40、50、60、70、80%)提取,测定总黄酮的提取率;乙醇体积分数60%、超声时间30 min、超声温度60 ℃、根据总黄酮的提取率考察不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30 g/mL)的影响;乙醇体积分数60%、料液比1∶20 g/mL、超声温度60 ℃、使用不同超声时间(20、25、30、35、40 min)提取,测定总黄酮的提取率;乙醇体积分数60%、料液比1∶20 g/mL、超声时间30 min、使用不同超声温度(40、50、60、70、80 ℃)提取,测定总黄酮的提取率。
2.4 正交优化试验设计
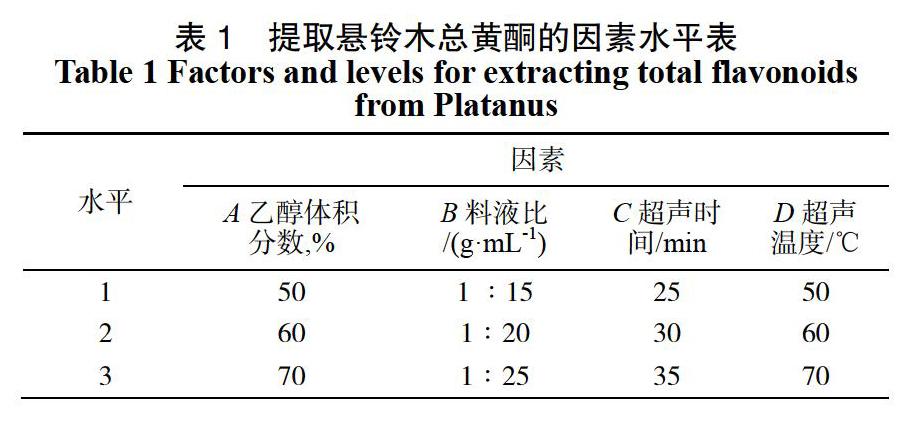
根据单因素试验结果,L9(34)正交试验见表1。
2.5 抗氧化活性测定
将悬铃木总黄酮配制成0、2.5、5、7.5、10、12.5、15、17.5、20μg/mL质量浓度,以Vc为对阳性照,分别测定其对DPPH自由基和ABTS+自由基的清除率,评价其抗氧化活性。
2.5.1 悬铃木总黄酮对DPPH自由基清除能力测定
参照文献[16,17]的测定方法并稍加修改。配制50μg/mL的DPPH乙醇溶液,取1与1 mL不同浓度的样品溶液或Vc溶液充分混匀,室温下暗处放置30 min,在517 nm波长处测吸光度。计算公式如下:
DPPH自由基清除率=1-(A1-A2)/A0
式中: A1 —样品组吸光度;
A2 —样品本底吸光度(以等体积无水乙醇代替DPPH溶液);
A0 —空白对照组吸光度(以等体积蒸馏水代替样品溶液)。
2.5.2 悬铃木总黄酮对ABTS+自由基清除能力测定
参照文献[18,19]的测定方法并稍加修改。配制7 mmol/mL的ABTS+溶液,室温下与等体积的4.9 mmol/mL过硫酸钾溶液混合后暗处放置12 h,制成ABTS+储备液,用pH=7.4的磷酸缓冲液稀释储备液20倍制成ABTS+工作液。取不同浓度的样品溶液和Vc溶液1 mL,加入2.0 mL的ABTS+工作液,震摇均匀后常温暗处放置10 min,在734 nm波长处测吸光度。计算公式如下:
ABTS+自由基清除率=1-(A1-A2)/A0
式中: A1 —样品组吸光度;
A2 —样品本底吸光度(以等体积蒸馏水代替ABTS+溶液);
A0 —空白对照组吸光度(以等体积蒸馏水代替样品溶液)。
2.6 数据处理
所有试验均重复进行3次,采用GraphPad Prism 8.0.2对结果进行分析,结果表示为平均值±标准偏差(mean±SD)。
3 结果分析
3.1 芦丁标准曲线
以芦丁为对照品,根据芦丁浓度和吸光度的测定结果绘制标准曲线如图1。线性回归方程为Y=11.95X+0.005 7,R2=0.999 4,其中Y为吸光度,X为芦丁浓度。
3.2 单因素试验结果
3.2.1 乙醇体积分数对总黄酮提取率的影响
由图2可知,在乙醇体积分数较小时,乙醇体积分数增加会导致总黄酮提取率增加,在60%时黄酮提取率最大,之后呈现急剧下降趋势。推测这是由于悬铃木总黄酮极性较大,当乙醇体积分数过高时,不利于溶解黄酮物质。当乙醇体积分数较低时,会有部分多糖等水溶性杂质溶出[20]。因此选择乙醇体积分数为60%。
3.2.2 料液比对总黄酮提取率的影响
由图3可知,料液比的变化导致总黄酮提取率呈现出先增大后降低的趋势,在1∶20 g/mL时黄酮提取率最大,之后呈现缓慢下降趋势。推测由于总黄酮在料液比1∶20 g/mL时基本溶出,继续增加溶剂用量会使其他杂质增加溶出,使黄酮提取率下降[21]因此选择料液比为1∶20 g/mL。
3.2.3 超声时间对总黄酮提取率的影响
由图4可知,总黄酮提取率随着超声时间的增大呈现出先增大后降低的趋势,在30 min时黄酮提取率最大,之后呈现缓慢下降趋势。可能因为过长的超声时间会破坏黄酮类化合物结构,使其容易于分解, 而且超声时间过长温度不好控制, 导致乙醇的挥发, 引起提取率的下降[22]。因此选择超声时间为30 min。
3.2.4 超声温度对总黄酮提取率的影响
由图5可知,总黄酮提取率随着超声温度的增大呈现出先增大后降低的趋势,在30 min时黄酮提取率最大,之后呈现缓慢下降趋勢。可能由于温度增加会使黄酮成分被破坏,而且也会增加杂质溶出。因此选择超声温度为60 ℃。
3.3 正交优化试验设计结果
由表2正交试验结果分析可知,各提取工艺条件对总黄酮提取率影响程度不同,根据极差分析结果可知,对总黄酮提取率的影响主次顺序为A>B>C>D,即乙醇体积分数的影响最大,其次是料液比,超声温度对提取率的影响最小。悬铃木总黄酮最佳提取工艺为A2B3C2D2,即乙醇体积分数60%,料液比1∶25 g/mL,超声时间30 min,超声温度60 ℃。对最优组合进行验证试验,结果显示为21.82 mg/g,大于正交试验结果中的最大含量21.39 mg/g,表明此提取方法重复性良好,提取率高,适用于提取悬铃木总黄酮。
3.4 对DPPH自由基清除能力的测定结果
由圖6可知,总黄酮质量浓度在0~20μg/mL范围内,随着总黄酮质量浓度的增加,DPPH自由基清除率随之增加。当总黄酮质量浓度为20μg/mL时,对DPPH自由基清除率达到85.38%,阳性对照Vc为77.23%。以上结果表明悬铃木总黄酮对DPPH自由基有良好的清除的能力。
3.5 对ABTS+自由基清除能力的测定结果
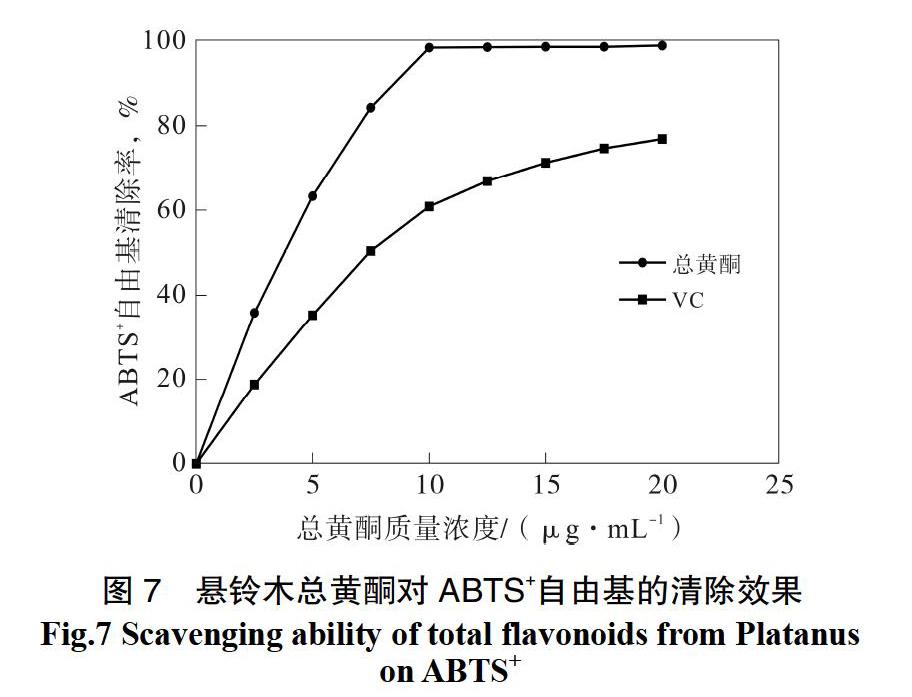
由图7可知,总黄酮质量浓度在0~20μg/mL范围内,随着总黄酮质量浓度的增加,ABTS+自由基清除率随之增加。当总黄酮质量浓度为10μg/mL时,对ABTS+自由基清除率达到98.38%,之后在总黄酮质量浓度在10~20μg/mL之间,ABTS+自由基清除率保持相对稳定。总黄酮质量浓度在20μg/mL时,对ABTS+自由基清除率达到98.38%,高于同浓度阳性对照Vc对ABTS+自由基清除率66.33%。以上结果说明悬铃木总黄酮具有很高的清除ABTS+自由基的能力。
4 结 论
通过单因素和正交试验,对悬铃木总黄酮的超声辅助提取工艺进行优化确定:乙醇体积分数60%、料液比1∶25 g/mL、超声时间30 min、超声温度60 ℃,悬铃木总黄酮提取率为21.82 g/mg。
通过抗氧化试验,结果表明在0~20μg/mL范围内,悬铃木总黄酮对DPPH自由基和ABTS+自由基清除率逐渐增加,总黄酮浓度在20μg/mL时,对DPPH自由基和ABTS+自由基清除率分别达到85.38%和98.84%,说明悬铃木总黄酮具有较强的抗氧化能力。
参考文献:
[1]Carpenter RJ, Hill RS, Jordan GJ. Leaf cuticular morphology links Platanaceae and Proteaceae[J].International Journal of Plant Sciences, 2005, 166 (5): 843-855.
[2]Yang CH,Yang Y,Liu JH.Platachromone A-D:Cytotoxic 2-styrylchromones from the bark of Platanus x acerifolia (Aiton) Willd[J].Phytochemistry Letters,2013,6(3):387-391.
[3] Nishanbaev SZ,Kuliev ZA,Khidyrova NK,et al.New oligomeric proanthocyanidins from bark of Platanus orientalis[J].Khim Prir Soedin,2005,41(4):404-409.
[4] Kaouadji M.Further prenylated flavonols from Platanus acerifolia's unripe buds[J].Tetrahedron Letters,2014,55(7):1285-1288.
[5]Ei-Alfy TS,Ei-Gohary HMA,Sokkar NM,et al.Phenolic constituents of Platanus orientalis L.leaves[J].Natural Product Communications,2008,3(2):199-203.
[6]Khan I,Sangwan PL,Dar AA,et al.A validated high-performance thin-layer chromatography method for the identification and simultaneous quantification of six markers from Platanus orientalis and their cytotoxic profiles against skin cancer cell lines[J].Journal of Separation Science,2013,36(16):2602-2610.
[7]Yang CH,Liu JH,Yang Y.Preparation and application of new styrylchromones: CN,101525323A[P].2009-09-09[2013-01-16].
[8] Chatzigeorgiou S,Thai QD,Tchoumtchoua J,et al.Isolation of natural products with anti-ageing activity from the fruits of Platanus orientalis[J].Phytomedicine,2017,33:53-61.
[9] Haider S,Nazreen S,Alam MM,et al.Anti-inflammatory and anti-nociceptive activities of Platanus orientalis Linn.and its ulcerogenic risk evaluation[J].Journal of Ethnopharmacology,2012, 143(1):236-240.
[10] Mitrokotsa D,Mitaku S,Demetzos C,et al.Bioactive Compounds From the Buds of Platanus Orientalis and Isolation of a New Kaempferol Glycoside[J].Planta Med,1993,59(6):517-520.
[11] Thai QD,Tchoumtchoua J,Makropoulou M,et al.Phytochemical study and biological evaluation of chemical constituents of Platanus orientalis and Platanus × acerifolia buds [J].Phytochemistry,2016,130:170-181.
[12] Bastos DZ,Pimentel IC,de Jesus DA.Biotransformation of betulinic and betulonic acids by fungi[J]. Phytochemistry,2007,68(6):834-839.
[13] Ravanel P,Tissut M,Douce R.Platanetin:A potent natural uncoupler and inhibitor of the exogenous NADH dehydrogenase in intact plant mitochondria[J].Plant Physiology February,1986,80(2):500-504.
[14]Wang J,Wu Y,Li J, et al.Eight Aeroallergen Skin Extracts May Be the Optimal Panel for Allergic Rhinitis Patients in Central China.Int Arch Allergy Immunol,2017,173(4):193-198.
[15] 崔鹏,高元栋,李玉文,袁岐山.响应面法优化超声辅助提取花椒叶黄酮工艺研究[J].食品研究与开发,2018,39(08):53-60.
[16] 姚新鼎,姜飞燕,王玉伟,等.微波辅助提取山竹壳中的总黄酮及其体外抗氧化活性研究[J].食品研究与开发,2019,40(04):114-118.
[17] 夏娜,赵丽凤.黑果枸杞功能性成分抗氧化活性及對线粒体的保护作用研究[J].食品工业科技,2014,35(22):162-166+175.
[18] 黄琴,沈杨霞,张成静,等.铁皮石斛多酚和黄酮含量及与抗氧化活性的相关性[J].应用与环境生物学报,2014,20(03):438-442.
[19] 范艳丽,韩丽娜,付丽霞,等.枸杞叶黄酮类化合物体外清除自由基作用研究[J].中国调味品,2017,42(12):32-37.
[20] 张国涛.超声波法提取荞麦粉中黄酮类化合物的工艺研究[J].当代化工,2017,46(08):1524-1526.
[21] 王振吉,杨申明,张光勇.首乌藤总黄酮提取工艺优化及抗氧化性研究[J].中国酿造,2019,38(03):177-180.
[22] 朱婉晴,卞杰松,周志远,等. 超声波辅助提取无患子果皮中总黄酮的研究[J]. 广州化工, 2018, 46 (01): 102-104+158.
