微小RNA-495-3p在卵巢癌组织的表达及对卵巢癌细胞凋亡和增殖的影响
2019-12-02韩听锋李春燕侯青霞岳青芬
韩听锋 李春燕 侯青霞 岳青芬
卵巢癌是女性最常见的恶性肿瘤之一,侵袭力强,复发率高,其致死率居女性恶性肿瘤的首位[1]。miRNA 是长度约为22个核苷酸大小的非编码RNA,通过抑制目的基因的翻译或降解目的基因,在转录后水平发挥调节基因表达的作用[2, 3]。多项研究发现miR-495-3p具有抑癌作用,对多种肿瘤的生长具有调控作用[4]。本研究旨在观察微小RNA-495-3p在卵巢癌组织和细胞株的表达,进一步通过基因转染技术观察miR-495-3p对卵巢癌SKOV-3细胞凋亡、增殖的影响及确切机制。
材料与方法
1.实验材料:选取笔者医院2016年3月~2016年11月经手术切除的新鲜卵巢癌组织标本10例;患者年龄31~69 岁,平均年龄46.87±14.64岁,卵巢子宫内膜样腺癌3例,卵巢浆液性癌7例;根据国际妇产科联盟(FIGO)2000年标准进行分期:Ⅰ期4例,Ⅱ期6例;标本均经组织病理学确诊,经笔者医院伦理学委员会批准及患者知情同意,取其卵巢癌原发肿瘤组织和癌旁组织(距离癌灶边缘>5cm)标本。所有患者术前均未接受放、化疗。HEK293细胞、人卵巢癌细胞株(A2780、SKOV-3、HO-8910、OC3)和正常卵巢上皮细胞IOSE80购自中国医学科学院基础医学研究所。DMEM/F12 培养基、RPMI 1640培养基和胎牛血清购自美国Gibco公司。RNA提取试剂盒和荧光实时定量试剂盒购自日本TaKaRa公司。脂质体转染试剂Lipofectamine 3000购自美国Invitrogen公司。miR-495-3p mimics和miR-NC购自广州市锐博生物科技有限公司。二喹啉甲酸(BCA)蛋白定量试剂盒购自武汉博士德公司。一抗β-Actin、NF90、p53、p21、Bcl-2、Bax和辣根过氧化物酶标记的二抗均购自美国Cell Signaling Technology公司。增强型化学发光(ECL)检测试剂盒购自北京康为世纪生物科技有限公司。pGL3荧光素酶检测系统购自美国Promega公司。
2.方法:(1)细胞培养及转染:在37°C、5%CO2、饱和湿度的培养箱中,使用含10%胎牛血清的DMEM/F12培养基常规培养A2780、SKOV-3、IOSE80和HEK293细胞,使用含10%胎牛血清的RPMI 1640培养基常规培养HO-8910和OC3细胞。选取对数生长期细胞以3×105个/孔接种于6孔板。按照试剂盒说明书,使用Lipofectamine 3000转染试剂盒进行转染。细胞分为miR-NC组(转染miR-NC)和miR-495-3p组(转染miR-495-3p)。(2)荧光实时定量聚合酶链反应(qPCR)检测miR-495-3p和靶基因mRNA表达:Trizol法提取组织或细胞总RNA,按照RNA反转录试剂盒说明书加样反转录RNA为cDNA,取反转录产物按照荧光实时定量试剂盒说明书进行qPCR。采用2-△△Ct法计算NF90相对于内参GAPDH及miR-495-3p相对于内参U6的表达量。引物序列见表1。(3)流式细胞术(FCM)检测细胞凋亡:将转染48h后的细胞消化收集,严格按照Annexin Ⅴ-FITC/PI双染试剂盒说明书操作,PBS溶液洗3次,500μl细胞结合液重悬细胞,分别加入5μl Annexin Ⅴ和5μl PI,4℃避光反应20min,流式细胞仪检测并分析各组细胞凋亡率。(4)CCK-8法检测细胞活力:将对数生长期的SKOV-3细胞重悬后以5000个/孔接种于96孔板,分别于转染后1、2、3、4、5天向96孔板加入CCK-8 10微升/孔,摇床低速震荡10s,继续培养2h后,酶标仪检测各孔在波长为450nm处的A值,以时间为横轴,A值为纵轴,绘制细胞生长曲线,评估细胞活力变化。(5)平板克隆实验:转染48h收集两组细胞,重悬计数细胞,以1000个/孔接种于新的6孔板。培养14天后用PBS溶液浸洗2次,加甲醇1ml固定15min,弃去固定液,加结晶紫染液染色10min,自来水冲洗,在倒置显微镜下计数含50个细胞以上的集落观察细胞形成的克隆数。(6)Western blot法检测目的蛋白表达:收集细胞,细胞裂解液裂解,提取总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度。取40μg蛋白经10%聚丙烯酰胺凝胶电泳 (SDS-PAGE)分离后,转至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶室温封闭2h。一抗4℃孵育过夜。Tris-HCl缓冲液(TBST)洗3次,辣根过氧化物酶标记的二抗室温孵育2h,增强型化学发光试剂(ECL)显影并进行图像分析。(7)荧光素酶活性检测:构建野生型及突变型 NF90-3′UTR的报告基因质粒,突变区域见图1,并将野生型、突变型分别与miR-495-3p和miR-NC共转染入HEK293细胞中,48h后按照双荧光素酶检测试剂盒说明书,使用酶标仪检测各组萤火虫荧光素酶和海肾荧光素酶的活性。以萤火虫荧光强度/海肾荧光强度比值反映各组的相对荧光强度。

表1 qPCR引物序列
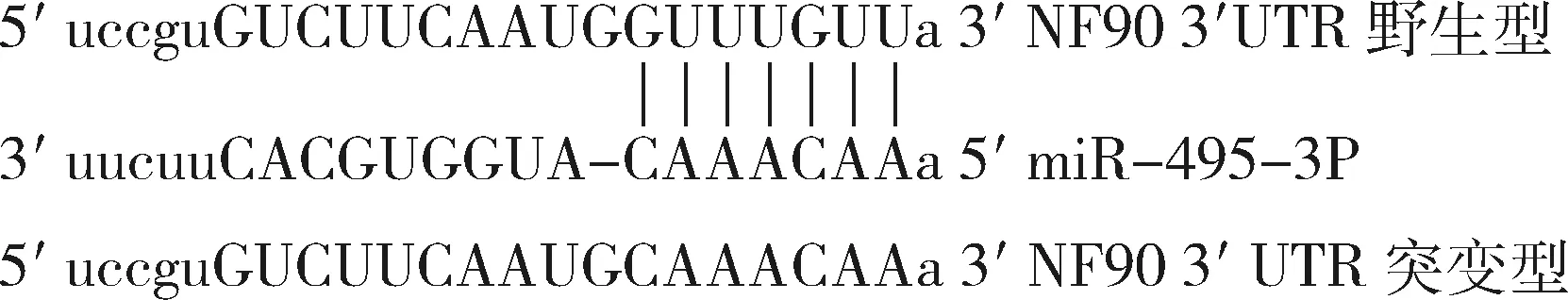
图1 野生型NF90 mRNA的3′-UTR区域含有miR-495-3p靶向结合片段

结 果
1.miR-495-3p在卵巢癌组织的表达:qPCR结果显示,miR-495-3p在卵巢癌组织和癌旁组织的表达水平分别为0.78±0.09、1.90±0.17,miR-495-3p在卵巢癌组织中表达明显低于高于癌旁组织(t=5.78,P<0.01,图2)。

图2 qPCR检测卵巢癌及癌旁组织的miR-495-3p水平与癌旁组织比较,*P<0.01
2.miR-495-3p在卵巢癌细胞株的表达:qPCR结果显示,miR-495-3p在正常卵巢上皮细胞IOSE80和卵巢癌细胞A2780、SKOV-3、HO-8910、OC3的表达量分别为1.03±0.29、0.35±0.10、0.18±0.04、0.46±0.05、0.60±0.09,miR-495-3p在卵巢癌细胞中的表达显著降低(P<0.05)。miR-495-3p在SKOV-3表达水平最低,与正常卵巢上皮细胞IOSE80及其他卵巢癌细胞株比较差异有统计学意义(P<0.05)。故选择SKOV-3细胞进行后续实验(图3)。
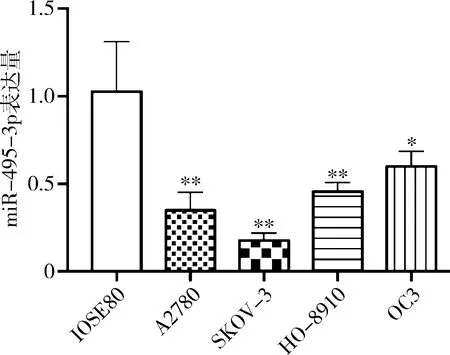
图3 qPCR检测卵巢癌细胞株及正常卵巢上皮细胞的miR-495-3p水平与IOSE80比较,*P<0.05,**P<0.01
3.转染miR-495-3p对SKOV-3细胞miR-495-3p表达的影响:qPCR结果显示,SKOV-3细胞转染miR-495-3p后miR-495-3p表达较对照组显著升高(18.46±2.59 vs 1.05±0.33,t=13.35,P<0.01)。
4.转染miR-495-3p对SKOV-3细胞凋亡的影响:流式细胞术结果显示,SKOV-3细胞转染miR-495-3p后凋亡率较对照组显著增加,差异有统计学意义(P<0.01,表2)。
5.转染miR-495-3p对SKOV-3细胞增殖能力影响:平板克隆实验显示见表2,实验组SKOV-3细胞克隆形成数显著低于对照组,差异有统计学意义(P<0.05)。

表2 miR-495-3p对卵巢癌细胞凋亡和增殖能力的影响
6.转染miR-495-3p对SKOV-3细胞活力影响:采用CCK-8 法检测不同时间点SKOV-3细胞的生长,并绘制生长曲线。细胞生长至第4天,对照组和实验组细胞A值分别为1.32±0.16和0.94±0.11,第5天对照组和实验组细胞A值分别为2.09±0.25和1.51±0.13,对照组细胞A值显著高于实验组,差异有统计学意义(P<0.01,图4)。
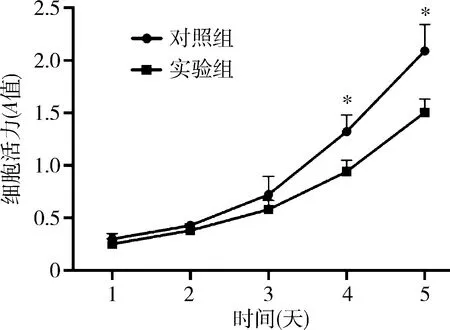
图4 CCK-8 法检测转染miR-495-3p后不同时点SKOV-3细胞活力的变化与实验组比较,*P<0.01
7.转染miR-495-3p对SKOV-3细胞NF90 mRNA表达的影响:qPCR结果显示,SKOV-3细胞转染miR-495-3p后NF90 mRNA表达较对照组显著降低(0.37±0.16 vs 1.00±0.06,t=7.54,P<0.01)。
8.转染miR-495-3p对SKOV-3细胞NF90相关蛋白表达的影响:Western blot法检测结果显示, SKOV-3细胞转染miR-495-3p后NF90、Bcl-2蛋白表达较对照组显著下调,p53、p21、Bax蛋白表达较对照组显著上调(图5)。

图5 Western blot法检测miR-495-3p转染SKOV-3细胞后目的蛋白的表达水平1.实验组;2.对照组
9.荧光素酶报告基因实验:荧光素酶活性检测结果显示,野生型质粒与miR-NC或miR-495-3p共转染SKOV-3细胞后,两组细胞荧光素酶活性分别为1.02±0.22和0.39±0.10(P<0.01),表明miR-495-3p可显著抑制野生型 NF90-3′ UTR质粒转染细胞的荧光素酶活性,而对突变型NF90-3′ UTR 质粒转染细胞的荧光素酶活性并无影响。该结果证实,NF90是miR-495-3p的直接作用靶点,miR-495-3p对NF90的表达存在负调控(图6)。

图6 荧光素酶报告基因验证SKOV-3细胞中miR-495-3p与NF90-3′ UTR的靶向结合与突变型比较,*P<0.01
讨 论
miRNA通过与靶基因的3′-非翻译区(UTR)结合,诱导mRNA降解或者抑制mRNA翻译,调节癌基因和抑癌基因的表达,参与肿瘤的起始和进展[5]。越来越多miRNA如miR-18b、miR-630、miR-29b等[6~8]被发现与卵巢癌的发生、发展密切相关。miR-495-3p在多种肿瘤中表达异常,可作为肿瘤抑制因子起作用,与肿瘤的发生、发展密切相关。非小细胞肺癌中miR-495-3p显著下调,miR-495-3p通过靶向转移相关蛋白3抑制肺癌细胞的增殖和转移[9]。miR-495-3p的表达水平在胶质瘤组织和细胞株中下调,体外研究表明miR-495-3p可通过直接抑制MYB表达,干扰胶质瘤细胞的增殖和侵袭[10]。miR-495-3p在临床食管癌组织中的表达比癌旁组织低,miR-495-3p表达水平与食管癌的淋巴结转移、侵袭和TNM分期相关。miR-495-3p通过靶向Akt1,抑制细胞周期转变和EMT信号通路,从而抑制食管癌细胞的增殖、迁移和侵袭[11]。miR-495-3p的表达在肾癌细胞系和组织中均下调,miR-495-3p的过表达可诱导G0/G1期停滞并抑制肾癌细胞的增殖和迁移,SATB1是miR-495-3p的直接靶标[12]。miR-495-3p还可通过靶向Akt和mTOR信号通路,体内体外抑制前列腺癌细胞的增殖、迁移和侵袭[13]。miR-495-3p在卵巢癌中的作用未见报道。
本研究结果显示,miR-495-3p在10例临床卵巢癌组织及卵巢癌细胞株中显著低表达,提示miR-495-3p可能参与了卵巢癌的发生和进展。笔者通过转染miR-495-3p至卵巢癌细胞SKOV-3,发现SKOV-3细胞活力和增殖能力明显降低,细胞凋亡率明显升高,提示miR-495-3p具有抑癌效应。生物信息学软件分析显示核因子蛋白90(NF90)可能是miR-495-3p的靶基因。NF90是ILF3基因的可变剪接体之一,主要包含双链RNA 结合基序、锌指结构域及入核、出核序列等,在调节真核基因转录与翻译、调控 miRNA 前体成熟等方面具有重要作用,可表现为癌基因的作用[14, 15]。本研究结果显示过表达miR-495-3p后,细胞中NF90蛋白明显下调。荧光素酶报告基因系统检测进一步表明NF90是miR-495-3p的靶基因。有文献表明NF90蛋白表达下调将诱导抑癌基因p53、p21表达水平的上升,从而对肿瘤的生长发挥抑制作用[16]。Bcl-2是抑制细胞凋亡蛋白,而Bax是促进细胞凋亡蛋白[17]。本研究结果表明,过表达miR-495-3p后,抑癌蛋白p53、p21的表达上调,促凋亡蛋白Bax表达明显升高,抑制凋亡蛋白Bcl-2表达明显下降。本研究的不足之处在于没有验证miR-495-3p在体内是否同样具有抑制卵巢癌细胞增殖的作用。笔者下一步将通过裸鼠荷瘤实验观察miR-495-3p在体内对卵巢癌细胞增殖的抑制作用。
综上所述,本实验初步研究表明miR-495-3p通过抑制NF90基因的表达,提高p53和p21蛋白的表达,促进卵巢癌细胞的凋亡,抑制细胞增殖,为miRNA未来可能应用于卵巢癌的临床治疗提供实验依据。
