靶向调控TOX3基因对乳腺癌细胞增殖及周期的影响
2019-12-02韩翠翠刘立琨王玉春马立威
韩翠翠 刘立琨 王玉春 杨 莹 马立威
研究认为乳腺癌发病机制可能与恶性表征相关基因的异常有关。TOX3为高迁移率(high mobility group,HMG)蛋白家族成员3基因,又名三核苷酸重复9基因(trinucleotide repeat-containing gene 9,TNRC9),CAG三核苷酸重复基因F9 基因(CAG trinucleotide repeat-containing gene F9,CAGF9)[1]。近年来,越来越多的研究报道,TOX3可能参与肿瘤的发展。在不同人群的全基因组关联分析(genome-wide association study,GWAS)中发现TOX3与乳腺癌易感性相关,其在乳腺癌组织中高表达,且与临床TNM分期分级以及淋巴结转移具有相关性,但其在乳腺癌发生、发展进程中的生物学功能以及调控机制尚不清楚[2~7]。因此,本研究在前期构建稳定沉默和过表达TOX3基因细胞模型的基础上,初步探讨靶向调控TOX3基因的表达对乳腺癌细胞增殖活性以及周期的影响,为进一步探讨TOX3基因在乳腺癌恶性病变过程中的生物学功能奠定研究基础。
材料与方法
1.材料:人乳腺癌ZR-75-1细胞、MDA-MB-231细胞购自中国科学院上海细胞库,稳定沉默TOX3基因的的乳腺癌细胞(TOX3-shRNA细胞)、阴性对照细胞(LV3-NC细胞)、稳定过表达TOX3基因乳腺癌细胞(MDA-MB-231-TOX3细胞)和阴性对照细胞(MDA-MB-231-NC细胞)模型均由本实验室构建;L-15培养基和1640培养基、胰蛋白酶、胎牛血清均购自美国Gibco Technology 公司;BCA 蛋白定量试剂盒和ECL高灵敏度化学发光试剂盒均购自北京康为世纪生物科技有限公司;TOX3兔抗人单克隆抗体购自英国Abcam公司;GAPDH鼠抗人多克隆抗体购自北京康为世纪生物科技有限公司;抗兔二抗和抗鼠二抗均购自美国Cell Signaling Technology公司;细胞周期与细胞凋亡检测试剂盒购自碧云天生物技术有限公司。
2. 方法:将已构建的稳定沉默TOX3的乳腺癌ZR-75-1细胞系分为空白对照组(ZR-75-1细胞)、阴性对照组(LV3-NC细胞)和TOX3干扰组(TOX3-shRNA细胞);稳定过表达的MDA-MB-231细胞分为空白对照组(MDA-MB-231细胞)、阴性对照组(MDA-MB-231-NC细胞)和TOX3过表达组(MDA-MB-231-TOX3细胞)。(1)Western blot法检测稳定转染后乳腺癌细胞TOX3蛋白的表达:将各组细胞接种于60mm培养皿中,待细胞融合度达到80%左右,收集各组细胞,各组细胞按照一定比例加入含有PMSF蛋白酶抑制剂的RIPA强效裂解液,冰上提取总蛋白,离心,收集蛋白液。BCA法检测提取蛋白液浓度并进行定量,经变性后,取20μg蛋白进行聚丙烯酰胺凝胶电泳,转膜,BSA封闭液4℃封闭,过夜。按照1∶2000比例加入TOX3单克隆抗体,1∶3000比例加入GAPDH抗体,室温孵育3h后,洗膜3次。1∶3000比例加入抗兔二抗和抗鼠二抗,室温孵育2h,洗膜,ECL化学发光试剂显影,曝光。(2)MTT法检测过表达和干扰TOX3对MDA-MB-231和ZR-75-1细胞增殖活性的影响:将各组细胞常规消化,计数,使细胞密度为3000个/孔,接种于96孔板内,每组平行设5个复孔,过夜。次日弃掉旧培养基,每孔加入200μl新鲜L-15或1640培养基,继续培养。于检测当日加入20μl 5mg/ml的MTT溶液(注意避光),37℃孵育4h,终止培养,吸出上清液,每孔加入150μl DMSO溶液,室温充分震荡使结晶溶解。应用酶标仪检测570nm波长处各孔吸光度值,观察第0~7天的细胞增殖活性的变化。(3)平板单克隆实验检测过表达TOX3对MDA-MB-231细胞单克隆形成能力的影响:将过表达TOX3的MDA-MB-231各组细胞常规消化,计数,以3000个/孔细胞密度接种于6孔板内,于培养箱内常规培养,视生长状况换液,连续培养14天后,吸去旧培养基,PBS清洗两次。采用冰甲醇固定10min,PBS清洗,结晶紫溶液染色10min,洗去结晶紫。计细胞数>50个的集落数,计算集落形成率。集落形成率(%)=计数细胞集落数/细胞总数×100%。(4)流式细胞术检测稳定沉默和过表达TOX3基因后乳腺癌细胞周期变化:将各组细胞常规消化,以1×106个/孔的细胞密度接种于6孔板中,37℃培养过夜。常规消化细胞,收集细胞悬液到离心管中,2000r/min离心5min,弃掉上清。加入预冷的PBS悬浮细胞,2000r/min离心5min。弃掉上清液,再次加入预冷的PBS重悬细胞,离心。弃上清,加入预冷的70%乙醇,轻轻吹散细胞,4℃固定,过夜。离心,弃掉乙醇,加入预冷的PBS重悬细胞。离心,弃掉PBS,每个样品加入0.5ml配制好的碘化丙啶染色液,重悬细胞,37℃避光反应30min,用流式细胞仪检测各组细胞周期的变化。
结 果
1.稳定转染后乳腺癌细胞TOX3蛋白的表达:Western blot法检测已构建的稳定沉默TOX3的乳腺癌ZR-75-1细胞系和稳定过表达TOX3的乳腺癌MDA-MB-231细胞系内TOX3蛋白的表达。实验结果显示,转染ZR-75-1细胞后,与阴性对照组比较,TOX3干扰组(TOX3-shRNA细胞)TOX3蛋白表达水平明显降低(P<0.05,图1)。转染MDA-MB-231细胞后,与阴性对照组比较,TOX3过表达组(MDA-MB-231-TOX3细胞)TOX3蛋白表达水平明显升高(P<0.05,图2)。
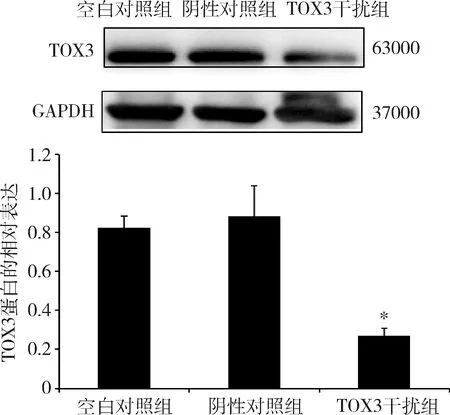
图1 稳定沉默TOX3的ZR-75-1细胞TOX3蛋白的表达与阴性对照组比较,*P<0.05
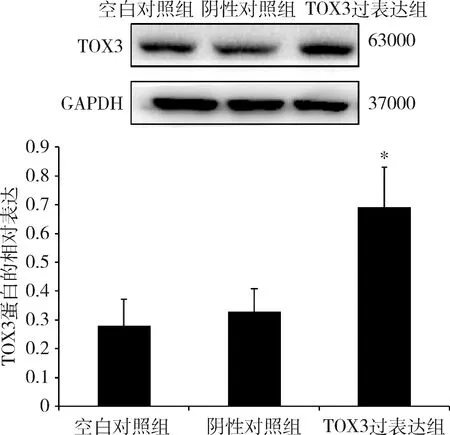
图2 稳定过表达TOX3的MDA-MB-231细胞TOX3蛋白的表达与阴性对照组比较,*P<0.05
2.过表达和干扰TOX3基因对MDA-MB-231和ZR-75-1细胞增殖的影响:采用MTT实验观察过表达TOX3基因对MDA-MB-231细胞增殖活性的影响。实验结果显示,0~7天内空白对照组与阴性对照组细胞的增殖活性比较差异无统计学意义,TOX3过表达组随着时间的推移细胞的增殖活性增强(图3)。干扰TOX3后,ZR-75-1细胞增殖活性降低(图4)。

图3 过表达TOX3基因对MDA-MB-231细胞增殖的影响与阴性对照组比较,*P<0.05

图4 干扰TOX3基因对ZR-75-1细胞增殖的影响与阴性对照组比较,*P<0.05
3.过表达TOX3对MDA-MB-231细胞单克隆形成能力的影响:采用平板克隆实验检测过表达TOX3对细胞单克隆形成能力的影响。与空白对照组比较,阴性对照组细胞集落形成率无明显变化;与阴性对照组比较,TOX3过表达组细胞的集落形成率明显增大,单克隆形成能力增强(P<0.05,图5)。
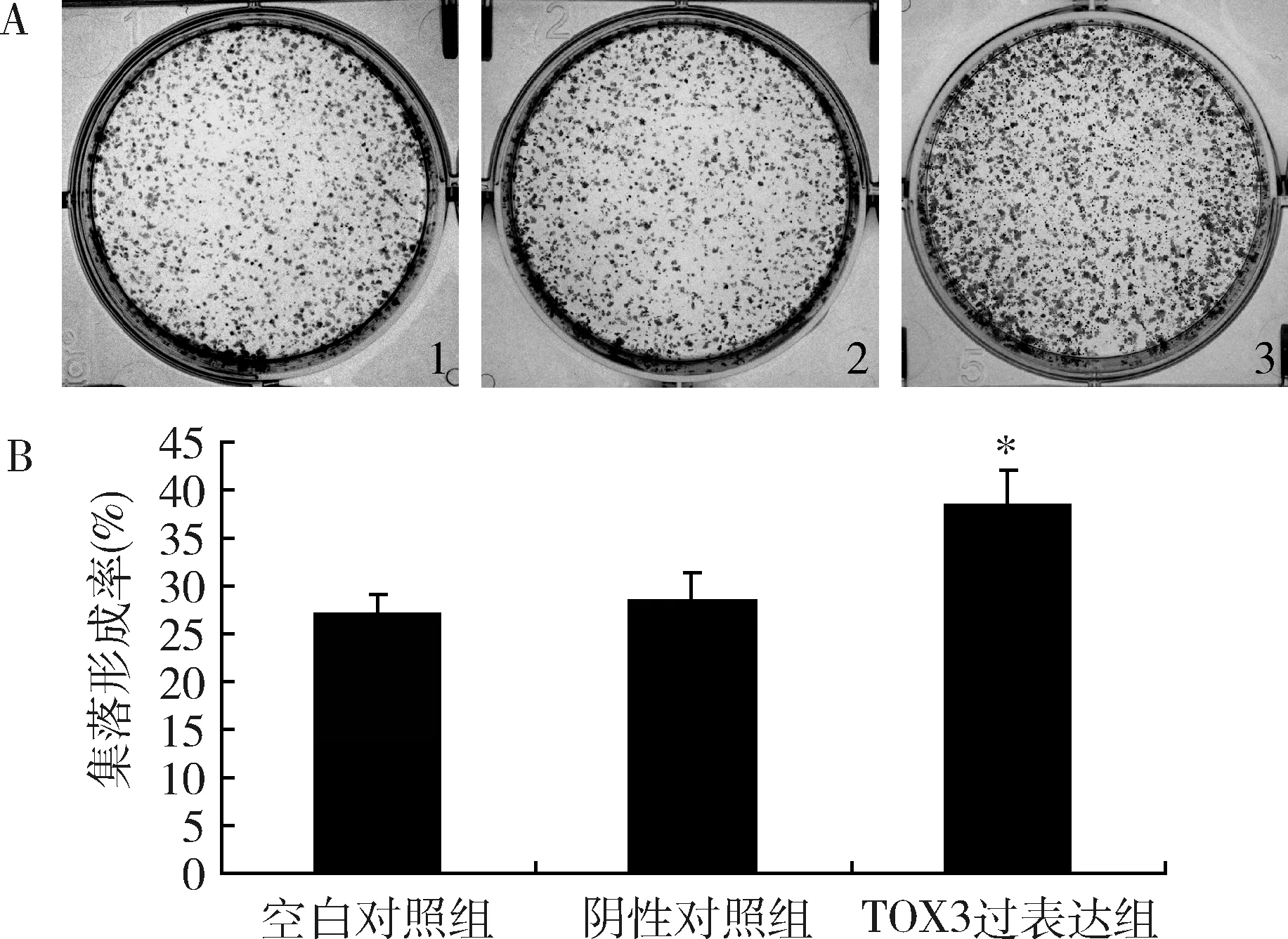
图5 过表达TOX3基因对MDA-MB-231细胞单克隆形成的影响A.各组细胞平板克隆形成图;B.各组细胞平板克隆分析图;1.空白对照组;2.阴性对照组;3.TOX3过表达组;与阴性对照组比较,*P<0.05
4.干扰TOX3基因对ZR-75-1细胞周期的影响:流式细胞术检测干扰TOX3基因对ZR-75-1细胞周期的影响。与空白对照组比较,阴性对照组各周期细胞比例无明显变化。与阴性对照组比较,TOX3干扰组细胞G0/G1期细胞比例明显增加(P<0.05),G2/M期细胞比例减少(P<0.05),而S期有减少的趋势但差异无统计学意义(P>0.05,表1,图6)。

表1 干扰TOX3基因对乳腺癌细胞周期的影响
与阴性对照组比较,*P<0.05
5.过表达TOX3基因对MDA-MB-231细胞周期的影响:流式细胞仪检测过表达TOX3对MDA-MB-231细胞周期的影响。空白对照组与阴性对照组各周期细胞比例比较差异无统计学意义。与阴性对照组比较,过表达TOX3组G0/G1期细胞所占比例减少,G2/M期细胞比例明显增多(P<0.05),而S期差异无统计学意义(P>0.05,表2,图7)。

图6 干扰TOX3基因对乳腺癌细胞周期的影响A.空白对照组;B.阴性对照组;C.TOX3干扰组

表2 过表达TOX3基因对MDA-MB-231细胞周期的影响
与阴性对照组比较,*P<0.05
讨 论
近年来,研究发现TOX3与肿瘤的发展相关。组织学分层分析表明TOX3多态性位点rs3803662的基因分型CT/TT与弥漫型胃癌较好的生存期相关[8]。TOX3基因的变异体可能在慢性粒细胞白血病早期诊断和治疗中起重要作用[9]。另有研究发现,在HIV感染的肺癌组织中,TOX3 mRNA的表达高于相应的癌旁组织,表明TOX3可能与HIV感染的肺癌相关[10]。然而越来越多的研究表明TOX3基因与乳腺癌密切相关。
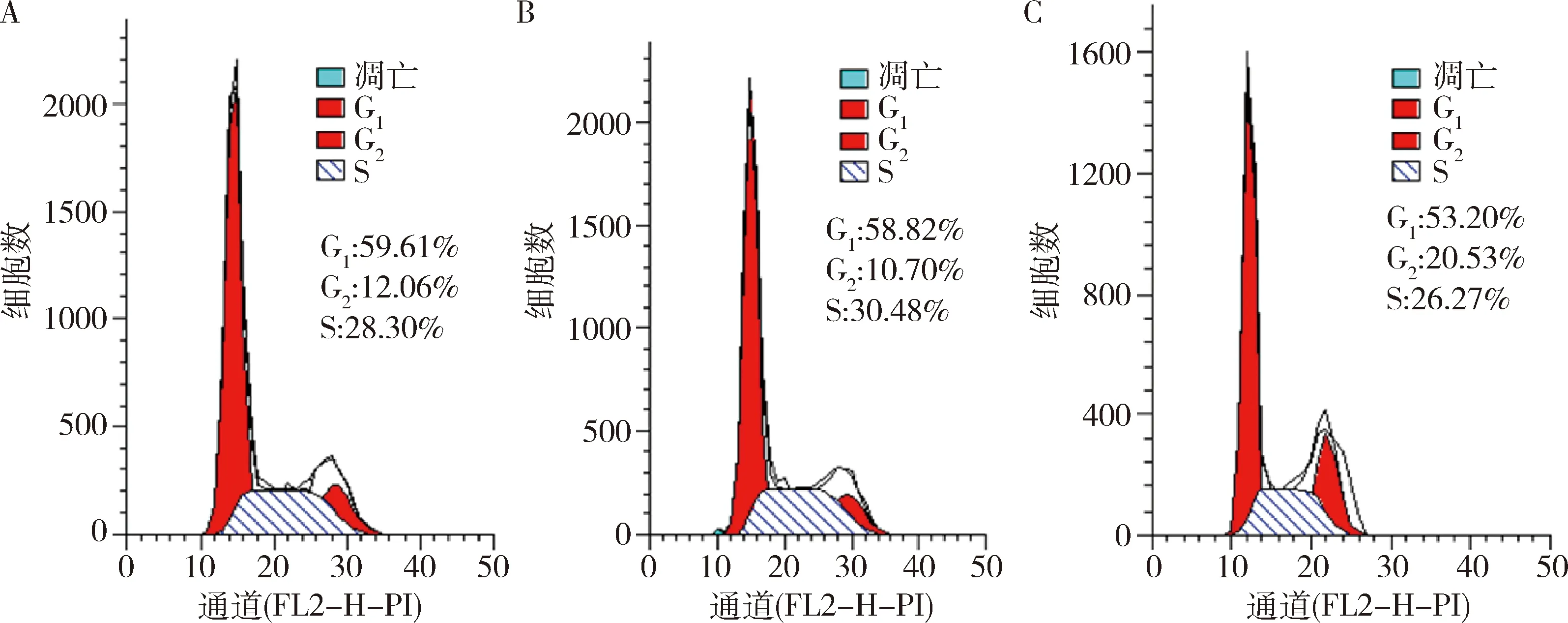
图7 过表达TOX3基因对MDA-MB-231细胞周期的影响A.空白对照组;B.阴性对照组;C.TOX3过表达组
近年来,在不同人群中的GWAS研究发现,TOX3与乳腺癌的发展密切相关[2~6]。研究显示,含有多个TOX3危险等位基因的患者大大增加了患乳腺癌的风险,且TOX3基因多态性明显增加了家族乳腺癌的风险[11,12]。GWAS研究发现,TOX3基因上的多态性位点与雌激素受体阳性乳腺癌具有较强的相关性,可作为绝经前和绝经后女性乳腺癌患病风险的预测因子之一[13]。此外,研究发现TOX3在雌激素受体阳性的乳腺细胞中表达,且在乳腺癌肿瘤中高表达,TOX3的高表达与Luminal B型乳腺癌不良预后相关。降低TOX3的表达,Luminal B型乳腺癌细胞增殖的能力下降,但TOX3在乳腺癌发生、发展中的生物学功能尚不清楚[14]。
研究发现,与正常乳腺组织比较,TOX3蛋白在乳腺癌组织中呈高表达,且其表达水平与临床TNM分期和分级呈显著相关[7]。Shan等[15]研究也发现,与正常乳腺组织比较,TOX3在乳腺癌尤其是晚期乳腺癌组织内高表达,且发现其可下调BRCA1的表达,使乳腺癌细胞侵袭和转移能力增强。沉默TOX3的表达,可抑制人乳腺癌细胞MCF-7和ZR-75-1细胞增殖,其体内研究进一步证实干扰TOX3基因后,成瘤率明显降低,且形成的肿瘤也明显减小。以上研究证实,TOX3基因参与了乳腺癌发展进程,并发挥重要作用。
笔者前期研究应用慢病毒表达载体成功构建了稳定过表达TOX3的乳腺癌MDA-MB-231细胞模型和稳定沉默TOX3的乳腺癌ZR-75-1细胞模型[16]。本研究在此基础上检测已构建的稳定沉默TOX3的乳腺癌ZR-75-1细胞系和稳定过表达TOX3的乳腺癌MDA-MB-231细胞系内TOX3蛋白的表达。结果显示转染ZR-75-1细胞后,TOX3干扰组TOX3蛋白表达水平明显降低。转染MDA-MB-231细胞后,TOX3过表达组TOX3蛋白表达水平明显升高。在此基础上采用MTT法及平板单克隆实验检测TOX3对MDA-MB-231细胞增殖能力的影响,结果发现过表达TOX3基因可使MDA-MB-231细胞增殖和单克隆形成能力增强,干扰TOX3基因可使ZR-75-1细胞的增殖能力下降,这与Shan等[15]研究发现的干扰TOX3基因乳腺癌细胞的增殖能力下降结果相符。
肿瘤是一种由多原因导致细胞周期紊乱性疾病。研究认为细胞周期中 G2/M期和S期所占的百分比可反映细胞的增殖活性[17]。本研究应用稳定沉默和过表达TOX3基因的乳腺癌细胞模型,采用流式细胞术分别检测干扰和过表达TOX3对乳腺癌细胞周期的影响,结果发现干扰ZR-75-1细胞TOX3基因的表达后,G0/G1期细胞的比例显著上升,G2/M期细胞明显减少,S期细胞比例有减少趋势,但差异无统计学意义。以上结果表明TOX3基因沉默后,生长停滞在G0/G1期不能进入DNA合成期的细胞比例增多,细胞的增殖活性减弱。过表达TOX3基因后,MDA-MB-231细胞G0/G1期细胞百分比减小,G2/M期细胞所占百分比增大,而S期细胞比例没有明显变化,细胞增殖活性增强。以上结果提示TOX3基因可通过调控乳腺癌的细胞周期而影响细胞增殖。
综上所述,本研究发现靶向调控TOX3基因的表达可改变乳腺癌细胞增殖和单克隆形成能力,影响乳腺癌细胞周期。
