丙型肝炎病毒生活周期中脂蛋白代谢的研究进展
2019-11-30杨银荣王谦
杨银荣 王谦 ,2★
丙型肝炎病毒(hepatitis C virus,HCV)是单股正链RNA病毒,属于黄病毒科丙肝病毒属,是丙型肝炎的致病因子。流行病学调查,全球约2%~3%的人感染HCV,80%以上的感染者不能自发清除HCV,进而引起持续性感染,持续性感染者可演变成慢性肝炎、肝硬化和原发性肝细胞癌[1]。尽管目前已研制出了针对HCV有效的抗病毒药物,这类药物多是以病毒蛋白酶为靶点,疗效强但长期用药后容易产生耐药性。因此,开发HCV疫苗以及其他新型HCV抗病毒药物仍然具有重要前景。
近年来与HCV生活周期各环节有关的宿主细胞因子得到广泛研究,越来越多的研究证明,HCV的生活周期与宿主脂质代谢密切相关[2]。HCV的组装和分泌途径与脂蛋白的产生和分泌密不可分,其颗粒的感染性在很大程度上取决于脂蛋白的相互作用。此外,HCV进入肝细胞后受脂蛋白的强烈影响,介导这些相互作用的关键脂蛋白分子是载脂蛋白。了解HCV的生命周期与脂蛋白代谢之间的关系可为抗病毒药物的研发提供新的研究靶点。并且这类药物的作用机制不直接作用于病毒本身,因此就有可能降低耐药的几率,还可能具有更加广谱的抗病毒优势。
1 脂蛋白代谢
脂蛋白是一类球状微粒,由富含固醇脂、甘油三酯的疏水性内核和蛋白质、磷脂、胆固醇等组成的外壳构成。脂蛋白是血液中不溶性脂类的载体,根据其密度大小分为:乳糜微粒(chylomicrons,CM)、极低密度脂蛋白(very lowdensity lipoproteins,VLDL)、中间密度脂蛋白(intermediate density lipoproteins,IDL)、低密度脂蛋白(low density lipoproteins,LDL)和高密度脂蛋白(high density lipoproteins,HDL)。CM和VLDL是富含甘油三酯的脂蛋白,而LDL和HDL含有丰富的胆固醇。CM颗粒最大,密度最低,而HDL颗粒最小,密度最高。
载脂蛋白(Apo)是脂蛋白颗粒表面的两亲性蛋白质,在肝脏(部分在小肠)合成,是极其活跃的一组血浆蛋白质,在血浆脂蛋白代谢中具有促进脂类运输,调节酶活性,引导血浆脂蛋白同细胞表面受体结合等功能。载脂蛋白主要分为Apo A、Apo B、Apo C、Apo D、Apo E五类。根据生物学和结构特征,载脂蛋白也可分为可交换和不可交换的载脂蛋白。Apo B100是一种与LDL和VLDL颗粒结合的不可交换性蛋白质,而其他载脂蛋白则是可交换蛋白。Apo AⅠ和Apo AⅡ是HDL的主要载脂蛋白,Apo CⅡ是介导CM和VLDL颗粒水解不可缺少的脂蛋白脂酶(Lipoprotein lipase,LPL)的激活剂,而Apo CⅢ则具有抑制LPL的功能。这些可交换载脂蛋白主要存在于CM、VLDL和HDL颗粒的表面。脂蛋白代谢途径包括外源性途径和内源性途径。脂蛋白代谢的主要途径见图1[3]。
2 脂蛋白代谢对HCV生命周期的影响
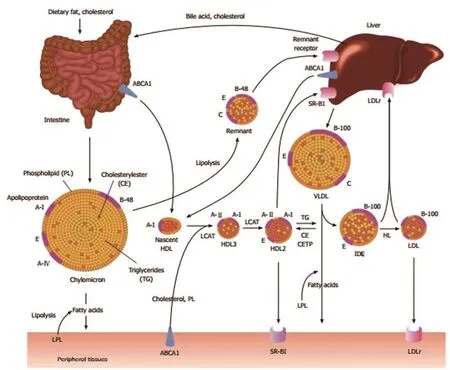
图1 脂蛋白代谢的主要途径Figure 1 The main pathway of lipoprotein metabolism
HCV建立了一个复杂的与宿主细胞相互作用的网络,以维持其复制循环的所有步骤。与其他单股正链RNA病毒类似,HCV首先吸附于细胞膜表面的病毒受体或辅助受体,然后由HCV包膜蛋白E1和E2介导病毒进入细胞。HCV使用的是一种包括脂质和脂蛋白受体在内的入胞因子组合,已知与HCV吸附及入胞有关的细胞表面蛋白包括:claudin-1、B类清道夫受体I型(scavenger receptor class B type 1,SRB1)、低密度脂蛋白受体(low density lipoprotein receptor,VLDLR)、CD81 和闭塞素等[4],因此,干扰这某些入胞蛋白能否发现临床抗病毒药物的潜在靶点值得探究。
HCV基因组编码十种蛋白质,包括核心蛋白C、包膜糖蛋白E1和E2,以及p7病毒肽4种结构蛋白和 NS2、NS3、NS4A、NS4B、NS5A、NS5B 6种非结构蛋白。所有的病毒蛋白在HCV感染中都有特定的功能,以协助完成HCV的复制过程,是病毒形态发生的必要条件[5],HCV的复制始于修饰的内质网膜即由NS4B与NS5A诱导形成的囊泡结构上[6]。HCV RNA和非结构蛋白NS3、NS4A、NS4B、NS5A和NS5B以及某些细胞蛋白共同在内质网膜上组装成HCV复制复合体,复制复合体形成是HCV复制的标志。其中非结构蛋白参与内质网膜的形成和修饰,而体内的一些宿主蛋白则被募集到网状复合物中,参与调控膜复合物的脂质组成,为病毒复制提供稳定场所[6]。
肝细胞内富含鞘磷脂和胆固醇的动态细胞器脂滴(Lipid droplet,LDs)在HCV复制和病毒颗粒的装配中发挥了重要作用[7]。装配的开始阶段发生在与LDs相互作用的内质网的胞质侧,HCV核心蛋白转运与LDs密切相关[8],核心蛋白通过与NS2和NS3-4A的相互作用被招募到HCV装配位点[9]。在后期的组装步骤中,包膜糖蛋白E1和E2结合到病毒颗粒上[10],跨膜蛋白NS2通过介导未成熟病毒颗粒与膜糖蛋白E1/E2的相互作用在病毒的组装中发挥了非常关键的作用[11]。新生病毒颗粒在成熟过程中与前VLDLs结合[12]。通过这种方式,LDs管腔中的Apo B100、Apo E和APO CⅠ参与生成脂类病毒颗粒(Lipid Virus Particles,LVPs),形成真正的HCV和VLDL杂合颗粒。Apo B100不是HCVLVPs形态发生的必要条件,相反,Apo CⅠ和Apo E是HCV-LVPs细胞内形态产生不可或缺的因素[13]。以这样的方式,HCV病毒颗粒的成熟和分泌过程与VLDL的组装和分泌链接在了一起。微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTP)是产生VLDL的关键分子,通过下调MTP抑制了丙型肝炎病毒的复制[14]。在感染细胞中,四胱氨酸标记的核心蛋白与GFP标记的Apo E一起运输也证明了这一观点[15]。新合成的HCV-LVPs最终以VLDL依赖的方式从感染的细胞中释放。多项研究证明了Apo E和VLDL通路在病毒释放中的重要作用[16]。
3 HCV颗粒的特征、感染与脂蛋白代谢的关系
HCV病毒颗粒的一个显著特性是其低密度,并且密度范围大,颗粒的大小和形状呈现较大的不均一性 ,感染性HCV颗粒的密度为(1.03~1.10)g/mL。这一密度与血清脂蛋白类似[17]。各类脂蛋白VLDL、LDL、IDL和HDL之间是交换脂质和载脂蛋白的动态群体,除了Apo B外,其他载脂蛋白可逆地结合在脂蛋白表面,脂蛋白类别在血液循环中可以相互切换。同样地,与其他黄病毒科病毒不同的是HCV的密度范围不仅很宽,而且是动态的,受体内饮食中甘油三酯和宿主细胞的影响[18],这表明脂蛋白和LVPs之间的脂质在血循环中可以相互转移的[18],宿主细胞脂蛋白代谢状态与颗粒特性关系密切。通常,培养细胞的HCV可感染黑猩猩和人肝嵌合体小鼠等动物,但从这些动物分离出的HCV比培养细胞中HCV显示出更低的颗粒密度和更高的传染性[19]。同样地,HCV感染患者血清中分离出的HCV也显示了更低的密度和更高的特异感染性,如果将分离出的病毒颗粒在细胞系中培养,这种特性就会消失[20],提示低密度HCV颗粒可能含有与感染性相关的蛋白成分。高传染性HCV颗粒的密度小于1.07 g/mL,与LDL或VLDL的密度相对应,其平均粒径为73 nm,与VLDL的粒径相对应[17]。因此,感染性HCV颗粒的物理性质与VLDL颗粒非常相似。感染性HCV颗粒具有Apo E和ApoCⅠ-Apo C-Ⅲ在表面上,正如VLDL颗粒[21]。随着电镜技术的发展,使用针对HCV糖蛋白天然表位或工程标记的有效抗体或针对载脂蛋白的有效抗体[22],证实了:丙肝病毒病毒颗粒大小不一,在40~140 nm的范围内;丙肝病毒不具有明显的对称性,无论是其包膜还是其衣壳。
在病毒形态发生过程中结合宿主细胞蛋白是一种比较常见的现象[23]。HCV除了3种结构蛋白外,还有一系列载脂蛋白被结合在病毒包膜内,并实际参与病毒颗粒进入细胞和保护病毒免受抗体介导的中和作用[24]。通过免疫纯化的病毒质谱检测也证实了载脂蛋白是HCV颗粒一部分的结论[25]。在HCV颗粒中结合的多种载脂蛋白已被证实的有Apo B、Apo AⅠ、Apo CⅠ、Apo CⅡ、Apo CⅢ和Apo E[24]。近年来,基因敲除技术的发展使得载脂蛋白在HCV产生中的作用有了新的认识:Apo E是HCV形态发生的关键脂蛋白因素,实际上所有与Apo E相关的可交换载脂蛋白以及Apo B都能够修复HCV的产生[26]。这表明真正影响HCV生活周期的不是特定的氨基酸序列,而是蛋白的结构即Apo E的双亲螺旋结构,这个结构也存Apo B中,而Apo B是HCV装配的关键决定因素[26]。许多研究已经解决了Apo E在HCV生成过程中所起的作用,在肝癌细胞系中证实Apo E表达受抑制或被阻断[27],病毒在没有Apo E的情况下进行包膜复制,在细胞内和细胞外均不产生传染性病毒,这表明Apo E对于病毒组装的包膜后步骤是必不可少的[28]。虽然在293t细胞株Apo E补足时,核心定位没有明显差异[28],然而,已有研究证实核心蛋白积聚在Apo B/Apo E双基因敲除的huh-7细胞的LDs表面[26]。总之,Apo E参与了HCV的成熟,并赋予其感染性。
4 HCV与宿主脂蛋白代谢和载脂蛋白的相互作用
随着HCV体外培养系统的建立以及研究的不断深入,人们发现一方面脂质通过提供细胞内膜表面、脂质、能量和蛋白质等重要组分来参与HCV生活周期,在病毒复制过程中发挥重要作用。另一方面HCV也能够调节细胞内脂质代谢,营造富含脂质的内环境以利于病毒复制,并对宿主细胞的脂质代谢产生影响。
HCV复制对脂蛋白代谢的影响主要表现为慢性HCV感染者血清脂蛋白水平降低,以及肝实质细胞中脂类堆积造成肝脂肪变性等。低LDL水平是慢性HCV感染的显著特点[29-30]。脂质代谢改变的程度取决于宿主干扰素λ3(Interferonλ3,IFNλ3)基因多态性和HCV基因型:rs12979860多态性CC型(IFNλ3主要的基因型)合并HCV基因型1(G1)患者表现为较高的LDL水平,但HCV基因型3(G3)、基因型4(G4)或未感染对照组的LDL水平则无相关性[31]。日本的一项研究显示HCV本身直接导致了低血脂的发生,HCV根除后,紊乱的脂质得到纠正[32]。
慢性HCV感染所伴随的炎症和脂肪变性可能受脂蛋白代谢紊乱的影响。HCV核心蛋白转基因小鼠肝脏细胞发生脂肪变性的研究表明了HCV感染与脂肪变性的发生密切相关[33]。此外,HCV感染的肝细胞经过长期的培养后,由于持续的脂质代谢紊乱,HCV核心蛋白具备了致癌潜力[34]。与慢性乙型肝炎(Chronic hepatitis B,CHB)相比,脂肪变性与慢性丙型肝炎(Chronic hepatitis C,CHC)炎症的关系更为密切[35]。CHC的脂肪变性可能导致后续的炎症和肝纤维化的进展。
Apo AⅠ已被证实参与HCV RNA复制和病毒颗粒的产生[36],而Apo AⅡ直接与HCV核心蛋白的C-末端结构域结合[37]。研究证明Apo AⅡ与HCV患者HOMA-IR(抗胰岛素性稳态模式评估法)和瘦素显著相关[38],因此,Apo AⅡ可能参与HCV感染细胞肝脂肪变性的进展。然而,也有研究支持在HCVG1b患者中,Apo AⅡ水平似乎升高,而体重指数并没有随之增加[39]。因此血清Apo AⅡ在慢性HCV感染中的意义有待进一步研究。血清中Apo B 100被证实与HCV感染的持续性和干扰素疗效有关[40]。与其他脂蛋白相比,Apo CⅢ水平与慢性病毒感染清除的相关性最强,随着肝纤维化程度的加重而下降[41],提示Apo CⅢ可能是与HCV相关的肝纤维化进展相关的潜在生物标记。
Apo E是HCV组装和进入肝细胞的关键分子之一。Apo E有3个等位基因(E2、E3和E4),其中E3是最常见的。E2与细胞表面受体结合不良,使得HCV慢性感染风险降低3~5倍[42]。E4可能对HCV引起的严重肝损伤有保护作用[43]。此外,在Apo E3/E3纯合子中,转氨酶持续正常的慢性丙型肝炎患者的纤维化进程可能加快[44]。因此Apo E亚型可能是慢性HCV感染发病率差异的原因之一。
展望
HCV是一种独特的病毒,它巧妙地利用宿主脂蛋白代谢途径建立起了适宜自身增殖的环境。HCV和脂蛋白代谢在HCV生命周期的多个阶段密切相关。HCV感染可能对脂蛋白代谢产生影响,而脂蛋白也可以调节HCV的复制。脂蛋白代谢紊乱与炎症活动、肝纤维化进展和肝癌发展密切相关。最近发现脂蛋白无关蛋白可以替代载脂蛋白在丙肝病毒的组装、释放和进入中的作用[16],这无疑为肝外丙型肝炎病毒库的建立和疫苗的研制开辟了新的研究途径。
未来的研究还有待于进一步阐明不同脂类、脂肪酸及脂蛋白在HCV感染周期中的具体功能及其分子机制,以及临床上CHC的发生发展及抗病毒治疗效果与患者血清中的脂类和脂蛋白水平的紧密联系。我们相信深入研究HCV与其宿主脂蛋白代谢之间的这种独特相互作用,可进一步揭示宿主对HCV感染易感性的新的遗传决定因素和激发新的疫苗概念平台,以及针对HCV-LVPs颗粒特性衍生抗HCV治疗的潜在靶点,以更加有效的应对HCV的耐药问题。
