锁核酸修饰探针熔解曲线分析在Kras基因突变检测中的应用
2019-11-29倪润芳黄秋英钱思雨李腾文苏国强李庆阁
倪润芳,黄秋英,钱思雨,李腾文,苏国强*,李庆阁*
(1.厦门大学生命科学学院,分子诊断教育部工程研究中心,福建 厦门 361102;2.厦门大学附属第一医院胃肠外三科,福建 厦门 361005)
近年来,对化疗无效的结直肠癌患者治疗研究中,在表皮生长因子受体(EGFR)靶向药物治疗方面取得重大进展,显著改善了转移性结直肠癌患者的存活率[1].结直肠癌患者中Kras基因突变率为35%~40%[2],其中90%的突变发生在外显子2的密码子12和13上[3](密码子12上发生频率为70%,密码子13上的发生频率为30%),而极少发生在密码子61和63上.美国综合癌症网络(NCCN)将Kras突变检测列入结直肠癌患者常规检测项目,并明确指出必须进行密码子12和13上突变的检测,其中常见的7种热点突变及其发生频率见表1.结直肠癌患者发生任何一种上述类型的Kras突变均表现为对EGFR靶向药物的耐受[4].因此,准确检测Kras突变有十分重要的临床意义.
肿瘤基因突变是发生在实体瘤中的体细胞突变,表现为混杂有大量野生型基因组的低含量突变,故称为稀有突变.近年来,利用外周血循环肿瘤DNA(ctDNA)[5-7]进行肿瘤稀有突变无创检测成为热点,而ctDNA中突变率更低,一般低于0.5%[8].因此,必须提高稀有突变检测方法的灵敏度.目前,有多种针对Kras突变的检测方法,主要包括等位基因特异性PCR(AS-PCR)、扩增阻碍突变系统(ARMS)、高分辨率熔解分析(HRM)、低温变性共扩增PCR(COLD-PCR)、下一代测序(NGS)以及基于小珠、乳浊液、扩增、磁性的数字PCR-流式技术(BEAMing)和数字PCR(dPCR)等.然而这些方法的分析灵敏度大多有限(1%~5%),难以检测低丰度的Kras突变[9].虽然BEAMing[10]和dPCR[11]方法的分析灵敏度较高,可达0.1%左右,但是因为操作繁琐且检测成本较高,在临床上的应用有限.基于以上研究现状,临床上迫切需要更加简便、价廉、灵敏度高的检测方法用于检测低丰度的Kras突变.

表1 Kras的7种常见突变类型及其发生频率
注:c表示cDNA参考序列;p表示蛋白参考序列;34,35,38表示碱基在Kras基因序列中的位置.*来自于Cosmic数据库.
探针熔解曲线分析(MCA)是PCR后的产物分析技术[12],利用探针与不同靶序列杂交后形成的双链DNA熔点差异来区分不同靶序列,方法简捷,且闭管操作可防止样本交叉污染,但其灵敏度一般在5%~10%.近年来,有多种DNA和RNA的类似物用于科学研究,其中锁核酸(LNA)的应用引起了广泛关注.LNA是一种核苷酸衍生物[13],和普通核苷酸分子的区别在于其碳环的2′-O和4′-C位置引入了亚甲基桥而形成锁状结构.LNA与DNA/RNA结合时遵循Watson-Crick碱基互补配对原则,且LNA的杂交亲和性远高于相应的DNA-DNA或RNA-RNA[14].据Wahlestedt等[15]报道,因为LNA和DNA的结合导致构象发生一定程度的改变,所以含有LNA碱基的寡核苷酸更能耐受核酸酶的作用,不易被降解.LNA不仅与DNA的亲和度高,而且对碱基错配的敏感性高,因此可显著增大完全匹配双链与碱基错配双链间的热稳定性差异,适合用于点突变检测.
本研究使用LNA修饰探针和MCA技术进行Kras突变富集检测,旨在建立一种简捷、高灵敏度的突变检测方法,用于指导肿瘤患者个体化用药,推进分子诊断技术在精准医疗等方面的临床应用.
1 材料与方法
1.1 材 料
293T细胞系不含Kras突变,作为野生型基因组标准品.采用DNeasy Blood & Tissue Kit(Qiagen,德国)进行基因组DNA提取.
结直肠癌标本为冰冻组织标本,由厦门大学附属中山医院提供.冰冻组织标本经手术切除后立即被分装成小块保存于液氮或-80 ℃冰箱中,提取前切取米粒大小的组织,使用TIANamp组织/细胞/血液全基因组DNA提取试剂盒(天根生物有限公司,北京)进行提取.
以上提取获得的DNA样本用Spectrophotometer ND-1000(Nanodrop,美国)测定吸光度,检测提取质量和浓度,剩余样本置于-20 ℃冰箱保存备用.
1.1.2 突变型质粒
使用重叠延伸法构建突变型质粒,包括表1中的7种热点突变.使用小量质粒提取试剂盒(Omega,美国)提取质粒,使用BamH Ⅰ酶(TaKaRa,大连)酶切,经琼脂糖凝胶电泳切胶获得对应长度的目的片段,用胶回收试剂盒(Omega,美国)纯化得到线性质粒,用Spectrophotometer ND-1000测定质粒DNA的浓度,根据浓度及质粒片段大小计算出对应拷贝数,梯度稀释后置于-20 ℃冰箱保存备用.
1.1.3 引物和探针
通过NCBI数据库查询公布的Kras序列,查找到相关序列并标出单核苷酸多态性(SNP)位点,在后续的引物和探针设计过程中保证引物探针位置不覆盖SNP位点,以免影响扩增效率或杂交效率.
由于所检测的7个突变集中在密码子12和13上,设计一条探针即可全部覆盖.为了增强探针对野生型和突变型的区分度,依据反义序列设计探针,使探针与野生型完全匹配.使用TmUtility v1.3软件预测探针与野生型和突变型杂交双链的Tm值,保证两者的ΔTm大于5 ℃.使用The Mfold Web Server(http:∥mfold.bioinfo.rpi.edu/cgi-bin/dna-form1.cgi)进行二级结构分析,保证设计的改良分子信标仅存在一种稳定的茎环结构,分析条件为Na+浓度50 mmol/L、Mg2+浓度3.0 mmol/L、折叠温度55 ℃.未修饰的探针设计完成后,结合Kras突变特点进行LNA修饰,7个热点突变发生在密码子12和13的3个碱基G位点上,对这3个位点的核苷酸进行LNA修饰.通过LNA TM Oligo Tools(https:∥www.exiqon.com/oligo-tools)预测修饰LNA后探针的Tm值.
综上所述,在抑制HeLa细胞中的GRIM-19基因表达后,细胞的存活及抗凋亡作用能力显著降低,提示GRIM-19基因对肿瘤细胞起到了保护作用。深入研究GRIM-19基因在子宫颈癌中的表达和意义将会为今后的临床治疗和防治提供重要的理论基础。
探针设计完成后,使用Primer Premier 5.0、Oligo 6.0和TmUtility v1.3软件在探针两侧设计引物.将设计好的引物和探针通过BLAST(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对,保证其扩增和检测的特异性.引物和探针均由上海生物工程有限公司合成,相应序列见表2.

表2 MCA-LNA体系所用引物和探针
注:“+”后的碱基表示其被相应的LNA替代.
1.2 方 法
1.2.1 人工合成靶序列MCA考察探针
人工合成的靶序列是一段与探针互补的寡核苷酸,比探针长约4~8 bp,用于考察探针的区分能力和评价LNA修饰对探针Tm值和ΔTm的影响.合成的8条靶序列如表3所示.

表3 本研究所用的人工合成靶序列
注:下划线标记位置为突变位点.
探针与人工合成靶序列的MCA体系(25 μL)如下:1×PCR缓冲液、0.2 μmol/L探针、0.4 μmol/L靶序列或无菌水(阴性对照).MCA程序为:95 ℃变性1 min,35 ℃保温5 min,随后按照每步0.2 ℃的升温速率从40 ℃递增至95 ℃,升温过程中采集ROX通道的荧光信号.实验在LightCycler 480实时荧光定量PCR仪(Roche,瑞士)上进行.
1.2.2 MCA-LNA体系的建立
MCA-LNA体系(25 μL)如下:1×PCR缓冲液、5 mmol/L MgCl2、0.2 mmol/L dNTPs、0.5 UTaqHS(TaKaRa,大连)、0.4 μmol/L上游引物、0.04 μmol/L下游引物、0.2 μmol/L探针和5 μL DNA模板.PCR反应程序为:95 ℃预变性3 min;循环周期为95 ℃ 20 s,58 ℃ 20 s,78 ℃ 10 s,共60个循环.PCR反应结束后进行探针MCA,分析程序与1.2.1小节中相同.
1.2.3 体系的分析灵敏度考察
灵敏度为在一定量野生型背景下能够检测到的突变模板含量.3.3 pg人类基因组DNA相当于1个拷贝[16],即10 ng相当于3×103个拷贝.考察MCA-LNA体系的分析灵敏度时,使用相同浓度(6×103拷贝/μL)的突变型质粒DNA和野生型基因组DNA按不同比例混合,形成一系列混合模板,突变型比例分别为50%,10%,5%,1%,0.5%,0.1% 和0.05%.
1.2.4 结直肠癌临床标本检测
通过对72份结直肠癌临床冰冻组织标本的检测,考察MCA-LNA体系的准确性和临床适用性.同时采用MCA体系、直接测序和本研究前期建立的ARMS[17]作为对照方法对临床标本的检测结果进行验证.
2 结果与分析
2.1 MCA-LNA体系检测原理
MCA技术检测突变的原理如下:当探针设计与野生型序列完全匹配时,探针与野生型扩增子形成完全匹配且稳定的双链产物,产生Tm值较高的熔解峰;而探针与突变型扩增子会产生单碱基错配,形成稳定性较差的双链产物,产生Tm值较低的熔解峰.MCA-LNA检测体系采用LNA修饰探针进行MCA,与MCA体系检测原理类似:由于完全匹配的DNA-LNA双链稳定性显著高于DNA-DNA双链,所以探针与野生型模板形成稳定的双链结构,在延伸阶段也可稳定结合,导致引物难以延伸,从而起到抑制野生型模板扩增的作用;而探针与突变型模板间有单碱基突变,相对于DNA-DNA双链,DNA-LNA双链存在错配会更大程度地降低双链稳定性,在延伸阶段探针可以解链,使得突变型模板的扩增不受影响,以此达到富集突变型模板的目的.
2.2 靶序列的MCA考察
靶序列的熔解曲线如图1(a)和(b)所示:探针与野生型模板完全匹配,所得双链产物的Tm值最高;探针与7个突变型模板均有一个碱基错配,所得双链产物的Tm值较低,且探针在LNA修饰前后均可达到区分野生型和突变型的目的.不同模板对应的Tm值如图1(c)所示,可见LNA修饰探针后,7种突变型和野生型模板的Tm值均得到明显提升,提升幅度在7~10 ℃.探针熔解曲线的区分能力取决于野生型与突变型的ΔTm值.如图1(d)所示,LNA修饰后探针的ΔTm提高约1~4 ℃,由此可见LNA修饰能提升探针的区分能力.

(a)和(b)分别为MCA-LNA和MCA体系的探针与靶序列的熔解曲线,WT为野生型对照,NTC为无模板对照,MUT为突变型模板,F表示荧光强度(下同);(c)野生型与不同突变型的Tm值对比;(d)不同突变型与野生型之间的ΔTm值对比.图1 靶序列的MCAFig.1 MCA of target sequences
2.3 分析灵敏度的考察
MCA-LNA体系的灵敏度考察结果如图2所示:灵敏度标准品由于混有野生型和突变型2种模板,所以会有2个不同Tm值的熔解峰;以突变型峰的有无作为判读依据,MCA-LNA体系的分析灵敏度可达0.05%~0.5%.由此可见MCA-LNA体系具有良好的检测灵敏度,更适用于肿瘤的稀有突变检测.
2.4 临床标本检测
MCA-LNA体系检测结直肠癌标本的结果显示,72份标本中检测出24份阳性,突变率为33.3%,与文献[18-19]报道的突变率一致.
典型临床标本的检测结果如图3所示:其中33号和51号标本经测序检测均为突变型,且51号标本中突变型的比例较33号的低,用MCA体系检测时,突变型比例较高的标本,其突变信号峰也较高,而MCA-LNA体系对这2份标本检测的突变型信号峰均更明显;对于67号标本,测序和MCA体系均未检出突变型,但MCA-LNA体系检测时有较低的突变型信号峰,说明MCA-LNA体系更有利于低比例突变型标本的检测.
全部标本的检测结果见表4.由于测序的灵敏度只能达到15%~20%,检测标本时容易造成假阴性,24份阳性标本中测序仅检测到15份突变阳性;MCA体系检测时,相比MCA-LNA体系少检出5份阳性标本,其余检测结果完全一致;ARMS检测时,检测到26份突变阳性标本,相比MCA-LNA体系多检出2份G12V阳性标本(10号和18号),分析其检测结果不一致的原因为ARMS对该位点的检测灵敏度(0.01%)略高于MCA-LNA体系对该位点的灵敏度(0.05%),当样本中突变型比例在0.05%以下时,MCA-LNA在该位点可能存在突变型标本漏检的情况.

图2 MCA-LNA体系的分析灵敏度Fig.2 Analytical sensitivity of MCA-LNA assay
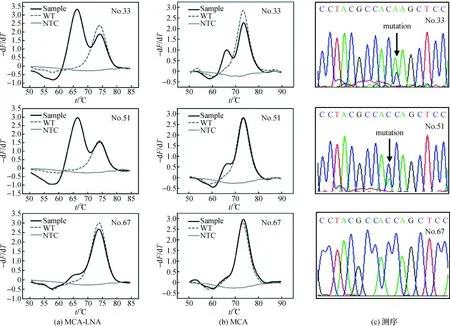
图3 典型临床标本的检测结果Fig.3 Detection results of typical clinical samples
以上结果说明标本检出的突变阳性率与分析灵敏度的高低有关,MCA-LNA体系的探针经LNA修饰后提升了检测的灵敏度,从而提高了突变阳性标本的检出率.
3 讨论与结论
Kras突变检测对结直肠癌患者的个体化治疗有非常重要的作用.然而Kras突变属于实体瘤中体细胞的稀有突变,对现有检测方法造成了技术瓶颈,因此要求检测的灵敏度必须得到很大程度的提升,以避免检测结果出现假阴性,提高稀有突变的检出率.

表4 不同方法的样本检测结果
注:WT.野生型;MUT.突变型.
LNA对DNA的亲和性高且区分度良好,在PCR反应过程中不会被DNA聚合酶的5′→3′外切酶活性所影响,可以富集突变型,提高体系的灵敏度.目前LNA技术已被广泛应用于低丰度突变的检测中,利用与野生型完全匹配的LNA修饰的寡核苷酸链作为阻抑子阻碍野生型模板的扩增,可实现对突变型模板的富集.例如利用LNA技术对低丰度突变富集后测序[20-21],灵敏度达到约1%,富集能力达到普通MCA体系的约20倍;利用LNA技术结合实时荧光定量PCR检测[22-24]时,在PCR反应体系中同时加入LNA阻抑子和荧光检测探针,灵敏度约为0.1%.本研究对MCA体系中的荧光双标记自淬灭探针进行LNA修饰,使探针同时作为阻抑子和检测探针,既在扩增阶段达到阻抑野生型和富集突变型的目的,又在MCA时作为检测探针对多种突变型与野生型进行区分,体系的灵敏度可达0.05%~0.5%,与普通MCA体系相比,LNA修饰后体系的突变富集能力可达10~100倍.
MCA-LNA体系存在的缺点是无法区分Kras突变的类型,但由于Kras多种突变类型对EGFR靶向药物都是耐药的,所以不会影响耐药情况的判断.近年来有研究显示,含有不同Kras突变的患者可能会有不同的临床反应:若携带有KrasG12D突变,则可能发生造血系统的转移[25];若发生Kras密码子13的突变,同时MACC1基因高表达,则患者生存期会减短[26];若发生KrasG12C或G13D突变,则预后会变差[27].这些研究说明Kras突变类型的区分也是有意义的,但目前还未得到广泛认证.若检测中需要进行突变类型的确认,可将MCA-LNA体系的扩增产物进行测序验证,辅助判读.
综上,本研究以MCA体系为基础,结合LNA修饰探针技术建立了MCA-LNA体系.与普通MCA体系相比,通过探针的改良达到了富集突变型的效果,提高了分析灵敏度,实现一管反应中同时检测Kras密码子12和13上的7个热点突变.此方法判读简单,检测成本较低,具有良好的临床推广潜力.
