基于多色探针熔解曲线分析技术的华法林个体化用药相关基因多态性快速检测方法
2019-11-29黄秋英夏众敏洪国粦李庆阁
黄秋英,夏众敏,洪国粦,李庆阁
(1.厦门大学生命科学学院,分子诊断教育部工程中心,福建 厦门 361102;2.厦门大学附属第一医院检验科,福建 厦门 361003)
华法林是一种香豆素类口服抗凝药,通过抑制维生素K及其2,3-环氧化物(即维生素K环氧化物)的相互转化而发挥抗凝作用.由于疗效确切且价格低廉,华法林是目前临床上应用最广泛的口服抗凝药,主要用于预防和治疗静脉血栓、心肌梗塞、缺血性休克、肺栓塞等多种血栓性疾病,以及用于心脏人工瓣膜置换术、人工血管移植术等.华法林的治疗窗口较窄(剂量不足有血栓风险,过量服用会出现致命性出血),个体间剂量差异大(达到适宜抗凝效果的个体间剂量差异可达10~20倍)且受药物或食物影响较大,其剂量需求同时受遗传因素和非遗传因素的影响.近年来,国内外多项研究显示遗传因素是造成个体间华法林维持剂量差异的主要原因之一,这些遗传因素包括CYP2C9、VKORC1、CYP4F2等约30个基因上的多态性位点[1].
2017年临床药物基因组学实施联盟(CPIC)发布的遗传药理学指导华法林使用剂量指南[2]中,推荐了目前科学证据最强的3个基因用于指导华法林剂量,即CYP2C9、VKORC1和CYP4F2.CYP2C9基因编码华法林在体内代谢的关键酶,该酶可将华法林代谢为无活性成分.人CYP2C9基因的遗传多态性,如中国人群常见的多态性CYP2C9*3(c.1075A>C,rs1057910)[2-4]、CYP2C9IVS3-65G>C(rs9332127)[5]等,会导致编码的CYP2C9蛋白活性降低,从而导致患者对华法林的代谢及清除能力降低,临床表现出对华法林敏感,需要减少给药剂量以减少不良反应的发生.VKORC1基因编码维生素K环氧化物还原酶复合体(VKORC)的一个亚基,其基因多态性也会导致VKORC的酶活性改变,从而影响华法林的抗凝效果.其中,VKORC1c.-1639G>A(rs9923231)可导致基因启动子活性差异,携带有等位基因A的患者相比GG纯合子患者需要的华法林剂量更少[6-8].CYP4F2是CYP超家族成员之一,主要存在于肝脏和肾脏,为维生素K的单氧酶,近年来的研究发现CYP4F2*3(c.1297G>A,rs2108622)多态性能影响1%~2%的华法林个体差异代谢,其中AA纯合子患者需要提高华法林剂量方能达到相同的抗凝效果[9-11].
目前检测华法林个体化剂量相关多态性的方法有多种,主要包括限制性内切酶片段多态性分析(RFLP)[1,12]、基因芯片[13]、等位基因特异性PCR[14]、变性高效液相色谱法(DHPLC)[15]、LNA-taqman探针实时荧光PCR[16]、高分辨熔解曲线分析(HRM)[17]、焦磷酸测序[18]、Sanger测序等,但这些方法多数存在操作繁琐、耗时、需要昂贵仪器、需要PCR后处理以及单个PCR反应无法同时检测多个多态性位点等缺点,大多数并不适合用于临床检测.
多色探针熔解曲线分析(multicolor melting curve analysis,MMCA)技术利用末端双标记的自淬灭荧光探针与靶序列杂交,形成的双链杂交体稳定性存在差异从而造成熔点的差异,以此来区分不同的靶基因或突变,在单个PCR反应中可以实现多种靶序列的检测和基因分型[19].目前,该技术已应用于多种遗传性疾病相关基因突变的检测[20-22].本研究拟利用MMCA技术在单个PCR反应中实现对3个华法林个体化用药相关基因(CYP2C9、VKORC1和CYP4F2)上4个多态性位点(rs1057910、rs9332127、rs9923231和rs2108622)的同时检测和基因分型.
1 材料与方法
1.1 样本采集和DNA提取
于2016年12月3日厦门大学生命科学学院细胞应激国家重点实验室开放日活动中,用唾液收集器(厦门致善生物科技有限公司)采集厦门地区随机人群(主要是中小学生)的唾液样本218份,所有样本的采集均获得采集对象及其监护人知情同意.唾液样本使用厦门致善生物科技有限公司Lab-Aid 820全自动核酸提取仪及配套的核酸提取试剂盒进行核酸提取.提取后的基因组DNA使用ND-1000全波长紫外-可见光扫描分光光度计(NanoDrop,美国)对其提取质量和浓度进行检测,并将DNA的终质量浓度调节为10 ng/μL,直接使用或置于-20 ℃冰箱中保存备用.
1.2 质粒标准品构建
以4个多态性位点的野生型基因组DNA为模板,通过直接扩增法构建野生型序列,采用重叠延伸法构建突变型序列,再采用TA克隆法将各序列连接至PMD 18-T载体(TaKaRa,大连)并转化大肠杆菌(Escherichiacoli),挑取阳性克隆;经双向测序鉴定正确后,提取纯化质粒DNA并通过ND-1000全波长紫外-可见光扫描分光光度计进行定量;随后分别制备成不同浓度梯度的待检基因的不同基因型(即野生型、杂合突变型和纯合突变型)质粒DNA,置于-20 ℃冰箱中保存备用.
1.3 引物和探针设计
通过NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)获得CYP2C9、VKORC1和CYP4F2的全基因序列,找到rs1057910、rs9332127、rs9923231和rs2108622多态性所在位置,针对每个多态性位点采用Primer Premier 5.0、Oligo 6.0、TmUtility v1.3软件先设计4条自淬灭探针,再围绕探针分别设计相应的扩增引物对.将设计好的引物和探针通过BLAST(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对,保证其扩增和检测的特异性.所有的引物和探针均由上海生物工程有限公司合成,相应序列见表1.
1.4 MMCA体系的建立
经过优化和调整建立MMCA体系,其具体组分(终浓度)为:1×PCR缓冲液,3 mmol/L MgCl2,0.2 mmol/L dNTPs,1 UTaqHS (TaKaRa,大连),F1、F2和F4各0.06 μmol/L,R1、R2和R4各0.6 μmol/L,1 μmol/L F3,0.1 μmol/L R3,P1和P4各0.2 μmol/L,0.22 μmol/L P2,0.12 μmol/L P3,5 μL DNA模板,用无菌水补齐至总体积25 μL.
PCR和熔解曲线分析均在Bio-Rad CFX96 实时荧光定量PCR 仪 (Bio-Rad,美国)上进行.PCR程序为:95 ℃ 预变性5 min;95 ℃变性15 s,65~56 ℃(每个循环下降1 ℃)退火15 s,76 ℃延伸20 s,10个循环;95 ℃变性15 s,55 ℃退火15 s,76 ℃延伸20 s,50个循环,在退火阶段采集相应检测通道的荧光信号.反应结束后,进行熔解曲线分析,程序为:95 ℃变性1 min,35 ℃保温5 min,随后按0.5 ℃/5 s的升温速率从40 ℃递增至85 ℃,且在此阶段采集探针所对应通道FAM、HEX、CY5、ROX的荧光信号.实验结束后,采用与仪器配套的Bio-Rad CFX Manager 3.0软件进行结果分析.
1.5 MMCA体系的评价
利用各多态性位点不同基因型的质粒标准品,由2名操作员分别在2个不同的实验室进行连续5次实验,每次实验中每个样品设置3个重复,以对MMCA体系的重复性和再现性进行评价.每次实验均统计各多态性位点野生型和突变型的Tm值,并计算野生型与突变型的Tm差值(ΔTm).

表1 引物和探针序列
注:下划线标记位置为基因多态性位点.
为考察MMCA体系的检测灵敏度,用建立好的MMCA体系检测10倍梯度稀释的已知基因型的人基因组DNA模板(rs9923231: AA; rs2108622: GG; rs1057910: AA; rs9332127: GG),每个梯度加入的模板量依次为50,5,0.5,0.05,0.005 ng.根据0.01 ng人基因组DNA相当于3个拷贝,将体系中的初始模板量转换成人基因组DNA的拷贝数.为了进一步验证试剂盒的检测灵敏度,在梯度稀释实验的基础上,再对初步确定检测限浓度的人基因组DNA样本进行20管平行检测实验.
1.6 随机人群样本检测及验证
用所建立的MMCA体系分批次对218份未知人基因组DNA样品进行4个基因多态性位点的检测和基因分型,每次实验均以一份由各多态性位点(rs9923231: AA; rs2108622: GG; rs1057910: AA; rs9332127: GG)相应的质粒等比例混合得到的质粒标准品为阳性对照,以无菌水替代DNA模板为阴性对照(NTC).检测完成后由Bio-Rad CFX Manager 3.0软件自动获取各通道信号,判读样本各位点基因型,并对结果进行统计分析.同时根据基因分型结果选择各多态性位点不同基因型的共40份样本进行PCR扩增,产物送上海生物工程有限公司测序,以验证MMCA体系检测结果的准确性和特异性.
1.7 统计学分析
用SPSS 18.0统计软件进行数据处理,通过χ2检验判断所检测的rs1057910、rs9332127、rs9923231和rs2108622多态性位点的等位基因频率和基因型频率分布是否符合Hardy-Weinberg平衡,p<0.05表示有显著差异.
2 结果与分析
2.1 MMCA体系的设计及基因分型结果
用于华法林相关基因多态性检测的MMCA体系设计如图1所示.整个MMCA体系是一个单管四重四色PCR体系,针对4个待检测的基因多态性位点分别设计1对引物和1条覆盖基因多态性位点的自淬灭荧光探针,其中每个多态性位点的检测荧光探针均标记不同荧光基团,分别对应实时荧光定量PCR仪中的不同检测通道FAM、HEX、CY5、ROX.MMCA体系检测流程包括3个步骤(图1(a)):首先将各位点的引物和探针均加入PCR反应管,进行不对称PCR扩增;PCR扩增后产生大量可与相应荧光探针互补的单链产物,随后进行低温到高温的熔解曲线分析,采集各通道在整个熔解曲线分析过程的荧光强度(F);最后,利用实时荧光定量PCR仪配套的软件进行结果分析,获取各熔解曲线的熔解峰,根据熔解峰的个数及Tm值的高低判断各多态性位点的基因型.
利用不同基因型的质粒DNA标准品,建立了4个基因多态性位点的标准熔解曲线.如图1(b)所示:当模板为野生型时(黑色实线),各基因多态性位点均只有野生型熔解峰;当模板为杂合突变型时(灰色虚线),各基因多态性位点均有野生型熔解峰和突变型熔解峰;当模板为纯合突变型时(黑色虚线),各均只有突变型熔解峰.因此,利用熔解峰的个数及Tm值的差异,各多态性位点均可实现较好的基因分型.

图1 MMCA体系的基因多态性检测流程(a)及各多态性位点的典型基因分型结果(b)Fig.1 Flowchart of the MMCA assay for gene polymorphism detection (a), and the typical genotyping results with plasmid of each polymorphism site (b)
2.2 MMCA体系的评价结果
MMCA体系对各多态性进行区分是依据熔解峰Tm值的不同,4个多态性位点分别分布在4个不同的检测通道,每个通道可能有2个不同的熔解峰.为避免各熔解峰Tm值的波动范围太大而导致结果误判,对各熔解峰Tm值的重复性和再现性进行考察.结果表明(表2):各熔解峰Tm值较稳定,其3倍标准偏差(3SDs)均小于0.9 ℃,相邻的熔解峰之间没有交叠,区分度良好;各多态性位点的不同等位基因之间Tm值差异波动也很稳定,ΔTm均大于3.5 ℃,3SDs均小于0.53 ℃.由以上结果可见不同操作员在不同实验室使用不同批次配制的MMCA体系检测多份质粒标准品时,均能获得稳定的检测结果,说明MMCA体系具有良好的重复性和再现性.
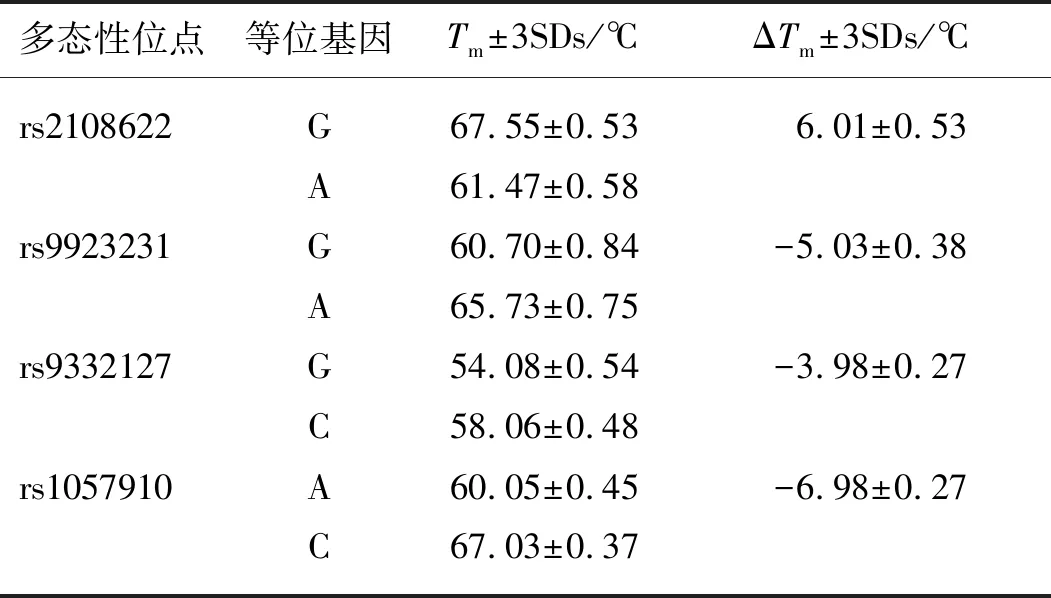
表2 各基因多态性位点的野生型和突变型熔解峰的Tm值
注:Tm为平均值;ΔTm=Tm(野生型)-Tm(突变型).
由于人基因组DNA来源(如血液、唾液、头发等)的不同可能造成基因组DNA的提取质量及浓度有所不同,而MMCA体系最终检测的对象是人基因组DNA模板,所以有必要对所建立体系适用的人基因组DNA浓度检测范围(即灵敏度)进行考察.图2的结果表明:MMCA体系可对0.05~50 ng的人基因组DNA模板进行检测,不论模板起始浓度的高低,熔解曲线分析均只产生同一个熔解峰,故不会对标本基因型的判断造成影响;但模板起始浓度会影响熔解峰的高度,在起始模板量为0.005 ng时,有个别通道的熔解峰较低,但对于0.05 ng的模板(相当于15个拷贝的人基因组DNA)则各通道均能稳定检测,故将此MMCA体系的最低检测限初定为0.05 ng的人基因组DNA.
随后对0.05 ng人基因组DNA的20管平行检测实验结果表明,20管在各通道均有稳定的熔解峰,检出率为100%,验证了MMCA体系的最低检测限为0.05 ng人基因组DNA,说明该体系具有较高的检测灵敏度.
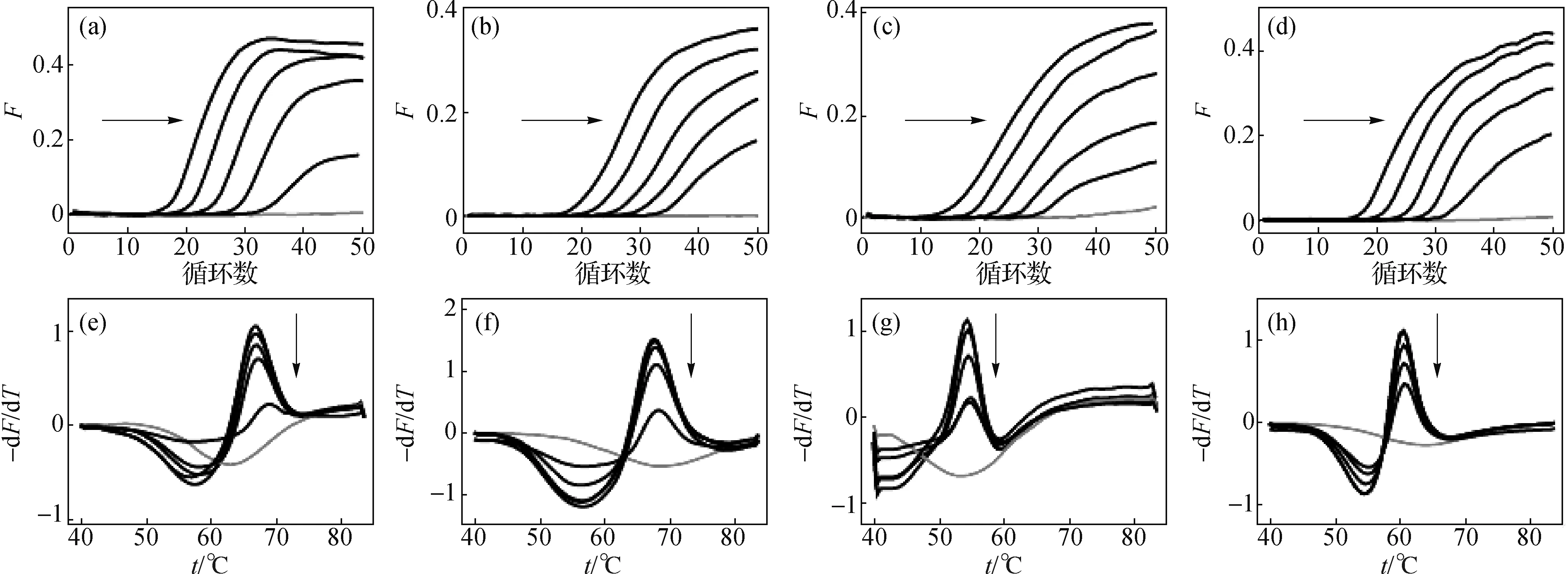
(a)~(d)分别为FAM、HEX、CY5、ROX通道的扩增曲线,(e)~(h)分别为对应的熔解曲线分析结果;各图中按箭头指示方向加入的人基因组DNA量依次为50,5,0.5,0.05,0.005 ng,灰色曲线为未加模板的阴性对照.图2 MMCA体系的检测灵敏度Fig.2 Detection sensitivity of the MMCA assay
2.3 随机人群样本检测结果
利用MMCA体系对218份人基因组DNA样本的CYP4F2、VKORC1和CYP2C9的4个多态性位点进行基因分型,各多态性位点检测结果参考图1(b)进行判读.如表3所示,在218份样本中检测到CYP4F2rs2108622位点的基因型GG、GA和AA分别为124,82和12例,各占56.9%,37.6%和5.5%;检测到VKORC1rs9923231位点的基因型GA和AA分别为34和184例,各占15.6%和84.4%,未检测到野生型纯合子GG基因型;检测到CYP2C9rs9332127位点的基因型GG、GC和CC分别为204,12和2例,各占93.6%,5.5%和0.9%;检测到CYP2C9rs1057910位点的基因型AA、AC和CC分别为203,14和1例,各占93.1%,6.4%和0.5%.抽取其中40份不同基因型样本进行测序,结果与MMCA体系基因分型结果完全一致,说明MMCA体系具有很高的特异性和准确性.
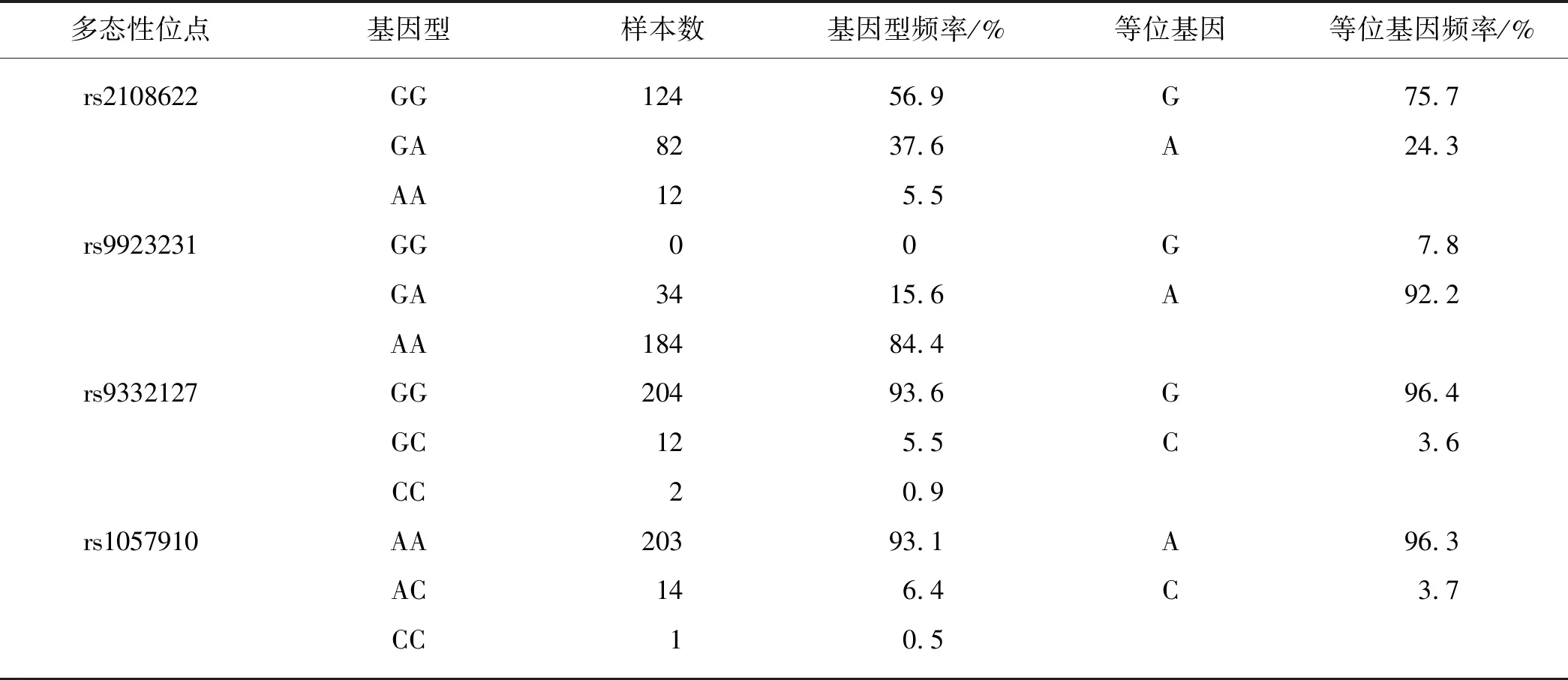
表3 218例样本的基因分型结果及所检测的各基因多态性位点的频率
经χ2检验分析,所选人群的4个多态性位点rs2108622、rs9923231、rs9332127和rs1057910的等位基因频率和基因型频率均符合Hardy-Weinberg平衡,χ2值分别为0.008,1.139,1.077和1.077,p>0.05.
3 讨 论
本研究选用VKORC1、CYP4F2和CYP2C9这3个基因上中国人群出现频率高的4个单核苷酸多态性(SNP)位点作为检测对象,利用MMCA技术在单个四重四色PCR反应中成功实现对4个SNP位点的同时检测和基因分型.对体系的性能评价结果表明,该体系有较好的重复性和再现性,不同操作人员在不同的实验室采用不同批次配制的MMCA体系检测已知标准品均能获得稳定的结果,各多态性位点Tm值的3SDs均小于0.9 ℃;同时该体系可检测低至0.05 ng的人基因组DNA,具有很高的检测灵敏度,可以满足对临床各种不同来源(唾液、血液、头发等)DNA样本的检测要求;而对不同基因型质粒DNA标准品和218例随机人群基因组DNA样本的基因分型结果与部分样本的测序结果完全一致,说明MMCA体系检测具有很高的特异性和准确性.
通过对218份厦门地区随机人群基因组DNA的4个SNP位点的基因分型,考察了华法林个体化用药相关基因的4个SNP位点在厦门地区的发生频率.如表3所示:CYP4F2*3(c.1297G>A, rs2108622)的等位基因G和A的频率分别为75.7%和24.3%,其中A等位基因携带者需要提高华法林用药剂量;VKORC1c.-1639G>A(rs9923231)的等位基因G和A的频率分别为92.2%和7.8%,其中A等位基因携带者需要减少华法林用药剂量;CYP2C9*3(c.1075A>C, rs1057910) 的等位基因A和C的频率分别为96.4%和3.6%,其中C等位基因携带者需要减少华法林用药剂量;CYP2C9IVS3-65G>C (rs9332127)的等位基因G和C的频率分别为96.4%和3.6%,其中C等位基因携带者需要减少华法林用药剂量.上述4个SNP位点在厦门地区的发生频率均符合已有中国汉族人群的研究结果[23-24].因此,CYP2C9*3、CYP2C9IVS3-65G>C、VKORC1c.-1639G>A和CYP4F2*3基因多态性在中国人群具有一定的发生率,这是影响中国人群华法林个体剂量差异的主要因素.在用药前进行这些基因多态性检测,并结合患者的身高、体质量等临床信息,有助于为患者提供合理的华法林剂量,缩短调整时间,降低严重不良反应的发生率.
目前国内外常用的检测华法林个体化用药相关SNP位点的方法可分为需要PCR后处理的方法(如PCR-RFLP、基因芯片、等位基因特异性PCR、DHPLC、焦磷酸测序、Sanger测序等)和无需PCR后处理的基于实时荧光定量PCR的方法(如LNA-taqman探针实时荧光定量PCR、HRM)两类.其中前者在PCR后需要多步骤操作,容易造成PCR产物污染,耗时长,检测通量低,临床适用性差;后者不需要PCR后处理,简便快速,但单管能同时检测的位点有限,在一定程度上也限制了临床上的应用.本研究基于MMCA技术开发的检测体系可在单个常规四重四色PCR反应中同时实现4个SNP位点的基因分型,扩增和检测整个过程均在封闭的管中进行,且无需任何PCR后处理,在2.5 h内即可完成检测,操作简便,检测通量高,因此与目前方法相比具有多方面的优势,适合推广用于临床实验.
4 结 论
本研究所建立的MMCA体系具有简便、快速、无需PCR后开盖处理、检测通量高等优点,在进行更深入的临床性能评价后,有望用于华法林个体化用药相关基因CYP2C9、VKORC1和CYP4F2多态性的临床分子诊断.
