DLL4-Notch1信号通路与肺癌组织新生血管形成的相关性研究
2019-11-27王玉洁权瑞泉
张 丽,匡 黎,王 宇,王玉洁,向 玮,权瑞泉△,杨 靖
(湖北医药学院附属东风医院:1.肿瘤科;2.儿科;3.急诊科,湖北十堰 442001;4.湖北医药学院基础医学院微生物免疫教研室,湖北十堰 442000)
肺癌是目前全球发病率最高的癌症,每年全球有100多万人死于肺癌,其中80%以上为非小细胞肺癌(NSCLC)[1]。NSCLC的恶性程度比较高,多数患者就诊时既已发生远处转移,伴随有血管生成,失去手术治疗机会,5年生存率低[2-3]。抗血管生成药物给NSCLC治疗带来的生存获益已被临床证实[4],但是目前研究对NSCLC相关的新生血管形成信号通路的报道较少。Delta样配体4(DLL4)-Notch1信号通路可促进或抑制细胞增殖、分化和凋亡,还有助于调节机体血管生成[5-6]。并且该通路在进化过程中属于高度保守的信号通路,其中Notch1受体家族有4个成员,Notch1是最常见的Notch1受体,在结直肠癌、胃癌中起着促癌的作用[7-8]。已有研究显示,Notch1的过量表达可使NSCLC细胞周期阻滞在G0期,抑制细胞生长[9-10]。基础研究也显示,Notch1在正常早期小鼠肺内均有表达,其在小鼠肺中的表达量随年龄增长而增加,在肺发育中发挥重要作用[11],但是与新生血管形成的研究还鲜有报道。本文具体探讨DLL4-Notch1信号通路与NSCLC组织新生血管形成的相关性,希望为NSCLC的诊断、评价、治疗提供思路与参考。现报道如下。
1 资料与方法
1.1一般资料 选择2009年8月至2017年2月保存于湖北医药学院附属东风医院病理科的肺癌组织标本56例(肺癌组)与癌旁组织标本(离肺癌肿块>5.0 cm的肺组织)56例(癌旁组)。纳入标准:临床病理资料完整,每例患者都保存有肺癌组织标本与癌旁组织标本;病理确诊为NSCLC,患者术前均未行放、化疗及其他抗肿瘤治疗;年龄20~80岁。排除标准:临床与病理资料缺乏者;合并严重性心脏瓣膜病、先天性心脏病患者。56例患者中男30例,女26例;年龄22~78岁,平均(63.22±2.19)岁;病理类型:鳞状细胞癌50例,腺癌6例;分化类型:高分化6例,中分化35例,低分化15例;淋巴结转移31例;临床分期:Ⅰ期21例,Ⅱ期19例,Ⅲ期10例,Ⅳ期6例;平均病程(4.10±0.22)年;平均体质量指数(22.47±1.48)kg/m2。
1.2免疫组织化学分析 兔/鼠抗人多克隆抗体(抗DLL4抗体、抗Notch1抗体)、PBS缓冲液购自北京中杉金桥生物技术有限公司,羊抗鼠/兔IgG 聚合物(二抗)、DAB显色剂购自福州迈新生物技术开发有限公司。所有组织标本均经4%中性福尔马林固定,石蜡包埋组织以4 μm厚连续切片。60 ℃烘烤,二甲苯、乙醇脱蜡水化,高压热修复,3%H2O2灭活。免疫组织化学染色步骤按试剂盒说明书进行,抗DLL4抗体、抗Notch1抗体工作浓度为1∶500,37 ℃孵育1 h,二抗于室温下作用10 min(工作浓度1∶2 000),DAB 显色3~5 min,苏木素对比染色,封片后在镜下观察分析结果。免疫组织化学染色步骤按试剂盒说明书进行,以PBS液代替一抗作空白对照,用已知阳性片作对照。
1.3判断标准 所有免疫组织化学结果最后由2位病理医师采用独立双盲法阅片判定。DLL4、Notch1均以细胞膜和细胞质出现棕黄色颗粒为阳性。着色强度:0分,无色;1分,淡黄色;2分,棕黄色;3分,棕褐色。着色范围:0分,阳性细胞所占百分比<10%;1分,11%~50%;2分,51%~75%;3分,>75%。将着色强度得分和着色范围得分的乘积作为判断结果,总得分≤2为阴性,总得分>2为阳性。
1.4调查内容 本研究调查了患者的一般资料与新生血管形成状况,包括年龄、性别、临床分期、病程、分化类型、病理类型、淋巴结转移、体质量指数、新生血管形成等。

2 结 果
2.1DLL4-Notch1表达情况对比 肺癌组的DLL4与Notch1阳性表达率分别为57.1%和14.3%,癌旁组分别为7.1%和32.1%,DLL4、Dotch1在2组间差异均有统计学意义(P<0.05)。见表1与图1。
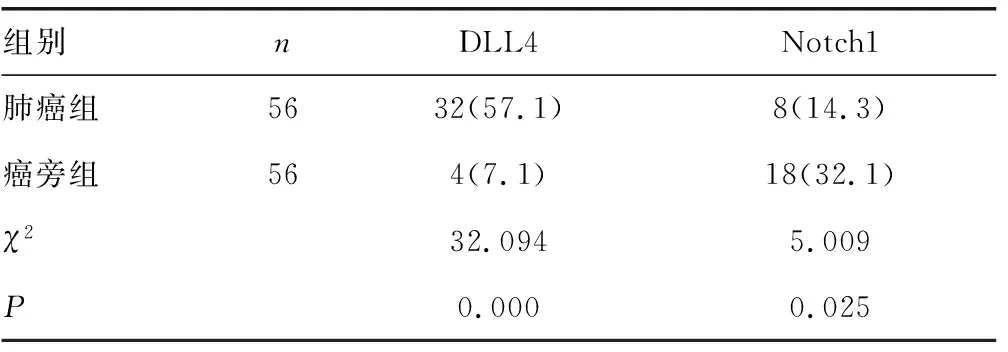
表1 2组DLL4-Notch1表达情况对比[n(%)]
2.2新生血管形成情况 在56例患者中,病理表现为新生血管形成30例,其DLL4与Notch1阳性表达率分别为96.7%和1.3%,与非新生血管形成(1.3%和26.9%)比较,差异有统计学意义(P<0.05)。见表2。
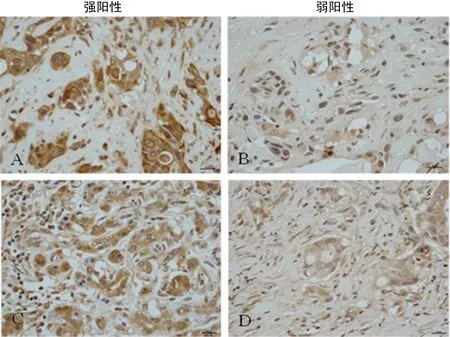
注:A、B表示DLL4;C、D表示Notch1
图1肺癌组DLL4-Notch1的免疫组织化学表达

表2 肺癌组中新生血管形成的DLL4、Notch1阳性表达率比较[n(%)]
2.3相关性分析 在肺癌组中,Spearman相关分析显示,新生血管形成与DLL4表达呈正相关(r=0.734,P=0.000),与Notch1表达呈负相关(r=-0.795,P=0.000)。
2.4影响因素分析 在肺癌组中,以新生血管形成为因变量,将调查资料、免疫组织化学结果等因素作自变量,多因素非条件Logistic 回归分析显示,DLL4表达、Notch1表达、临床分期、淋巴结转移、组织学分化均为影响新生血管形成的因素(P<0.05)。见表3。

表3 影响肺癌患者新生血管形成的多因素分析结果(n=56)
3 讨 论
肺癌是目前全球发病率最高的癌症,NSCLC约占肺癌总数的80%。NSCLC患者的5年生存率很低,术后转移、复发是主要原因[12-13]。本研究显示,肺癌组的DLL4与Notch1阳性表达率分别为57.1%和14.3%,癌旁组分别为7.1%和32.1%,差异均有统计学意义(P<0.05)。Notch1的过量表达可以引起NSCLC细胞形态发生改变,抑制细胞的生长。Notch1在肿瘤组织中的表达与具有促癌作用的DLL4 因子均呈负相关,提示Notch1可能存在抑制NSCLC生长的趋势[14-15]。
肿瘤的生长与肿瘤的血管生成密切相关,新生血管形成可以与机体血液循环相通,使得肿瘤组织能得到更好的血液供应,促进肿瘤的转移与侵袭[16]。本研究结果显示,在56例患者中,病理表现为新生血管形成30例,其DLL4与Notch1阳性表达率分别为96.7%和1.3%,与非新生血管形成(1.3%和26.9%)比较,差异有统计学意义(P<0.05),表明有新生血管形成的NSCLC具有更高的侵袭性和转移能力,临床上表现为患者预后很差。新生血管形成的特点为管道内没有血管内皮细胞衬覆,肿瘤细胞模仿机体血管生成而形成瘤细胞条索并围成管道[17]。病理学显示分化程度越低,新生血管形成的阳性率越高,肿瘤的恶性度越高[18]。而DLL4与Notch1的表达都可调节肿瘤干细胞的分化,特别是DLL4高表达可导致肿瘤干细胞比例减低,抑制肿瘤细胞克隆形成,促进细胞分化和凋亡[19]。当前也有研究显示,Notch1具有很强的致瘤、血管侵袭能力;在增殖过程中,Notch1可能会分泌某种化学因子,使得肿瘤细胞具有新生血管的微环境,从而调节内皮细胞的增殖,并促进血管的发育和成熟[20]。
肿瘤的生长与肿瘤的血管生成密切相关,抗血管生成已经是当前肿瘤治疗研究的新方向。DLL4-Notch1信号通路是影响肿瘤血管生成的重要信号通路,DLL4是唯一特异性存在于血管内皮细胞的Notch1配体,可调控血管萌发和分支的形态[21]。DLL4只存在于内皮细胞的表面,在肿瘤组织中呈高表达状态,可促进肿瘤生长;阻断DLL4信号,起到协同抑制肿瘤生长的作用[22]。Notch1受体是目前Notch信号通路中研究最多的受体,其通过邻近细胞间的相互作用来调控细胞的生物学行为;Notch1的异常活化可能使细胞过度增殖和侵袭[23]。本研究Spearman相关分析显示,肺癌组织的新生血管形成与DLL4表达呈正相关(r=0.734,P=0.000),与Notch1表达呈负相关(r=-0.795,P=0.000);多因素非条件Logistic 回归分析显示,DLL4表达、Notch1表达、临床分期、淋巴结转移、组织学分化均为影响新生血管形成的因素(P<0.05),表明DLL4-Notch1信号通路异常可能参与NSCLC的病理学分化等,该通路的异常表达可促进新生血管形成和肿瘤的侵袭、转移[24]。但是抗新生血管形成治疗并不是对所有NSCLC都有效,有的NSCLC虽然在治疗初期有效,但在治疗过程中可以发展为耐药,因此,有必要研究更多的影响新生血管形成的信号通路,寻找新的血管治疗靶点,从而改善患者的预后[25]。
4 结 论
DLL4-Notch1信号通路在NSCLC的形成中起重要作用。DLL4-Notch1信号通路促进新生血管形成是NSCLC组织发生侵袭、转移的关键事件,可作为评估NSCLC患者临床特征与转移的重要指标。
