日本积水乳胶凝集法KL-6试剂盒的性能评价
2019-11-27岳道远邓玲艳潘莹莹胡卫红
岳道远 ,邓玲艳,王 旭,潘莹莹,胡卫红
(华中科技大学同济医学院附属同济医院检验科,湖北武汉 430030)
血清人唾液酸化糖链抗原6(KL-6)是KOHNO等[1]发现并命名的高分子量糖蛋白,属于分类为Cluster9的上皮性黏蛋白1(MUC1)蛋白。KL-6主要由增殖的、受激发的或受损的Ⅱ型肺泡上皮细胞分泌,对判断Ⅱ型肺泡上皮细胞的功能具有特异性。在肺泡损伤的初期,KL-6表达明显增加,并从肺部渗到血液中从而使血清中KL-6水平也升高[2],并且这种升高与组织的纤维化损伤程度呈正相关[3]。近年有研究报道血清KL-6高水平表达可能与间质性肺疾病[4]、急性肺损伤[5]、病毒性肺炎[6]、药物相关性间质性肺炎[7]、肿瘤等疾病相关联,其作用可能是促进成纤维细胞增殖和迁移,从而影响纤维化的发生和发展[8]。有研究发现,血液中KL-6水平能够敏感地反映肺泡上皮和间质的损伤程度,在日本已经成功作为过敏性肺炎、结节病和放射性肺炎等疾病的特异性诊断标志物用于临床诊断[9-11]。2006年中国原卫生部颁布的《医疗机构临床实验室管理办法》中明确要求,临床实验室在某一检测项目正式用来检测患者标本、发出检验报告前,实验室需对其相关方法学分析性能进行评价,现根据文献、国内外标准和指南的要求评价积水公司的KL-6定量检测试剂盒在本实验室罗氏MODULAR P800全自动生化分析系统上的性能,报道如下。
1 材料与方法
1.1仪器与试剂 瑞士罗氏公司生产的MODULAR P800全自动生化分析仪;日本积水公司生产的血清KL-6定量检测试剂盒(批号:909RLM)及配套校准品(批号:917JYK,918HYK)、质控品(批号:803MGO)。日本希森美康公司生产的干扰物A-PLUS(批号:ZS6003)。
1.2标本来源 2016年1—10月本院门诊、住院患者生化常规检测后将剩余血清标本,分装于冻存管保存在-80 ℃冰箱,检测前进行复温。
1.3方法
1.3.1仪器准备 实验前按厂商要求对MODULAR P800进行维护保养和功能校准,室内质控合格,以确保仪器各项性能合格,操作人员均规范培训,以熟练掌握仪器的操作和了解整个实验方案。
1.3.2精密度及正确度评价 参照临床实验室标准化协会(CLSI)EP5-A2的标准[12],选取低值和高值2个水平质控品,批号均为803MGO,标示水平分别为150 U/mL和1 130 U/mL,1 d内连续测定20次,计算日内不精密度;然后每天测定1次,连续检测20 d,计算日间不精密度。参照CLSI EP15-A2标准[13]和国内毕波等[14]的方案,复测不同批号校准品,计算允许偏差来进行正确度验证,允许偏差标准以目前实验室所能达到的技术性能来制订[15],即<10%为合格。
1.3.3分析测量范围及稀释回收试验评价 参照CLSI EP6-A2标准[16],选取线性范围两端低水平(L)、高水平(H)2个标本各1份,然后按不同份数比进行混合配比:5份L+0份H、4份L+1份H、3份L+2份H、2份L+3份H、1份L+4份H、5份H+0份L,配成6个水平的系列标本,每份标本测定2次,计算线性回归方程和相关系数(r),r>0.990表明分析测量范围验证合格。选取3份高值标本,其中1份水平在5 000 U/mL左右(接近分析测量范围上限),将样本通过仪器自动稀释3倍后,检测2次取均值,将均值乘以稀释倍数,如回收率在90%~110%,则稀释回收试验验证通过。
1.3.4检出能力评价 根据CLSI EP17-A2指南[17]的要求,选取接近定量检出限(LoQ)水平的3个低值标本,用标记水平为0的校准品对标本进行稀释至LoQ附近,然后每天重复测量5次,连续检测4 d,总计20个有效数据,计算不精密度,若<20%(厂商标准),则验证通过。
1.3.5生物参考区间验证 参照WS/T402—2012《临床实验室检验项目参考区间的制定》的要求[18],选择74例健康体检成年人,入选标准:影像学无肺部病变,血糖、糖化血红蛋白、同型半胱氨酸、胱抑素-C等生化指标检测结果正常;若<5%(95%CI)的结果超出厂商提供的参考区间,则验证通过。
1.3.6分析干扰能力的评价 依据CLSI EP7-A2指南[19]的建议,采用添加外源性干扰物的方式来进行KL-6抗干扰性能评估。购买日本Sysmex公司A-PLUS系列干扰物,标示水平分别为游离胆红素200 mg/dL,结合胆红素200 mg/dL,溶血血红蛋白5 000 mg/dL,乳糜微粒2 000 FTU的干扰物和对应的空白液。将溶解好的干扰物和空白液分别与混合血浆按比例配置成一定水平梯度的检测物,以原混合血浆作为空白对照,测定各检验项目,判断其受干扰程度。
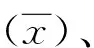
2 结 果
2.1不精密度评价结果 2个水平的积水KL-6质控品的日内不精密度分别为3.15%和0.98%,日间不精密度分别为4.99%和1.66%,均低于厂商提供的不精密度标准,见表1。

表1 积水KL-6 2个水平质控品在MODULAR P800上检测的不精密度结果
2.2正确度评价结果 使用批号为917JYK(EXP:2018年10月)的校准品校准检测系统后,对另一批号为918HYK (EXP:2019年1月)的校准品进行检测,重复检测3次计算均值与偏差;依据当前技术水平,以厂商声明允许偏差(<20%)的1/2作为实验室允许偏差;4个不同水平校准品检测均值与标示值的偏差在-0.22%~1.53%,均低于本实验室规定的允许偏差,见表2。

表2 积水KL-6校准品在MODULAR P800上检测的正确度评价结果
2.3分析测量范围评价结果 以自配标本的实测均值为Y,预期值为X,得出线性回归方程为Y=0.982 5X-44.233 0,Pearson相关系数r=0.998 3,即r>0.990,直线回归方程斜率在0.97~1.03,且P<0.05,数据呈线性关系。故本实验验证的KL-6分析测量范围为50.1~4 935.5 U/mL,与试剂厂商提供的线性范围(50~5 000 U/mL)接近,验证合格,见表3。

表3 积水KL-6试剂在MODULAR P800上检测的分析测量范围
2.4稀释倍数验证及临床可报告范围评价 将3份高值标本用仪器3倍自动稀释后,重复检测2次取均值;原倍标本重复检测2次后取均值;再计算回收率,以回收率在90%~110%判定为合格。本次3份标本的稀释检测回收率均合格,见表4。临床可报告范围为分析测量范围的上限乘以稀释倍数,即为50~15 000 U/mL。
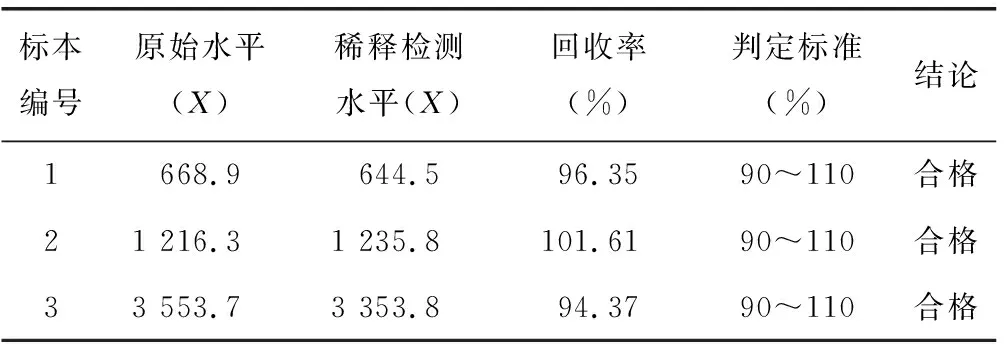
表4 临床可报告范围评价结果表
2.6生物参考区间评价结果 积水KL-6试剂说明书声明的生物参考区间为105.3~401.2 U/mL,参与验证的74例体检健康者的检测结果中仅3例超出范围,占4.05%,<5%(生物参考区间取95%CI),验证合格。
2.7分析干扰能力评价结果 将干扰物和对照空白液分别按要求用纯化水预先溶解,将溶解好的干扰物1.0 mL与9.0 mL混合血浆混匀制成标本A,作为干扰标本;将溶解后的空白液1.0 mL与9.0 mL混合血浆混匀制成标本B,作为对照标本;将A和B按表6的要求配制成不同稀释比例的标本,重复检测2次取均值,并计算标本A、B间的偏差(干扰值),偏差(%)=(A-B)/B×100%,以偏差<10%作为是否存在明显干扰的判定标准。见表5。通过添加系列水平的外源性干扰物对临床常见的游离胆红素、结合胆红素、溶血血红蛋白、乳糜微粒这4种干扰物对试剂盒检测性能的干扰程度进行评价,以干扰值<10%作为判定标准,实验结果显示在游离胆红素水平在20 mg/dL以下,结合胆红素水平在20 mg/dL以下,溶血血红蛋白在500 mg/dL以下,乳糜微粒在2 000 FTU以下对检测结果的影响较小,干扰值<10%,见表6~9。

表5 干扰标本配置表
注:—表示无数据
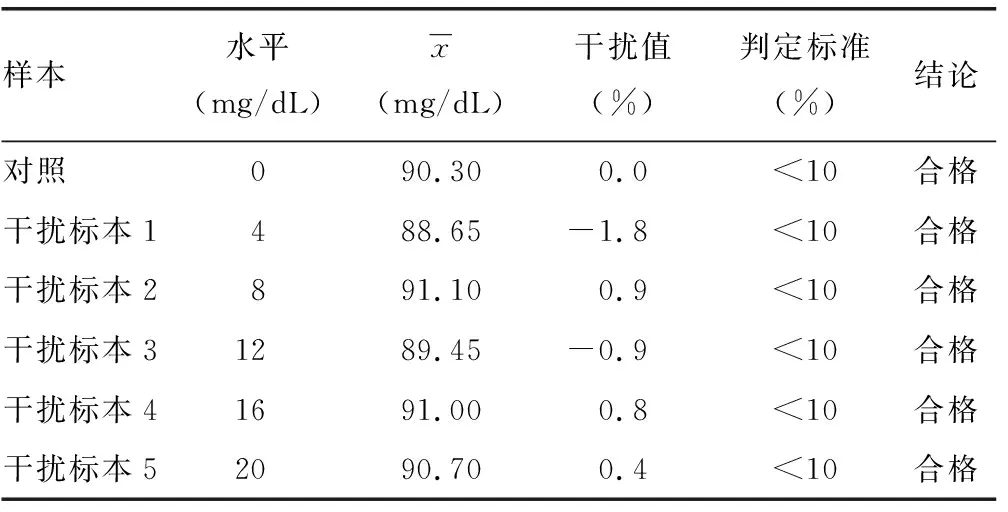
表6 游离胆红素干扰试验结果
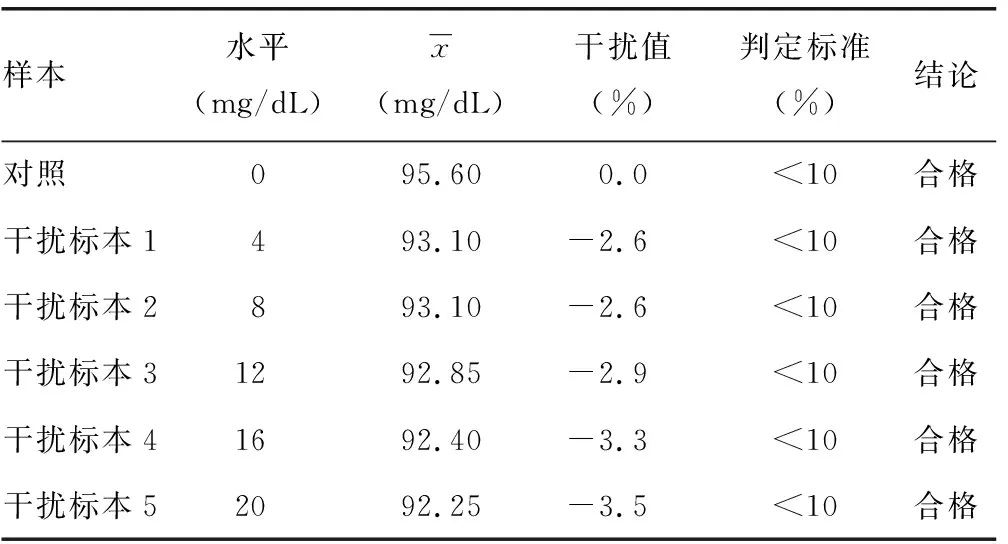
表7 结合胆红素干扰试验结果

表8 溶血血红蛋白干扰试验结果

表9 乳糜微粒干扰试验结果
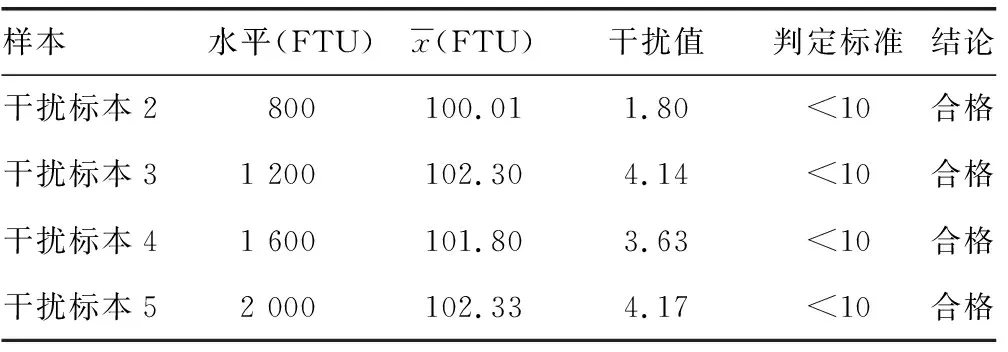
续表9 乳糜微粒干扰试验结果
3 讨 论
近年来,随着我国科技的进步,实验室诊断水平有了大幅提高,各种检测仪器、体外诊断试剂盒基本能与发达国家同步使用。美国《临床实验室改进法规修正案》和我国《医疗机构临床实验室管理办法》均规定[20],新型试剂盒及各种检测设备在应用于临床之前,实验室必须对检测系统的主要分析性能进行评价,内容包括不精密度、正确度、分析测量范围、临床可报告范围、检测限等。随着ISO15189实验室认可在国内日益受到重视,广大实验室工作人员也对方法学性能评价有了更多的关注和认识,而实验室检测系统分析性能是否满足临床的需求,是开展质量管理工作的根本。因此,在新项目开展之前,应按要求对其进行方法学性能评价,以确保其分析性能满足临床的要求。
本研究依据行业指南或文献报道,对血清KL-6检测系统的不精密度、正确度、分析线性范围、临床可报告范围、检出能力、生物参考区间等进行了验证,并对常见干扰物如胆红素、溶血血红蛋白、乳糜微粒等的抗干扰能力进行了初步的评估。实验结果表明,血清KL-6检测试剂盒在罗氏MODULAR P800生化分析仪上检测的日内不精密度和日间不精密度均小于其试剂说明书声明的10%。由于当前血清KL-6检测方法中,尚无公认的参考物质和参考测量程序,也无合适的室间质评材料,所以在正确度评价方面[21],本文依据当前实验室技术水平,使用类似校准验证的方式,采用KL-6检测试剂盒说明书声明的正确度允许偏差的1/2作为评价标准。参照CLSI EP6-A2标准,配置不同血清KL-6水平的6份标本,水平范围覆盖厂商声明的线性范围,实验结果表明可接受50~5 000 U/mL作为仪器的分析检测范围。同时通过稀释回收试验验证将接近线性范围上限的标本进行3倍稀释结果可靠,可以将线性范围上限乘以稀释倍数直接作为该项目的临床可报告范围的上限,从而将临床可报告范围拓展至50~15 000 U/mL;并根据CLSI EP17-A2的要求对血清KL-6的检出限进行评估[17],即使用标记水平为0的校准品对标本进行稀释,获得3份接近KL-6检测下限的标本,按要求重复检测,计算各自的CV,实验结果显示其不精密度在10.72%~11.63%,小于厂商试剂说明书的要求;在表观健康体检者中,74例只有3例超出,验证合格。干扰试验结果表明当游离胆红素水平<20 mg/dL,结合胆红素水平<20 mg/dL,溶血血红蛋白<500 mg/dL、乳糜微粒<2 000 FTU时,对血清KL-6检测的影响均<10%,可以接受。
4 结 论
综上所述,本文验证了日本积水血清KL-6试剂盒在罗氏MODULAR P800全自动生化分析仪上检测性能符合试剂说明书声明的要求,可以应用于实验室的临床检测。本研究中采用的评价方法,对广大基层实验室工作人员也具有一定参考意义。
