应用佛尔哈德法测定酱油中氯化钠的含量
2019-11-27
(1.朔州师范高等专科学校,山西 朔州 036002;2.山西大同大学,山西 大同 037009)
在日常生活中,要做出美味可口的佳肴,酱油是一种不可或缺的调味品。现代科学分析表明,酱油中含有多种化学成分,酱油含有18种以上的氨基酸,其中包括人体所需的8种“必需氨基酸”;还含有糖分、维生素B1、维生素B2及锌、钙、铁、锰等多种微量元素[1];除此之外氯化钠也是酱油的重要组成。
为提高酱油的产品质量及对人体的保健作用,酱油中氯化钠的含量必须控制在适当范围内。为此,国家出台过一系列标准指导酱油中氯化钠的含量,一般要求其含量处于15-20g/100mL之间。目前执行的是GB18186-2000标准,标准中氯化钠指标不低于15 g/100mL。
酱油中氯化钠指标定为不低于15 g/100mL,其目的:一是保证一定条件下抑制杂菌的能力;二是符合传统消费习惯,主要是烹调使用习惯;三是服从工艺的需要[2]。
我国制定了测定酱油中氯化钠的含量的标准。该方法是以硝酸银为标准溶液(按GB/T601规定的方法配制和标定)滴定样品溶液,铬酸钾作指示剂,滴定终点时溶液由无色变成桔红色(须在白色瓷砖观察)[3]。该方法终点比较明显,能识别,且操作简单,测试速度快。但由于无色与桔红色差异区间较大,容易出现终点现象明显滞后引起测量误差较大,最终导致测量结果偏差较大。
本实验过程分两部分。一是对硝酸银标准溶液和硫氰酸铵标准溶液进行标定时采用的是莫尔法,该实验没有酱油颜色的干扰,对硝酸银标准溶液和硫氰酸铵标准溶液的浓度进行一一标定[4-5];二是对酱油中氯化钠含量进行测定时采用佛尔哈德法中的返滴定法,该方法是先向试液中加入已知过量的AgNO3标准溶液,使Cl-定量生成银盐沉淀后,再加入铁铵矾指示剂,用NH4SCN标准滴定溶液返滴定剩余的Ag+,克服了测定过程中终点反应不明显带来的误差[6]。且该方法使用的有机溶剂较少,对环境污染小,仪器简单易得,操作简便。
一、实验原理及计算公式
(一)硝酸银标准溶液的浓度标定和计算公式
1.标定原理
标定硝酸银标准溶液采用莫尔法,即以氯化钠为基准物质,铬酸钾为指示剂,滴定过程中生成白色沉淀,滴定终点时有铬酸银砖红色沉淀生成,此时溶液微呈砖红色[7]。反应式如下:
Ag++Cl-= AgCl↓ (白色)
2Ag++CrO42+=Ag2CrO4↓(砖红色)
2.计算公式
(2-1)
(二)硫氰酸铵标准溶液的浓度标定和计算公式
1.标定原理
标定硫氰酸铵标准溶液采用莫尔法,即以硝酸银为标准溶液,铁铵矾作指示剂进行标定,滴定过程中生成白色沉淀,滴定终点时溶液由无色变成淡红色[8]。反应式如下:
Ag++SCN-=AgSCN ↓ (白色)
Fe3++SCN-=FeSCN2+(红色)
2.计算公式
(2-2)
(三)酱油中氯化钠含量的测定原理和计算公式
1.测定原理
酱油中氯化钠含量的测定用佛尔哈德法中的返滴定法,即:加入过量的硝酸银标准溶液使与酱油中的氯化钠作用,生成白色的氯化银沉淀,剩余的硝酸银用硫氰酸铵标准溶液返回滴定,反应用铁铵矾作指示剂,滴定终点时溶液由无色变成红色。反应式如下:
Ag++Cl-=AgCl ↓ (白色)
Ag+(过量)+SCN-=AgSCN ↓ (白色)
Fe3++SCN-=FeSCN2+(红色)
2.计算公式
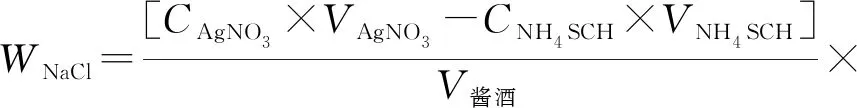
(2-3)
二、实验部分
(一)实验试剂
浓硝酸,6mol·L-1硝酸溶液,5%铬酸钾指示剂,硝基苯,NaCl基准物质(S),0.02mol·L-1NH4SCN标准溶液,0.02mol·L-1AgNO3标准溶液,8%铁铵矾指示剂。
8%铁铵矾指示剂的配制:称取8.0g硫酸铁铵于150mL烧杯中,加少许水溶解,滴加浓硝酸至溶液几乎无色,用水稀释至100 mL,装入100mL滴瓶中,贴好标签。
氯化钠基准物质溶液的配制:
准确称取0.25~0.30g固体基准物质氯化钠(在500~600 ℃灼烧至恒重)于烧杯中,加适量水溶解,定量转移到250mL容量瓶中,稀释至刻度、摇匀。实验称得的氯化钠基准物质的质量是0.2933g。
(二)实验主要仪器
电子分析天平(HANGPING FA2004,上海必能信超声有限公司)。
控温电热套(KDM型,山东鄄城新华仪器厂)。
容量瓶,滴定管,锥形瓶。
(三)测试样品
1号样品 淡盐头道酱油;
2号样品 味极鲜酱油;
3号样品 一品鲜酱油;
4号样品 金标生抽;
5号样品 老抽。
注:以上样均购自超市,标准GB18186—2000,高盐稀态,厂家忽略。
配制:准确移取1-5号样品各5.00mL,定量移入250mL容量瓶中,加蒸馏水稀释至刻度,摇匀,待测定。
三、结果与讨论
(一)0.02mol/L硝酸银标准溶液的标定
用移液管准确移取25.00mL氯化钠基准物质溶液于250mL锥形瓶中,加5mL 6mol·L-1HNO3溶液,0.5mL 5%铬酸钾指示剂,在剧烈振荡下,用AgNO3标准溶液滴定,直至溶液微呈砖红色并继续剧烈振荡不再消失为止,记录消耗AgNO3标准溶液的体积。重复测定三次,结果如表1所示。
据表1所示数据,由2-1式计算,结果表明:AgNO3标准溶液的浓度为0.02704mol·L-1,其标准偏差为0.00003,相对标准偏差为0.11%,相对平均偏差为0.08%,可见,精密度好,实验数据可靠。
(二)0.02mol/L硫氰酸铵标准溶液的标定
用移液管准确移取20.00mL 0.02704 mol·L-1AgNO3标准溶液于250mL锥形瓶中,加5mL 6mol·L-1HNO3溶液,1mL 8%铁铵矾指示剂,在剧烈振荡下,用NH4SCN标准溶液滴定,直至溶液变为淡红色并继续在轻微振荡下红色不再消失为终点,记录消耗NH4SCN标准溶液的体积。重复测定三次,结果如表2所示。

表1 硝酸银标准溶液浓度的标定
注:标准偏差用SD表示,相对标准偏差用RSD表示,相对平均偏差用AARD表示。

表2 硫氰酸铵标准溶液浓度的标定
据表2所示数据,由2-2式计算,结果表明:NH4SCN标准滴定溶液的浓度为0.02603mol·L-1,标准偏差为0.00004,相对标准偏差为0.14%,相对平均偏差为0.10%,可见,精密度好,实验数据可靠。
(三)酱油中氯化钠含量的测定
用移液管准确移取酱油样品稀释液10.00mL置于250mL锥形瓶中,加入50mL蒸馏水,加15mL6mol·L-1HNO3溶液,再由移液管准确移取25.00mL 0.02704mol·L-1AgNO3标准溶液,加硝基苯5mL,用力振荡摇匀。待AgCl沉淀凝聚后,加入8%铁铵矾指示剂5mL,用0.02603mol·L-1NH4SCN标准滴定溶液滴定至血红色终点。记录消耗NH4SCN标准滴定溶液的体积。每个样品重复测定三次,结果如表3所示。
由表3中数据,由2-3式进行计算。结果表明:
(1)实验所测数据相对标准偏差和相对平均偏差分别为0.13%、0.07%、0.07%、0.02%、0.06%和0.09%、0.05%、0.05%、0.02%、0.04%,可见,其精密度较好,实验数据可靠,实验方法可行。

表3 酱油中氯化钠含量
(2)从酱油中氯化钠的含量来看,除特制淡盐头道酱油(11.7056g/100mL)外,其余普通酱油均处于15-20g/100mL之间,且老抽高于生抽,与酱油生产过程及工艺相一致。
四、结论
酱油中氯化钠含量的高低直接影响消费者的身体健康,提醒人们烹饪时不要忽略酱油中的食盐。本实验采用佛尔哈德法中的返滴定法测定酱油中氯化钠含量。从酱油中氯化钠的含量来看,除特制淡盐头道酱油为11.7056g/100mL外,其余样品含量分别为:老抽19.4003g/100mL,金标生抽18.0135g/100mL,一品鲜酱油16.8067g/100mL,味极鲜酱油16.2261g/100mL,均处于15-20g/100mL之间,与酱油生产过程及工艺相一致。此方法操作简单快速、终点的辨识相对较容易,实验精密度好、准确度高,可用于成品检验。
