锌离子在缺血预处理保护机制中的作用
2019-11-27温凌娜田增有张春来周洪霞习瑾昆
温凌娜,田增有,张春来,周洪霞,习瑾昆
随着溶栓疗法、冠状动脉支架置入术等在心肌梗死治疗上的广泛应用,缺血再灌注(I/R)损伤越来越受到关注。1986 年,Murry 等[1]首次提出缺血预处理(IPC),发现IPC 可保护心肌免受I/R 损伤。Stokfisz 等[2]阐明了IPC 可能通过一氧化氮(NO)和一氧化氮合酶为中心的途径、再灌注损伤补救激酶(RISK)途径和生存活化因子增强(SAFE)途径等保护心肌。近期研究表明,IPC 可减少心肌I/R 诱导的细胞凋亡[3]。
锌离子是细胞正常结构和功能的基础[4],其失调与许多心血管疾病的发病机制有关[5]。锌离子可通过调节几种重要蛋白激酶的活性在细胞信号传导中起重要作用,如通过激活RISK 信号通路发挥心脏保护作用[6]。近期研究发现,瑞芬太尼通过减轻内质网应激起到心脏保护作用,而锌离子可能参与了这一过程[7]。Wang 等[8]研究表明锌离子可通过调节线粒体通透性转换孔(mPTP)的开放参与内质网应激(ERS),使心肌免受I/R 损伤。据报道,再灌注时细胞锌离子浓度会降低[6]。本研究探索IPC 是否能通过防止再灌注时的锌离子损失来保护心脏。
1 材料与方法
实验动物及分组:50 只健康雄性Wistar 大鼠,每只重250~350 g,由北京华阜康生物科技股份有限公司提供,实验动物使用许可证号:SCXK(京)2014-0004。大鼠被随机分为五组:假手术组(对照组)、I/R 组、I/R+IPC 组、I/R+IPC+锌离子抑制剂(TPEN)组、I/R+TPEN 组,每组10 只。
主要材料与试剂:锌离子检测试剂盒(南京建成生物工程研究所);抗核因子E2 相关因子2(Nrf2)抗体、抗磷酸化蛋白激酶样内质网激酶(p-PERK)抗体,均购自英国abcam 公司;辣根过氧化物酶标记山羊抗兔免疫球蛋白G 抗体(Cell Signaling Technology 公司,美国);末端脱氧核苷基转移酶介导的dUTP 原位末端标记(TUNEL)凋亡检测试剂盒(罗氏公司,美国);TPEN(Sigma 公司,美国)。
仪器:Langendorff 体外心脏灌流系统、数据采集分析系统(成都仪器厂);电泳及湿转系统(北京六一仪器厂);Multiskan FC 型酶标仪[赛默飞世尔(上海)仪器有限公司]、Tanon-5200 生物图像采集系统(Tanon 公司,中国);BX53 荧光正置显微镜(Olympus 公司,日本)。
离体大鼠心脏I/R 模型的建立:Lengandorff 系统建立大鼠心肌I/R 模型。配置Krebs-Henseleit(K-H)缓冲液(pH=7.4)加到灌流装置内,在37℃下,95%氧气、5%二氧化碳充气30 min。将大鼠用10%水合氯醛腹腔注射麻醉后,开胸取出心脏,立即放入盛有4℃生理盐水的平皿内,冲掉残留血液,迅速悬挂于Langendorff 灌流装置上,行主动脉逆行灌流。在左前降支周围放置5-0 丝线缝合线,并将缝合线的末端穿过一小片柔软的乙烯管以形成圈套。通过拉动圈套,用小止血钳夹紧管道来固定,以诱导缺血。再灌注时,松开小止血钳。对照组只悬线不结扎血管。I/R+IPC 组在缺血30 min 前给予3 轮5 min 缺血/5 min 再灌注。TPEN(10 μmol)在IPC 或缺血30 min的前5 min 给予。所有心脏稳定至少20 min。
锌离子水平测定[9-10]:提取心肌组织蛋白,按照锌离子检测试剂盒说明书操作,检测各组锌离子水平。
心肌梗死面积测定:再灌注达120 min 时,永久性结扎冠状动脉,由主动脉逆行注入2%伊文斯兰以显示危险区。取下心脏,放入-80℃冰箱冻存30 min,取出冷冻的心脏,快速切成厚度约1 mm 的心脏组织切片,置于1%三苯基氯化四唑(TTC)磷酸盐缓冲液中(pH=7.4),37℃恒温孵育20 min 后取出,浸入10%的福尔马林溶液10 min,以提高染色和非染色组织的对比度。此时,在危险区,未被TTC 染色的区域(白色)被确认为梗死区域。将心脏组织切片放在两块玻璃板中间并压平,放上横尺作为标尺,拍照,使用Image-J 软件量化。通过公式“心肌梗死面积百分比(%)=梗死区/危险区×100%”,进行心脏梗死区面积百分比的测定。
苏木素-伊红(HE)染色观察形态学改变:心肌组织在4%多聚甲醛溶液中固定24 h,流动水冲洗24 h。依次过梯度酒精、醇苯混合液、二甲苯,浸蜡,60℃~62℃烤箱中过夜,包埋,切片,60℃烤箱中烘烤30 min,二甲苯脱蜡、梯度酒精及水化,苏木素染色3 min,水洗。盐酸酒精分化10 s,用1%氨水蓝化1 min,水洗。伊红染色3 min,依次梯度酒精脱水、二甲苯透明。中性树胶封片,显微镜下观察并拍片。
蛋白免疫印迹实验检测Nrf2、p-PERK 表达:提取心肌组织总蛋白,用BCA 试剂盒蛋白定量[11]。以80 μg 蛋白上样,电泳并转膜。10%脱脂奶粉室温封闭30~60 min,p-PERK(1:500 一抗稀释液稀释)、Nrf2 抗体(1:1 000)4℃孵育过夜杂交。辣根过氧化物酶标记的二抗(1:2 000 0.1%的TBST 稀释)室温孵育1 h,用增强化学发光(ECL)试剂盒荧光显色。β 肌动蛋白(β-actin)抗体为内参。Image J 图像分析软件对条带进行灰度扫描及定量分析。
TUNEL 法检测细胞凋亡情况[12]:制备心肌组织切片,常规脱蜡脱水,用蛋白酶K(20 μg/ml 溶于Tris/HCl 中,pH 7.4~8.0)室温孵育15~30 min,PBS(主要成分:NaCl、Na2HPO4·12H2O、KCl、KH2PO4,浓度10 mmol,pH 7.4)冲洗,滴加50 μl 的TUNEL 反应混合溶液,在湿盒中37℃孵育60 min,PBS 冲洗,加入50 μl 转化剂-POD,在湿盒中37℃孵育30 min,PBS 冲洗,加入50~100 μl 二氨基联苯胺(DAB)底物溶液,室温孵育10 min,PBS 冲洗。苏木素复染,封片,显微镜观察并拍片。
实验步骤:离体心脏灌流,稳定20 min,缺血30 min,再灌注120 min。IPC 组在缺血前进行3 轮5 min 缺血/5 min 再灌注。取左心室危险区组织进行指标检测。取再灌注30 min 的心肌组织进行锌离子浓度测定及蛋白免疫印迹实验检测。取再灌注120 min 的心肌组织,进行HE 染色及TUNEL 细胞凋亡检测。再灌注120 min 测量心肌梗死面积百分比。
统计学方法:采用SPSS 17.0 统计软件进行数据处理,符合正态分布的数据用表示。显著性检验采用完全随机设计的单因素方差分析(one-way ANOVA)。P<0.05 为差异有统计学意义。
2 结果
各组大鼠心肌组织内锌离子水平比较(图1):与对照组相比,I/R 组大鼠在心脏再灌注后心肌组织内锌离子水平显著降低;而与I/R 组相比,I/R+IPC组大鼠心脏再灌注后心肌组织内锌离子水平升高。上述各组间差异均有统计学意义(P均<0.05)。

图1 各组大鼠心肌锌离子水平比较(n=5,±s)
各组大鼠心肌梗死面积比较(图2):与对照组相比,I/R 组大鼠心肌梗死面积显著增加;与I/R 组相比,I/R+IPC 组大鼠心肌梗死面积减小;与I/R+IPC 组相比,I/R+IPC+TPEN 组大鼠心肌梗死面积又显著增加。上述各组间差异均有统计学意义(P均<0.05)。
各组大鼠心肌组织形态学比较(图3):对照组大鼠心肌纤维排列整齐,无断裂,胞质和胞核清晰,无炎细胞浸润。与对照组相比,I/R 组大鼠心肌纤维排列紊乱、断裂,间隙增宽。与I/R 组相比,I/R+IPC 组大鼠心肌纤维排列相对整齐,间隙相对紧密,断裂相对较少。与I/R+IPC 组相比,I/R+IPC+TPEN 组大鼠心肌纤维排列紊乱,间隙显著增宽,断裂明显增加。

图2 各组大鼠心肌梗死面积比较(n=5,±s)
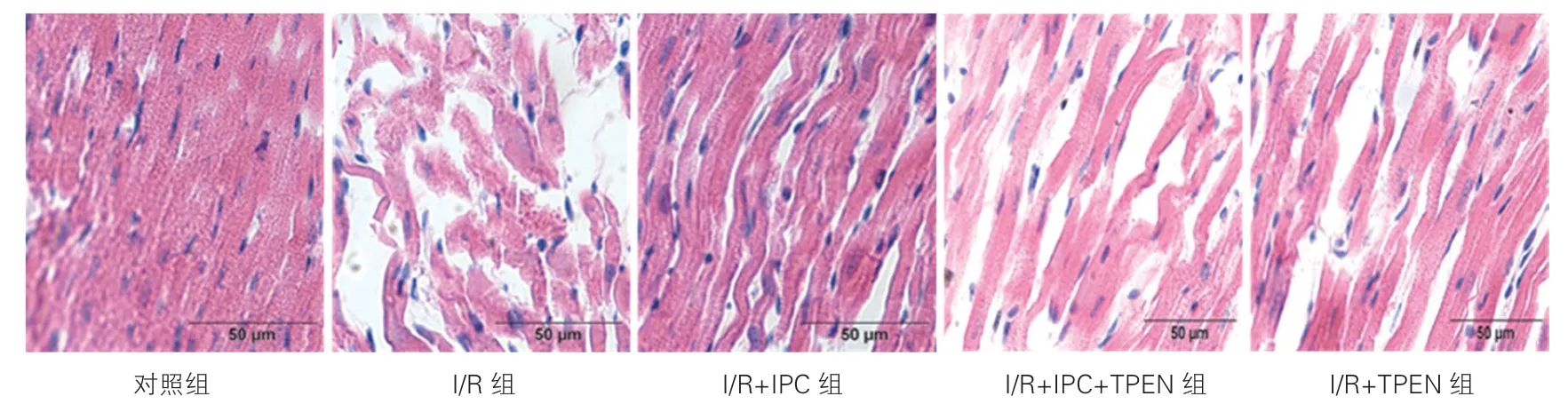
图3 各组大鼠心肌苏木素-伊红染色结果(×40)
各组大鼠心肌组织中p-PERK、Nrf2 蛋白表达水平比较(图4):与对照组相比,I/R 组大鼠心肌组织中p-PERK、Nrf2 两种蛋白的表达水平均显著升高;与I/R 组相比,I/R+IPC 组大鼠心肌组织中上述两种蛋白的表达水平显著降低;与I/R+IPC 组相比,I/R+IPC+TPEN组大鼠心肌组织中上述两种蛋白的表达水平明显升高;上述各组间差异均有统计学意义(P均<0.05)。
各组大鼠心肌细胞凋亡情况比较:I/R 组大鼠心肌凋亡细胞明显多于对照组;而与I/R 组相比,I/R+IPC 组大鼠心肌凋亡细胞减少;加入TPEN后,心肌凋亡细胞又明显增多(图5)。与对照组相比,I/R 组大鼠心肌细胞凋亡指数(AI)显著增加[(35.80±5.31)% vs(5.80±2.86)%];I/R+IPC 组 大鼠心肌细胞AI 显著低于I/R 组[(16.20±4.82)% vs(35.80±5.31)%];与I/R+IPC 组相比,I/R+IPC+TPEN组大鼠心肌细胞AI 明显升高[(32.60±6.03)% vs(16.20±4.82)%];以上组间差异均有统计学意义(P均<0.05)。

图4 各组大鼠心肌组织中p-PERK、Nrf2 蛋白表达水平比较(n=5,±s)

图5 各组大鼠TUNEL 法检测到的心肌细胞凋亡情况(×40)
3 讨论
锌离子是细胞质、囊泡、细胞器以及细胞核中最丰富的细胞内金属离子[13]。锌离子参与人体细胞代谢过程,可直接调节激酶、磷酸酶活性。据报道,补充锌离子可降低动脉粥样硬化的风险,并可预防心肌梗死和I/R 损伤[14]。既往研究发现,IPC 可能通过激活NO 系统保护心脏[15];同时,NO 可能在再灌注时通过提高锌离子水平保护心脏[16]。为探讨锌离子是否参与IPC 的保护机制,本研究对实验大鼠的心肌组织进行锌离子水平检测。结果显示,与对照组相比,I/R 组大鼠心肌组织中锌离子水平显著降低,表明I/R 导致组织内锌离子流失;与I/R 组相比,IPC 后大鼠心肌组织内锌离子水平明显增加,说明IPC 可能通过防止锌离子流失发挥保护作用。
IPC 是一种内源性保护现象[17]。有研究发现,IPC 可能通过蛋白激酶样内质网应激酶(PERK)途径减弱ERS 诱导的细胞凋亡,保护大脑免受I/R 损伤[18]。Nrf2 是PERK 的下游底物,PERK 可通过激活Nrf2,增加C/EBP 同源蛋白(CHOP)的表达,进而使抑凋亡因子Bcl2 蛋白表达下调、促凋亡因子Bax 蛋白表达上调,引起细胞凋亡[19-20]。在本研究中,与I/R 组相比,I/R+IPC 组大鼠心肌梗死面积比显著降低,心肌纤维排列相对紧密、断裂减少,p-PERK、Nrf2 蛋白表达显著减少,说明IPC 可能通过抑制PERK/Nrf2 通路减轻I/R 损伤、保护心肌;加入TPEN 后,心肌梗死面积比显著升高,心肌纤维排列疏松、断裂较多,p-PERK、Nrf2 蛋白表达显著增多,凋亡细胞明显增多;而与I/R 组相比,I/R+TPEN 组上述结果无明显统计学差异,说明TPEN 抑制IPC 的保护作用,而TPEN 为锌离子抑制剂,说明锌离子参与IPC 的这一保护作用。
既往研究表明,如果患者在心肌梗死前先出现心绞痛,可被认为是IPC 的一种形式,此类患者出现急性心肌梗死时,溶栓治疗后的心肌梗死面积较梗死前无心绞痛者更小[21]。临床上通过运动训练诱导心肌缺血预适应可保护心脏。最新研究发现,来自IPC 的微泡可以通过减弱ERS 诱导的细胞凋亡来保护心脏免受I/R 损伤[22],为临床治疗目标提供了新的见解。因此,进一步了解IPC 在I/R 损伤中的保护机制,可能为临床治疗提供了新的证据。
锌离子代谢的失调与许多心血管病(CVD)有关。低锌血症和锌转运蛋白异常与动脉粥样硬化和微血管疾病有关。现有证据支持血管壁中存在锌离子调节途径,其与NO 的产生和作用相关,从而对血管疾病的发病机理和治疗产生影响[23]。既往研究发现,血清锌离子水平与血清肌酸激酶、肌酸激酶同工酶和心肌肌钙蛋白T 水平呈显著负相关,急性心肌梗死的患病率随血清锌离子浓度的增加而降低[24]。锌离子还可以减轻心肌梗死后大鼠的心脏重构[25]。如果在CVD 早期发现细胞内锌离子稳态的改变,则可能通过尽早干预锌离子水平来改善CVD 患者预后。
总之,IPC 可能通过锌离子抑制PERK/Nrf2 通路而发挥心肌保护作用,进一步了解其作用机制有助于临床预防和减少心肌I/R 损伤,从而改善患者预后。
