养殖花鳗鲡鱼皮胶原蛋白的特性分析
2019-11-27卢珍华郭彩华陈昭华翁武银江兴龙
卢珍华,郭彩华,叶 鹏,陈昭华,翁武银,江兴龙
(1.集美大学食品与生物工程学院,福建厦门 361021;2.厦门出入境检验检疫局检验 检疫技术中心,福建厦门 361026;3.集美大学水产学院,福建厦门 361021)
花鳗鲡(Anguillamarmorata)属鳗鲡目鳗鲡科鳗鲡属,又称芦鳗、雪鳗。目前,花鳗鲡的研究主要集中在花鳗鲡的基础生物学特征,养殖技术,花鳗鲡的营养成分及营养价值分析,从基因水平对花鳗鲡的研究等方面[1-5],而有关花鳗鲡鱼皮胶原蛋白的研究却未见报道。本研究以养殖花鳗鲡为原料,从鱼皮中提取胶原蛋白,分析胶原蛋白的理化性质及体外自组装动力学特性,为花鳗鲡胶原蛋白在功能性食品、化妆品和生物医学材料等领域中的潜在应用提供基础数据。
1 材料与方法
1.1 材料
花鳗鲡由集美大学鳗鲡现代产业技术教育部工程研究中心合作的福建龙岩市某养殖场提供。取样时间2017年4—6月,共采集花鳗鲡样品6尾,平均个体重量(1 960±50)g,体长(85.4±2.6)cm。
十二烷基磺酸钠(SDS)、丙烯酰胺、DC蛋白试剂盒为美国Bio-Rad公司产品;蛋白质相对分子质量标准为加拿大Fermentas公司产品;氨基酸标准溶液为安捷伦科技(中国)有限公司产品;乙腈、甲醇(HPLC级)为美国INC公司产品;三氟乙酸(HPLC级)为美国Amresco公司产品;磷酸盐和胃蛋白酶(1 200 U/g)购于国药集团化学试剂有限公司;三羟甲基氨基甲烷(Tris)、考马斯亮蓝R-250为国产生物试剂;其余试剂为国产分析纯。
1.2 仪器与设备
Avanti J-25高速冷冻离心机(美国Beckman公司);FD-1A-50真空冷冻干燥机(北京博医康实验仪器有限公司);Mini-PⅢ垂直电泳槽(美国Bio-Rad公司);G:Box凝胶成像仪(英国Syngene公司);L-8900高效氨基酸分析仪(日本HITACHI公司);UV-2600A紫外分光光度计(上海元析仪器有限公司);Nicolet iS10傅里叶红外变化光谱仪(美国Thermo公司);FE20K pH计(梅特勒-托利多仪器有限公司);乌氏粘度计(上海玻璃仪器一厂);E-1010离子溅射仪、S-4800电子扫描显微镜(日本东京日立制造所);DHR流变仪(美国TA公司)。
1.3 方法
1.3.1 胶原蛋白提取
参考Tang等[6]的方法在4 ℃下提取花鳗鲡鱼皮胶原蛋白。花鳗鲡鱼皮先利用0.1 mol/L NaOH浸泡36 h后,用冰水漂洗至中性,再利用10%(V/V)的正丁醇溶液浸泡24 h,冰水漂洗,再用25%(V/V)乙醇浸泡24 h,冰水漂洗后,以1∶30(W/V)的比例将鱼皮浸泡于含1%(W/V)胃蛋白酶的0.5 mol/L 乙酸溶液中浸提3 d。浸提液通过离心(15 000g,20 min),获得的上清液利用透析袋(10 kDa)和0.02 mol/L pH7.4的磷酸盐缓冲液透析48 h,再用0.5 mol/L乙酸溶解,加入终浓度为2.3 mol/L NaCl使胶原盐析沉淀,通过离心(15 000g,20 min)收集沉淀,再用0.5 mol/L乙酸溶解沉淀,分别利用0.1 mol/L乙酸和蒸馏水进行透析,通过冷冻干燥获得白色、蓬松、海绵状的花鳗鲡鱼皮胶原蛋白,-30 ℃储存备用。
1.3.2 胶原蛋白理化性质研究
1.3.2.1 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分析
参考Laemmli[7]报道的方法进行SDS-PAGE(sodium dodecyl sulfonate-polyacrylamide gel electrophoresis)电泳。冻干的花鳗鲡鱼皮胶原蛋白利用蛋白质变性剂[20 mmol/L Tris-HCl、8 mol/L 尿素、2%(W/V)SDS,pH 8.8]溶解,15 000g离心20 min收集上清液,用Lowry等[8]的方法测定蛋白含量。
所用的浓缩胶和分离胶的浓度分别为4%(W/V)和6%(W/V),上胶样品的蛋白浓度为1 mg/mL,采用恒流电泳,电流8 mA。电泳后的凝胶,先用0.025%(W/V)考马斯亮蓝R-250染色液染色,再用脱色液(由甲醇∶乙酸∶重蒸水=1∶3∶7混合而成)脱色至背景清晰,利用G:Box凝胶成像仪拍照。电泳所用的标准蛋白质相对分子质量10 000~200 000。
1.3.2.2 氨基酸组成
花鳗鲡鱼皮胶原蛋白的氨基酸组成利用L-8900高效氨基酸分析仪测定。称取适量冻干鱼皮胶原蛋白于消化管中,加入含0.1%(W/V)苯酚的6 mol/L HCl溶液,抽真空充氮气密封,在110 ℃条件下水解22 h。酸水解后,利用旋转蒸发器在60 ℃下旋转蒸发除盐酸,残留物溶解在0.02 mol/L HCl中,过0.22 μm水系滤膜,用氨基酸自动分析仪测定酸水解液中氨基酸的组分。氨基酸含量以外标法确定。参照文献[6],氨基酸组成采用每1 000个氨基酸残基中某种氨基酸残基数表示,形式为平均值±标准偏差。
1.3.2.3 紫外吸收光谱
取适量冻干花鳗鲡鱼皮胶原蛋白溶于0.1 mol/L乙酸溶液中,调配成浓度为1 mg/mL的鱼皮胶原蛋白溶液。以0.1 mol/L乙酸溶液作为空白对照液,利用UV-2600A紫外分光光度计在200~400 nm紫外区段对1 mg/mL的鱼皮胶原蛋白溶液进行扫描。
1.3.2.4 傅里叶变换红外光谱
花鳗鲡鱼皮胶原蛋白的傅里叶变换红外光谱分析,利用Nicolet iS10傅里叶红外变化光谱仪在室温下实施。分别称取1 mg冻干的花鳗鲡鱼皮胶原蛋白和100 mg溴化钾(KBr),混合后充分研磨,研磨好的粉末置于压片机中压成透明薄片。以溴化钾薄片为空白对照。扫描波数取4000~400 cm-1,光谱分辨率设定为4 cm-1,扫描32次。
1.3.2.5 粘度和热变性分析
借鉴Nagai等[9]的方法并做一定的修改后测定花鳗鲡鱼皮胶原蛋白的粘度。冻干的鱼皮胶原蛋白用0.1 mol/L乙酸溶液溶解成1%(W/V)的胶原蛋白溶液,在10~45 ℃下测定花鳗鲡鱼皮胶原蛋白通过毛细管所需的时间,每个温度点的重复测定次数是5次。特性粘度ηsp按公式(1)计算,比浓粘度ηre按公式(2)的计算。
(1)
(2)
式中:t为花鳗鲡鱼皮胶原蛋白溶液通过毛细管所需的时间,t0为0.1 mol/L乙酸溶液通过毛细管所需的时间;c为1%(W/V)。比浓粘度ηre用L表示,即单位浓度下单个分子对溶液粘度的贡献。
以温度为横坐标,比浓粘度ηre为纵坐标,做花鳗鲡鱼皮胶原蛋白的热变性曲线。当比浓粘度ηre为最大比浓粘度一半时所对应的温度就是花鳗鲡鱼皮胶原蛋白的热变性温度,用Td(thermal denaturation)表示。
1.3.3 胶原蛋白自组装特性
根据Zhang等[10]报道的方法,将冻干的鱼皮胶原蛋白溶于0.1 mol/L乙酸溶液中,配制成浓度为1 mg/mL的胶原蛋白溶液,然后放在pH 7.2缓冲液(0.15 mol/L NaCl、0.1 mol/L Na2HPO4和0.1 mol/L 柠檬酸)进行透析24 h。透析好的胶原溶液放在水浴25 ℃下保温使胶原自组装形成纤维。
1.3.3.1 浊度
在胶原自组装过程中,利用UV-2600A紫外分光光度计间隔2 min测花鳗鲡鱼皮胶原蛋白在313 nm处的动态吸光值,绘制浊度曲线。
1.3.3.2 扫描电镜观察
将自组装形成的胶原胶体置于pH 7.4含2.5%(V/V)戊二醛的0.1 mol/L 磷酸盐缓冲液中固定1 d,用pH 7.4的0.1 mol/L 磷酸盐缓冲液漂洗后,再利用不同浓度的乙醇(30%~100%,由低到高)梯度脱水,经CO2临界点干燥,E-1010离子溅射仪镀金处理,再用S-4800电子扫描显微镜观察拍照记录。
1.3.3.3 动态黏弹性
pH 7.2缓冲液透析完成的胶原蛋白溶液根据赵燕等[11]报道的方法测定该胶原蛋白溶液的弹性模量值(G’)和黏性模量值(G”),绘制黏弹模量随时间变化的曲线。测定条件:φ40 mm标准铝材质平板模具;控制间隙:1 mm;测定温度:25 ℃;扫描模式:时间扫描;扫描时长:90 min。形变率:1%;频率:1 Hz。
2 结果
2.1 SDS-PAGE凝胶电泳结果
花鳗鲡鱼皮经碱除杂蛋白、正丁醇脱脂、胃蛋白酶及乙酸抽提处理、透析和干燥后得到花鳗鲡鱼皮胶原蛋白。该胶原蛋白的SDS-聚丙烯酰胺凝胶电泳结果见图1。

图1 花鳗鲡鱼皮胶原蛋白SDS-PAGE图谱Fig.1 SDS-PAGE patterns of the collagen from A.marmorata skins M:标准蛋白;C:花鳗鲡鱼皮胶原蛋白
在SDS-PAGE图谱中,花鳗鲡鱼皮胶原蛋白至少有5条条带出现,分别为α1、α2、α3、β和γ。α1的分子量约为118 kDa;α2的分子量比α1的小,其条带也比α1浅,表明α1是花鳗鲡鱼皮胶原蛋白的主要成分;有α3肽链存在,分子量比α1的小比α2的大。β条带的分子量在200 kDa以上,推测认为是α1链的二聚体;α3和γ的浓度值均低。根据SDS-PAGE结果,认为花鳗鲡鱼皮胶原蛋白属于Ⅰ型胶原蛋白,标记为[α1(I)]2α2(Ⅰ)。
2.2 花鳗鲡鱼皮胶原蛋白的氨基酸组成
花鳗鲡鱼皮胶原蛋白经酸水解后得到的氨基酸组成如表1。由表1可见,花鳗鲡鱼皮胶原蛋白含有丰富的Gly,约占总氨基酸数的1/3,Pro含量为11.2%,Hyp含量为7.67%,三者的比值约为8∶3∶2,符合胶原蛋白的氨基酸组成特点。胶原蛋白中占比大的氨基酸依次是Gly、Ala、Hyr、Glu和Pro,含量最小的是胱氨酸,没有检测到羟赖氨酸。

表1 花鳗鲡鱼皮胶原蛋白氨基酸组成Tab.1 Amino acid compositions of collagen from A.marmorata skins ‰
2.3 紫外吸收光谱特性
紫外光谱的作用主要是考察研究对象中是否存在共轭体系。花鳗鲡鱼皮胶原蛋白的紫外吸收光谱图见图2。从图2可以看到,花鳗鲡鱼皮胶原蛋白在200~400 nm紫外区段有吸收峰,说明该胶原蛋白分子中存在共轭体系,其最大吸收波长为222.6 nm。
2.4 傅里叶变换红外光谱特性
红外光谱能测定有机化合物在红外区域波长的光照射下的吸收情况,有机物中不同的基团在不同波长处有特征的吸收峰,所以借助于红外光谱的测定,通过分析红外谱图中波数4 000~1 300 cm-1区域中的吸收峰,可以推测该化合物中存在哪些官能团。花鳗鲡鱼皮胶原蛋白的傅里叶红外光谱图见图3。

图2 花鳗鲡鱼皮胶原蛋白的紫外吸收光谱Fig.2 UV absorption spectra of collagen from A.marmorata skins

图3 花鳗鲡鱼皮胶原蛋白的傅里叶红外光谱Fig.3 Fourier transform infrared spectra of collagen from A.marmorata skins
根据图3,该胶原蛋白的红外光谱特征吸收峰为酰胺A、B、Ⅰ、Ⅱ和Ⅲ。酰胺A的吸收峰在3 307 cm-1处,酰胺B的吸收峰在2 930 cm-1处,酰胺I的吸收峰在1 652 cm-1处,酰胺Ⅱ的吸收峰在1 548 cm-1处,酰胺Ⅲ的吸收峰在1 238 cm-1处。酰胺Ⅰ、Ⅱ和Ⅲ吸收峰的存在说明所提取的花鳗鲡胶原蛋白的二级结构和三级结构均没有被破坏。所提取的花鳗鲡胶原蛋白是经胃蛋白酶处理酸溶得到的胶原蛋白,傅里叶红外光谱结果表明胶原蛋白经胃蛋白酶处理后三股螺旋结构还存在。
2.5 粘度和热变性特性
花鳗鲡鱼皮胶原蛋白的比浓粘度ηre值随温度上升的变化趋势见图4。温度值在25 ℃之前比浓粘度ηre值变化小,可视作是稳定态;25~35 ℃比浓粘度ηre值急剧下降;当温度值达35 ℃时比浓粘度ηre值就很小了,35~45 ℃变化不大。

图4 花鳗鲡鱼皮胶原蛋白的热变性曲线Fig.4 Thermal denaturation curve of collagen from A.marmorata skins
根据图4花鳗鲡鱼皮胶原蛋白的热变性曲线,可以获得Td为28 ℃,这表示花鳗鲡鱼皮胶原蛋白三股螺旋结构在超过28 ℃后螺旋的稳定性会下降。
2.6 体外自组装动力学特性
花鳗鲡鱼皮胶原蛋白的浊度测定结果见图5。通过分析该浊度-时间曲线,可以发现该胶原蛋白的纤维形成过程的特点是:在25 ℃下保温的前6 min内,浊度值变化小,酸溶性胶原蛋白ASC的A313 nm平均值为0.134,是成纤维过程的迟滞期;随后A313 nm值增加,10~20 min浊度值迅速上升,是成纤维过程的成长期;26 min后渐渐进入稳定态,34 min时进入成纤维的平稳期,ASC的A313 nm平均值为1.476。
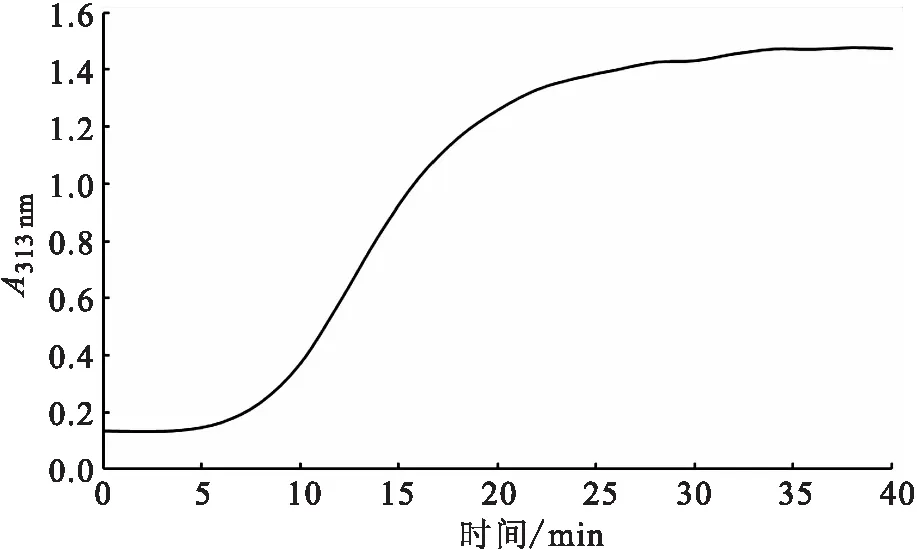
图5 花鳗鲡鱼皮胶原蛋白的浊度-时间曲线Fig.5 Turbidity-time curves of collagen from A.marmorata skins
花鳗鲡鱼皮胶原蛋白的动态黏弹性测定结果见图6。分析该流变弹性和黏性模量曲线,可以看出,随着组装时间的延长,胶原蛋白的模量(弹性模量和黏性模量)值展现出与浊度曲线相似的演变行为,即在组装初期,模量值较低,随后进入模量值的增长阶段并最终达到平衡。组装初期胶原溶液的黏性模量G”(loss modulus)大于弹性模量G’(storage modulus),这可以解释成此时的胶原是以液体状态存在,随着时间的延长,弹性模量G’的增加速率大于黏性模量G”,在大约7 min时,两者出现交汇点即凝胶点,交汇点弹性模量G’为0.091 Pa。之后弹性模量值快速上升,胶原分子有序地聚集形成凝胶纤维,经过约30 min的增长期后,花鳗鲡胶原蛋白形成胶原凝胶纤维的速度进入了稳定期,第一个平衡点(37 min)的弹性模量G’为62.64 Pa。

图6 花鳗鲡鱼皮胶原蛋白的流变弹性和黏性模量曲线Fig.6 The storage modulus(G’)and loss modulus(G”)for self-assembling of collagen from A.marmorata skins
2.7 花鳗鲡鱼皮胶原蛋白的微观结构
从图7可以发现,花鳗鲡胶原蛋白自组装后出现纤维结构,5 000倍和50 000倍的视野里,凝胶呈网状的交错条纹纤维结构。在100 000倍的视野里,通过SEM(scanning electron microscope)自带软件计算出花鳗鲡胶原凝胶纤维的直径主要集中在48.3~74.6 nm。
3 讨论
3.1 花鳗鲡鱼皮胶原蛋白SDS-PAGE凝胶电泳结果的解析
Weng等[14]在研究金鲳鱼鱼皮胶原蛋白的亚基结构特征时指出α1肽链的分子量比α2肽链的高,但等电点比α2肽链的低,而且鱼种间的氨基酸序列差异比α2肽链的更明显。Veeruraj等[12]认为海鳗鱼皮中有α3肽链存在,分子量比α1的小比α2的大;α3与α1以共同存在的形式出现,不易分离。朱圣庚等[15]认为Ⅰ型胶原蛋白是在骨、皮肤、腱和角膜中占优势的胶原蛋白,由2条相同的α1(Ⅰ)肽链和1条α2(Ⅰ)肽链构成。根据这些学者的观点,结合SDS-PAGE结果,认为推定花鳗鲡鱼皮胶原蛋白属于I型胶原蛋白是正确的。

图7 花鳗鲡鱼皮胶原蛋白纤维SEM图Fig.7 SEM pictures of collagen from A.marmorata skins
3.2 花鳗鲡鱼皮胶原蛋白氨基酸组成与其他鳗鱼皮胶原蛋白氨基酸组成的比较
与Veeruraj等[12]报道的提自海鳗鱼皮的酸溶性胶原蛋白(ASC)的氨基酸组成和鸿巢章二等[13]介绍的七鳃鳗胶原蛋白的氨基酸组成相比,胶原蛋白中占比最大的氨基酸有相似性,如Gly、Ala、Hyr、Pro;但含量较少的氨基酸有一些差异,如七鳃鳗中没有检测到胱氨酸,而花鳗鲡胶原蛋白中检测出有胱氨酸,海鳗ASC中检测出有半胱氨酸(Cys)。温慧芳等[16]在研究不同提取方法提取所得到鮰鱼皮胶原蛋白氨基酸组成时发现,酸溶性胶原蛋白和酶溶性胶原蛋白的1 000个氨基酸残基中分别小于0.1个和0.5个Cys。而张强等[17]在研究鲢鱼皮胶原蛋白的提取方法时,不论是酸法或是酶法或是热水浸提法提取的鲢鱼皮胶原蛋白均没有检测到Cys。由此可见不同来源不同方法提取的胶原蛋白是否有Cys,是一个值得探究的问题。
3.3 花鳗鲡鱼皮胶原蛋白的紫外吸收光谱图分析
花鳗鲡鱼皮胶原蛋白的最大紫外吸收峰所对应的波长是222.6 nm。一般认为蛋白质的最大紫外吸收峰会出现在280 nm处。花鳗鲡鱼皮胶原蛋白的吸收峰为什么没有出现在280 nm?分析原因,在280 nm处才有强力紫外吸收的氨基酸是色氨酸,可胶原蛋白中几乎不含色氨酸[17]。胶原蛋白中贡献苯环共轭π体系的氨基酸是Phe和Tyr,它们的最大光吸收波长分别是257和275 nm[15],Phe和Tyr在花鳗鲡胶原蛋白中的含量分别为18个和10个/1 000个氨基酸残基中。另外肽键的-C=O、-CONH2或与胶原螺旋构象有关的次级键也可以组成共轭体系,在210~250 nm范围内出现吸收峰[16]。使花鳗鲡鱼皮胶原蛋白最大吸收波长处在222.6 nm的另一个重要原因是溶剂(本次实验所用的溶剂是乙酸),溶剂会影响吸收峰的位置,乙酸是极性溶剂,会影响π电子跃迁所需的能量[18],我们通过Tyr标准品(生化试剂级)溶于乙酸后上机的验证实验也证实了乙酸确实使Tyr的最大光吸收波长向短波方向移动了一些。
3.4 花鳗鲡鱼皮胶原蛋白傅里叶变换红外光谱图分析
花鳗鲡鱼皮胶原蛋白的红外光谱图中含有酰胺A、B、Ⅰ、Ⅱ和Ⅲ吸收峰,与Heu等[19]所报道的比目鱼鱼皮胶原蛋白和Veeruraj等[12]报道的海鳗鱼皮的ASC的红外光谱结果类似。酰胺A是肽链中N-H的伸缩振动吸收峰,其峰形比较尖,波数范围通常是3 440~3 400 cm-1,当N-H参与氢键形成时,吸收峰会向低波数移动一些[20]。酰胺B为-CH2-的不对称伸缩振动峰[21]。酰胺Ⅰ、Ⅱ和Ⅲ峰被认为与多肽链的结构直接相关[19]。酰胺Ⅰ是酰胺键中的-C=O伸缩振动峰,这是多肽链二级结构存在的敏感标志[22],酰胺Ⅱ是酰胺键中的N-H和C-N的弯曲振动所产生的,酰胺Ⅲ是Gly残基和Pro残基中的-CH2所产生的振动峰。当酰胺Ⅰ、Ⅱ和Ⅲ吸收峰同时存在时说明胶原蛋白的二级结构和三级结构均没有被破坏。
3.5 花鳗鲡鱼皮胶原蛋白的热变性特性分析
本研究表明胶原蛋白的Td是28 ℃,虽然这是一个体外研究结果,但对养殖花鳗鲡的水温控制有一定的指导意义。朱陈平[23]认为养殖花鳗鲡时投食量与养殖池的水温有关,水温24~29 ℃花鳗鲡的食量较大,超过30 ℃后食量变小。鸿巢章二等[13]认为胶原的热稳定性与全部亚氨基酸(Pro+Hyp),尤其是含量之间存在着正的相关性,因为亚氨基酸的吡咯环对二级结构所起的固定化以及Hyp的羟基所形成的氢键对胶原螺旋的稳定性起着大的作用。Veeruraj等[12]报道的海鳗鱼皮ASC胶原蛋白的Td为38.5 ℃,亚氨基酸(Pro+Hyp)量为(96+94)/1 000,Gly∶Pro∶Hyp为3∶1∶1;张强等[17]报道的鲢鱼皮ASC的Td为31 ℃,亚氨基酸(Pro+Hyp)量为(128+65)/1 000,Gly∶Pro∶Hyp为5∶2∶1;花鳗鲡鱼皮胶原蛋白的亚氨基酸(Pro+Hyp)量为(112+76)/1 000,Gly∶Pro∶Hyp为8∶3∶2。花鳗鲡鱼皮胶原蛋白的热变性温度Td比海鳗鱼皮胶原蛋白和鲢鱼皮胶原蛋白的都低,而它们三者的亚氨基酸总量都在190/1 000左右,所以胶原的热稳定性,除了与全部亚氨基酸含量有相关性外,应该与胶原三股螺旋结构关系密切的Gly∶Pro∶Hyp比值也有关,因为多肽链很长区段是由Gly-x-y氨基酸序列重复而成的[15]。
3.6 体外自组装动力学特性分析
分析花鳗鲡鱼皮胶原蛋白的浊度曲线和流变黏弹性模量曲线的结果,发现花鳗鲡鱼皮胶原蛋白的体外自组装动力学特性表现为典型的3阶段模式,即迟滞期、成长期和稳定期。这与Comper等[24]报道的胶原纤维体外成核模式,以及赵燕等[11]描述的草鱼和乌鳢鱼皮胶原的自组装特征有相似之处。尽管花鳗鲡的生活史有在深海中产卵孵化这个特点,但它的生长成熟是在淡水中完成的,所以它的胶原自组装特征与淡水鱼鱼皮胶原的相似是能理解的。
3.7 花鳗鲡鱼皮胶原蛋白的微观结构分析
在5 000倍和50 000倍的视野里,花鳗鲡鱼皮胶原蛋白自组装后出现的是网状的交错条纹纤维结构。这与Zhang等[25]报道的鲟鱼皮胶原蛋白的胶原纤维SEM图相似。张强等[17]在报道鲢鱼皮ASC和PSC(pepsin soluble collagen)胶原蛋白的胶原纤维微观结构时,认为酸法保持了胶原纤维原有的结构,而胃蛋白酶法对胶原纤维的结构有一定的影响。我们在研究中也有尝试用酸法和酶法分别提取,但提取得率都不及胃蛋白酶结合酸法的,从图7可以发现胃蛋白酶结合酸法提取得到的花鳗鲡鱼皮胶原蛋白所形成的凝胶很好地保持了胶原纤维原有的结构。通常,酶溶性胶原不具备成纤维能力,因为端肽被胃蛋白酶切掉后,不容易形成纤维凝胶,但这里形成的凝胶纤维直径却较大,值得讨论。分析可能的原因有:一是花鳗鲡的鱼皮比一般鱼皮要厚实得多;二是提取时所用的酶量小,主要还是靠乙酸破坏胶原氢键促使胶原蛋白溶解到溶液中。
4 结论
SDS-PAGE结果表明花鳗鲡鱼皮胶原蛋白属于Ⅰ型胶原蛋白,氨基酸组成中Gly约占1/3,Gly∶Pro∶Hyp三者的比值约为8∶3∶2;胶原蛋白分子中存在共轭体系,最大的紫外吸收峰出现在波长222.6 nm处,红外光谱吸收峰中有酰胺A、B、Ⅰ、Ⅱ和Ⅲ等胶原蛋白的特征吸收峰,热变性温度为28 ℃。红外光谱图和SEM扫描结果均显示经胃蛋白酶处理酸溶得到的胶原蛋白保持了胶原原有的结构。花鳗鲡鱼皮胶原蛋白体外自组装动力学曲线图表现为典型的三阶段模式图,即为包含迟滞期、成长期和稳定期的曲线图。
