游泳运动对异育银鲫“中科3号”甲状腺激素代谢的影响
2019-11-27王海珊李长江李大鹏KommalyOnxayvieng
王海珊,李长江,汤 蓉,李大鹏,梁 骁,熊 梅,Kommaly Onxayvieng,3,李 莉
(1.华中农业大学水产学院,水产养殖国家级实验教学示范中心, 池塘健康养殖湖北省工程实验室,武汉 430070; 2.宜昌市水产技术推广站,湖北宜昌 443003; 3.Department of Livestock and Fisheries,Ministry of Agriculture and Forestry,Vientiane,Lao PDR)
游泳运动作为鱼类的生态习性,影响着鱼体内多种生理生化过程[1]。适度的游泳运动行为可以提升鱼类的生长性能,改善肌肉品质,增强免疫力等[2-4]。运动对鱼类所产生的各种有益生理效应可以视为动物福利改善的指标[5]。甲状腺激素(THs)对鱼类具有广泛的生物学作用,参与了生长、生殖、发育等多种生命活动[6-9]。甲状腺激素主要包括四碘甲状腺原氨酸(T4)和三碘甲状腺原氨酸(T3)。T3发挥着甲状腺激素的生物活性作用,它主要是由T4在外周组织内通过脱碘酶(IDs)催化脱碘作用产生[10,11]。运动对调控动物甲状腺机能方面具有一定作用。Kiessling等[12]在对全雌大鳞大麻哈鱼(Oncorhynchustshawytscha)的研究中发现,游泳运动可以提高血液T3含量以及T3/T4的比值[12]。
异育银鲫“中科3号”(Carassiusauratusgibeliovar.CAS Ⅲ)是异育银鲫第三代新品种,具有遗传性状稳定、生长速度快、出肉率高等特点[13]。目前,该品种已在全国多个省市广泛养殖。本研究以异育银鲫“中科3号”为研究对象,通过设置不同水流速度来使鱼类产生游泳运动,从而探究游泳运动对异育银鲫甲状腺激素水平及其代谢调控的影响,为鱼类的健康养殖实践提供基础科学数据。
1 材料和方法
1.1 实验鱼和驯养
异育银鲫“中科3号”幼鱼购自湖北省黄石市富尔水产苗种有限公司。试验前,将实验鱼在华中农业大学水产学院室内循环水养殖系统内暂养4周。暂养期间控制循环水水温在(28.0±0.5) ℃,pH为7.30±0.07,溶氧水平保持在6.7 mg/L左右。实验鱼被每天饱食投喂3次,分别是08:00、14:00和18:00,投喂1 h后立即清除养殖系统内的残饵和粪便,每日换水量约为养殖水体的10%。
1.2 实验装置与实验设计
1.2.1 实验装置
实验采用自主设计的环流水养殖装置(图1),养殖缸呈直径85 cm的蓝色塑料圆柱形,养殖水位高40 cm,养殖缸中间加入直径25 cm的空心PVC管并配备相应尺寸管帽。养殖缸右侧用吸盘吸附可调节水流量潜水泵(功率25、100、150 W;型号HJ-1500、HJ-5500、HJ-6000,森森集团股份有限公司),不同实验组配备不同功率的潜水泵以营造不同的水流速度环境。
1.2.2 实验设计
挑选体质量(99.47±10.22)g,体长(14.58±0.07)cm的健康异育银鲫“中科3号”幼鱼192尾,随机分为1个静水对照组和3个游泳运动组。对照组流速为0 bl(体长)/s,运动组的流速分别为0.5、1.0和2.0 bl/s,每组设置3个平行实验缸,每个实验缸内放养16尾鱼。在正式实验前3 d,逐步提高水流训练的时间,直至达到正式游泳所需的18 h。每天检测养殖缸内水流速度,选取水体底部、中部和顶部三个水位检测取平均值,由LS300-A型便携式流速测算仪(南京卓玛机电有限公司)测定大小。
在实验过程中,随着鱼体的生长,流速根据其体长每2周调整1次。每天饱食投喂3次,投喂期间各组水环境均保持静水状态,投喂1 h后立即清除养殖系统内的残饵和粪便。在游泳组中,每天的流速保持18 h,其他时间关闭水流,即实验鱼的游泳时间为18 h/d。实验时间为8周。
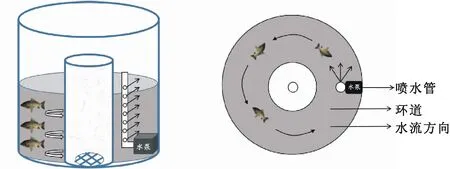
图1 环流水养殖系统设计图Fig.1 The scheme of water circulation in the experimental tank
1.3 样品采集
1.3.1 血液样品
流水训练8周后,进行取样。每个平行实验缸取12尾鱼,即每个处理组取36尾鱼。采用MS-222(120 mg/L)麻醉实验鱼,每尾鱼用不加抗凝剂的注射器自尾静脉取血1~3 mL,3 500g离心20 min后,取上层血清,保存于-80 ℃下用于激素测定。
1.3.2 组织样品
训练8周后,每缸随机选取12尾鱼,采用MS-222(120 mg/L)麻醉。每尾鱼分别采集肝组织以及下颌部第1至第3对鳃弓的交叉处组织(甲状腺滤泡聚集处)样品。将样品于液氮中速冻后,保存在-80 ℃超低温冰箱中以待测定。
1.4 测定方法
1.4.1 血清皮质醇含量的测定
采用放射性免疫测定法测定血清皮质醇(Cor.)含量,使用皮质醇放射性免疫试剂盒(北京北方生物技术有限公司,批号20171010)进行测定。应用免疫竞争机制原理,标准或样品中的Cor.和加入的125I-Cor.共同与定量的特异性抗体产生竞争性免疫反应。125I-Cor.与抗体的结合量与标准或样品重Cor.的含量呈一定的函数关系。用免疫分离试剂(PR)将结合部分(B)与游离部分(F)分离后,测定结合部分的放射性强度,并计算相应结合律B/B0。用已知标准Cor.含量与对应结合律作图,即得标准已知曲线。从标准曲线上查知对应结合率的待测样品重Cor.含量。
1.4.2 血清甲状腺激素与促甲状腺激素含量的测定
血清T3、T4、FT3和FT4含量采用酶联免疫(ELISA)检测试剂盒(北京北方生物技术研究所,批号20060009)测定,TSH含量用放射免疫法(RIA)检测试剂盒(北京北方生物技术研究所,批号20180424)测定。
1.4.3 脱碘酶活性的测定
肝脏组织中加入0.1 mol/L PBS,1 mmol/L DTT,2 mmol/L EDTA,pH7.0的缓冲液进行匀浆,12 000g室温下离心20 min,取上清液,得到10%的组织匀浆液。匀浆液快速冷冻于液氮中,在-80 ℃下保存。10%肝匀浆液采用Bradford蛋白测定试剂盒(南京建城研究所)测定蛋白质浓度。
脱碘酶(IDs)分为三种类型,分别是Ⅰ型脱碘酶(ID1)、Ⅱ型脱碘酶(ID2)和Ⅲ型脱碘酶(ID3)。按照如下成分制备ID1、ID2和ID3的孵育液。ID1孵育液:50 000 cPm125I-rT3,0.10 μmol/L rT3,15.00 mmol/L DTT;ID2孵育液:50 000 cPm125I-T4,1.00 μmol/L T4,30.00 mmol/L DTT;ID3孵育液:150 000 cPm125I-T3,1.00 μmol/L T3,30.00 mmol/L DTT。将200 μL肝匀浆液和200 μL不同的孵育液分别在放免管中于37 ℃下孵育120 min,对照组用匀浆缓冲液代替肝匀浆液,反应步骤和条件不变。
孵育液结束后,在每管中加入200 μL 4 ℃的5% BSA(w/v)溶液使反应停止,然后加入200 μL 10% TCA使蛋白沉淀,在3 500g离心30 min。用GC-911型恪β放射免疫计数器测量总放射性和上清液放射性的cPm值,脱碘酶的活性计算公式如下:

其中SCc=SC-BC;BC:对照管的放射性计数;SC:样品管的放射性计数;TC:总放射性计数;SA:孵育液中反应底物的含量/TC。碘甲状腺原氨酸的单位活性以每分钟每毫克蛋白释放出的I-1的飞摩尔(fmol I-1released/(mg Pro·min))表示。
1.4.4 甲状腺激素代谢调控相关基因表达量的测定
使用组织研磨仪在冰浴条件下,根据RNAiso试剂(TaKaRa,Shuzo,JaPan)使用说明进行肝脏与垂体总RNA的提取。通过琼脂糖凝胶电泳检测RNA质量,用NanoDroP 2000 核算分析仪(Thermo Scientific,Waltham,MA,USA)检测其浓度。使用HifairTMⅡ1 standard cDNA synthesis suPermix (Yisheng,Shanghai,China)反转录试剂盒进行反转录第一链cDNA的合成。
从GenBank中公布的鲫甲状腺内分泌系统与生长相关基因核心序列片段设计引物,测定鲫肝脏中id1、id2、id3、ttr、tr-α、tr-β基因的表达情况,选取β-actin为内参基因,引物序列如表1所示。
用HifairTMqPCR SYBR荧光染料(上海翊圣)进行qRT-PCR检测。qRT-PCR反应条件为:95 ℃预变性5 min,95 ℃变性10 s,58 ℃(β-actin)、60 ℃(id1)、58 ℃(id2)、60 ℃(id3)、58 ℃(ttr)、55 ℃(tr-α)、58 ℃(tr-β),4 ℃退火,72 ℃延伸20 s,扩增40个循环,目的基因的表达分析采用2-△△ct法。

表1 荧光定量PCR引物序列
1.4.5 甲状腺组织学观察
采集异育银鲫第1至第3对鳃弓的入鳃动脉和腹大动脉交叉处(鲫甲状腺滤泡主要集中处)组织,固定于4%多聚甲醛中,采用组织学石蜡切片技术和苏木精-伊红染色法,使用Nikon EcliPse 80i显微镜进行甲状腺组织学结构特性的观察。参考刘子栋等[24]的方法,通过测量细胞核的长径和短径来对甲状腺滤泡细胞核的大小进行定量评估,每个实验组统计3个切片样品数,每片共计数25个细胞核,运用椭圆公式(π×长轴长×短轴长/4)计算细胞核大小。
1.4.6 数据统计分析
实验中所有数据先用Excel进行初步处理,实验数据采用平均数±标准差(mean±SD)来表示,用SPSS 19.0软件进行实验数据的统计和分析。在检测实验数据的正态分布和方差齐性后,采用单因素方差分析(One-Way ANOVA)进行显著检验,用邓肯检验法(Duncan)进行多重比较分析,P<0.05为显著性差异。
2 结果
2.1 血清皮质醇、甲状腺激素和促甲状腺激素水平
游泳训练8周后,各组血清皮质醇含量基本保持稳定水平,各实验组之间并无显著性差异(表2)。游泳运动对实验鱼血清甲状腺激素水平产生了比较显著的影响(表2)。与对照组相比,血清T4与T3的含量在运动组均有上升,在0.5 bl/s运动组有显著上升,但1 bl/s和2 bl/s运动组与对照组之间没有显著性差异。8周游泳运动后,2 bl/s运动组的血清FT4含量显著高于对照组和其他运动组。此外,血清FT3含量在对照组与三个游泳运动组间不存在显著性差异。游泳运动也改变了实验鱼血清TSH的水平,其在0.5 bl/s与1 bl/s运动组中出现了显著性上升的现象(表2)。

表2 不同水流速度对异育银鲫血清皮质醇、甲状腺激素和促甲状腺激素水平的影响
2.2 肝脏脱碘酶活性
与对照组相比,ID1活性在0.5 bl/s运动组显著上升,但1 bl/s和2 bl/s运动组与0 bl/s对照组之间没有显著性差异。随着流速的增长,ID2活性呈逐渐上升趋势,但各个实验组间无显著性差异。ID3活性随着流速的上升而下降,1 bl/s和2 bl/s运动组中ID3的活性显著低于0 bl/s对照组,0.5 bl/s组与0 bl/s组之间无显著性差异 (图2)。

图2 不同水流速度对异育银鲫肝脏脱碘酶活性的影响Fig.2 The effect of swimming on the activity of iodothyronine deiodinase of C.auratus gibelio under different water velocity
2.3 甲状腺激素代谢相关基因表达量
tr-αmRNA相对表达量在2 bl/s运动组中显著性上升,且0 bl/s对照组和0.5 bl/s、1 bl/s运动组之间无显著性差异。tr-βmRNA相对表达量在各实验组间无显著性差异 (图3)。
id1 mRNA相对表达量在1 bl/s运动组中显著上升,显著高于0 bl/s对照组和0.5 bl/s、2 bl/s运动组,且后三组间无显著性差异。id2和ttr的mRNA相对表达量在各组见无显著性差异。同时,id3 mRNA相对表达量在2 bl/s运动组中显著性高于对照组和0.5 bl/s、1 bl/s运动组 (图3)。
2.4 甲状腺组织学结构
异育银鲫甲状腺滤泡内充满了均匀的胶质。各个实验组的鱼类甲状腺滤泡上皮细胞保持正常形态结构,未发生显著改变(图4)。但相比于对照组,运动组中异育银鲫甲状腺滤泡上皮细胞的细胞核显著性增大 (图5)。
3 讨论
血液皮质醇水平常被用作反映鱼类应激状态的内分泌指标。当鱼类产生应激反应时,血浆皮质醇水平会显著升高[14,15]。Young等[16]的研究表明,在面对捕捞和拥挤胁迫后0.5 h,条纹鲈鱼(Moronesaxatilis)血浆皮质醇含量显著性升高。胁迫后4 h,野生条纹鲈鱼以及经过游泳运动的鱼血浆皮质醇含量均恢复到应激前水平,对照组血浆皮质醇含量依旧显著性高于胁迫前水平。Woodward等[17]的研究结果同样示,经过运动训练后的虹鳟(Salmogairdneri)在面对游泳应激压力时表现出更好的抗应激能力。本研究发现,在经过8周的游泳运动后,异育银鲫“中科3号”血清皮质醇含量均保持正常水平,与对照组并无显著性差异。由此表明,实验鱼能够长期适应不高于2 bl/s的水流环境。

图3 不同水流速度对异育银鲫肝脏中tr-α,tr-β,ttr,id1,id2与id3基因表达的影响Fig.3 Transcript abundance for tr-α,tr-β,ttr,id1,id2 and id3 in liver of C.auratus gibelio under different water velocity

图4 不同水流速度对异育银鲫甲状腺滤泡组织 结构的影响Fig.4 The effect of different water velocity on the histological structure of thyroid follicles in C.auratus gibelio A:0 bl/s;B:0.5 bl/s;C:1 bl/s;D:2 bl/s;CO:胶质。

图5 不同水流速度对异育银鲫甲状腺滤泡细胞核 大小的影响Fig.5 The effect of different water velocity on the histological structure of thyroid follicles in C.auratus gibelio
鱼类甲状腺机能主要受下丘脑-垂体-甲状腺轴(HPT)的调控,并通过HPT轴维持外周循环系统甲状腺激素代谢的稳态。与其他脊椎动物不同,鱼类的甲状腺几乎不合成T3,只合成T4,其分泌活动受到垂体分泌的促甲状腺激素(TSH)的调控[18]。TSH含量的改变对甲状腺激素(THs)的合成与释放具有重要的作用[19,20]。在本研究中,游泳运动改变了异育银鲫血清TSH的含量,使其在游泳运动组积累增多,并且血清THs在游泳运动组显著性升高。说明可能是由于运动训练刺激了下丘脑与垂体对TSH的释放,从而促进了下游THs的积累。
在生物体内,T3是主要发挥生物活性的甲状腺激素形式,主要是由外周组织中的T4与TTR结合后转运至外周组织,通过脱碘酶(IDs)的外环脱碘作用转化而来。IDs对外周组织内TH的代谢具有重要的调控作用[11]。ID1具有催化T4外环脱碘形成T3和催化T4内环脱碘形成反T3(rT3)的双重特性。本研究中,ID1活性在0.5 bl /s流速组中显著性升高,这与血清T4与T3含量在0.5 bl s-1运动组显著性升高表现一致。可能是由于ID1活性的升高,增加了T4向T3的外环脱碘转化,提升了机体T3水平。同时,ID2也具有催化T4和rT3的外环脱碘作用。Yan等[21]认为,相比于ID1,只具有外环脱碘作用的ID2可以更专一地在调节机体T3含量方面发挥作用[21]。但在本研究中,虽然游泳运动组ID2活性出现了上升,但与对照组相比并无显著性差异。可能是由于不同的研究对象与处理条件引起的,本研究中ID1发挥了更大的作用。此外,承担催化T4和T3内环脱碘作用的ID3活性在游泳运动组显著性降低,由于ID3具有催化THs失活降解的作用,机体可能是通过减少THs的降解从而促进了训练组血清THs的积累。由此可见,运动训练引起了外周THs代谢过程中的一系列酶活性的改变增加了T4向T3增强以及T3降解代谢减弱,从而促进了机体内T3水平的升高。
THs通过与血浆中的甲状腺激素转运蛋白(TTR)结合进行转运,实现脱碘以及向靶组织器官运输的调节作用,对维持甲状腺组织外的THs含量起到了十分重要的作用[21,22]。有关研究表明,微囊藻毒素的暴露引起斑马鱼(Daniorerio)机体ttr基因表达水平的升高,同时引起T3与FT3含量的降低,是由于TTR与T3结合水平升高导致的[23]。在本实验中,肝脏ttr基因表达水平在各个实验组间无显著性差异游泳运动组升高的T4含量,促进了FT4的积累。THs与细胞内甲状腺激素受体(TRs)结合形成激素受体复合物,然后进一步调控下游基因的表达[24]。甲状腺激素受体包含两种类型,即TR-α与TR-β,其mRNA水平受到体内甲状腺激素的调节。tr基因的表达水平会影响其与THs的结合,从而影响THs生物学效应的发挥[24,25]。水流刺激下,异育银鲫的THs代谢在不同的流速下表现出不同的响应形式,如TRs上调或T3水平升高。TRs表达上调以及T3水平升高,都有助于THs生物学效应的发挥。因此,水流刺激银鲫增加游泳时间,可以锻炼鱼类起到促进TH发挥生物学效应,更好地调控鱼类的生长代谢。
与哺乳动物不同,常见淡水鱼类的甲状腺并不是一个单一实质腺体,而是由一些散布的甲状腺滤泡组成。在正常的生理活动下,由单层上皮细胞构成的甲状腺滤泡内布满了胶质,是甲状腺激素合成与贮藏的主要位置[6]。在本研究中,我们发现各个实验组中的甲状腺滤泡内胶质分布均匀。运动训练组中甲状腺滤泡上皮细胞细胞核出现增大现象,可能是由于血清中TSH含量过高对甲状腺组织的反馈作用,表明游泳运动增加了异育银鲫甲状腺组织的代谢功能[27]。
总体来讲,游泳运动可以通过调控TSH的分泌促进TH的合成,并通过调节外周组织的IDs活性来改变异育银鲫外周循环系统内的THs含量。适度的游泳运动可以促进异育银鲫甲状腺激素的代谢,提高其甲状腺机能,对提升其生理健康具有一定的促进作用。
