方格星虫dmrt1基因的克隆和表达分析
2019-11-26李文华吴雅琴马国兴袁铭瑞许瑞安
李文华 吴雅琴 马国兴 袁铭瑞 许瑞安
(华侨大学生物医学学院, 分子药物教育部工程研究中心, 福建省分子医学重点实验室, 厦门市海洋与基因工程药物重点实验室, 厦门 361021)
方格星虫(Sipunculus nudus)又名裸体方格星虫或光裸星虫, 俗称“沙虫”, 隶属于星虫动物门, 方格星虫纲, 方格星虫科, 方格星虫属[1], 是一种名贵的海产珍品。目前, 关于方格星虫繁殖生物学的研究甚少。方格星虫为体外受精, 雌雄异体, 性成熟最短时间为11个月, 其生殖腺位于收吻肌基部, 腺体细小, 肉眼难以识别, 仅在排卵期明显[2,3]。全年都可以在其体腔中观察到生殖细胞, 生殖细胞的发育随季节的变化而变化[4]。星虫动物的配子发生过程比较特别, 原生殖细胞在发育早期便以单细胞或细胞团的形式从性腺脱落进入到体腔液中继续发育至成熟, 发育成熟后进入肾管[3,4]。方格星虫具有1对细长的呈圆筒状的肾管结构, 肾管一般作为排泄器官, 负责排出体腔中的代谢废物[5]。在繁殖季节, 肾管兼作生殖道, 负责收集体腔中的精卵并使之获能。产卵前, 体腔内成熟的生殖细胞通过内肾孔进入到肾管。产卵时, 成熟的生殖细胞通过外肾孔排出体外[6,7]。与大多数无脊椎动物的繁殖过程不同, 星虫的繁殖生物学具有一定的特殊性, 其配子只有经肾管收集并停留一段时间进行最后的“激活包装”才能完全成熟, 才具有受精能力[4,6,8—11]。
DMRT (Double-sex and mab3-related transcription factor)基因家族, 在动物性别决定和分化过程中发挥着重要的调控作用[12]。该家族共同的特征是含有保守的锌指DNA结合结构域(Doublesex and mab-3, DM domain), 其中, DMRT基因家族中的dmrt1在性别决定、分化和器官功能维持上发挥着重要的作用, 已在哺乳动物、禽类、两栖爬行类及硬骨鱼类等发现[12—16]。人类(Homo sapiens)dmrt1定位于9号染色体, 该基因的缺失会导致精巢发育障碍[17], 在XY雄性小鼠(Mus musculus)中的研究结果显示, 敲除dmrt1基因后严重影响睾丸分化和精子形成[18]。鸟类dmrt1对于精巢的分化也起着至关重要的作用, 且高表达的dmrt1基因决定了鸟类的性别[19]。非洲爪蟾(Xenopus laevis)中的一个位于W染色体上的dmrt1的复制本,DM-W, 被证明为非洲爪蟾的性别决定基因,DM-W的表达能够阻止精巢的分化, 从而导致卵巢的发生[20,21]。青鳉(Oryzias la-tipes)dmrt1基因在Y染色体上的一个复制本Dmy(又叫Dmrt1y)是一个雄性特异的性别决定基因, 能促使雄性发生也是促使雄性发生所必须的基因[22,23]。与脊椎动物相比, 无脊椎动物dmrt1基因的研究报道尚少, Jennifer等[24]在无脊椎动物东部大螯虾(Sagmariasus verreauxi)中克隆到定位于Y染色体上的一个DMRT基因的复制本iDMY。dmrt1作为不同物种间保守的性别相关基因, 尚没有研究报道其在方格星虫中的研究情况。本研究旨在克隆得到在海洋无脊椎动物方格星虫生殖发育中的重要功能基因dmrt1的全长cDNA序列, 分析它的序列特征、进化关系和表达特征。
1 材料与方法
1.1 实验材料
1—1.5年龄方格星虫(体长约15 cm)购买于厦门第八海鲜市场。抽取方格星虫体腔液鉴定雌雄后, 取体腔液、肾管、神经节、肌肉、翻吻肌和肠道组织用液氮速冻后, 置于-80℃保存, 用于成体组织实时荧光定量PCR。
1.2 方格星虫SMART cDNA文库构建
取方格星虫雄性个体的体腔液, 使用TRIzol(TaKaRa)提取总RNA, 然后用SMART cDNA合成试剂盒(Clontech)构建SMART cDNA文库。总RNA的提取和SMART cDNA的合成参照产品说明书。
1.3 Dmrt1基因的cDNA序列扩增
根据前期实验获得的部分dmrt1序列设计RACE扩增引物(表 1), 然后使用以下程序进行PCR扩增: 95℃变性15s, 60℃退火30s, 72℃延伸2min, 共36个循环, 72℃加尾15min。将获得的PCR产物上样于1%的琼脂糖凝胶中, 取适量目标条带切胶纯化后的产物与pMD18-T载体连接, 4℃过夜处理后转入大肠杆菌感受态中, 筛选含有阳性插入片段的菌落进行测序验证和分析。
1.4 Dmrt1基因的序列分析
在NCBI (http://www.ncbi.nlm.nih.gov/)数据库中, 利用方格星虫DM结构域检索近缘物种DM结构域的氨基酸序列, 使用MUSCLE软件对所有序列进行对位排列, 并用BioEdit软件对排列不整齐的序列进行人工校正。选择MEGA 7.0软件, 基于Jones-Taylor-Thornton (JTT)模型, 将对位排列整齐的序列构建邻接法(Neighbor-Joining, NJ)系统发育树, 系统树进行1000次自展重复, 其中大于50%的枝被认为是可信的。
1.5 实时荧光定量PCR
分别提取雌雄方格星虫体腔液、神经节、肠道、肌肉、肾管和翻吻肌的总RNA。用PrimeScript®RT reagent Kit With gDNA Eraser (TaKaRa)试剂盒合成单链cDNA, 具体操作步骤参见产品说明书。选择方格星虫β-actin作为内参基因, 使用ChamQ SYBR qPCR Master Mix (Vazyme)进行实时荧光定量PCR扩增, 具体操作程序和方法参见产品说明书,所用引物序列见表 1。

表1 引物序列Tab. 1 Primer sequences
1.6 原位杂交
选取方格星虫dmrt1的部分cDNA序列设计原位杂交引物, 为了获得含有T7启动子的目标序列,我们分别在上下游引物的5′端插入T7启动子序列TAATACGACTCACTATAGGGAGA, 以获得方格星虫dmrt1正反义探针, 具体参见表 1, 然后通过常规PCR扩增的方式获得含有T7启动子的方格星虫dmrt1基因片段。接下来, 使用T7聚合酶(Roche)进行体外转录, 具体操作方法参见产品说明书。分别取雌雄方格星虫体腔液涂布于载玻片上, 37℃烘干1h, 然后将切片进行蛋白酶消化、多聚甲醛固定、RNA探针杂交、洗脱、封闭、抗体孵浴、染色及显色等步骤[25]。
1.7 统计分析
荧光定量的统计数据用平均值±标准差(Mean±SD)来表示。对各实验组的荧光定量数据进行单因素方差分析(ANOVA), 取P<0.05为显著性差异阈值, 差异分析使用SPSS 22.0软件进行。样品间基因表达量数据图选用GraphPad Prism 5.0软件进行绘制。
2 结果
2.1 Dmrt1基因的序列特征分析
方格星虫dmrt1全长cDNA含有1509 bp (Gen-Bank: MK182259), 其中开放阅读框的长度为615 bp,5′-UTR的长度为145 bp, 3′-UTR的长度为749 bp, 共编码204个氨基酸。同时, 我们扩增出的方格星虫dmrt1全长含有多腺苷酸化加尾信号AATAAA, 加尾信号位于poly (A)尾上游的18 bp处。
对方格星虫dmrt1的氨基酸序列进行保守结构域分析, 显示其与Dmrt家族成员具有极其相似且高度保守的DM结构域, 将方格星虫DM结构域与已报道的其他物种DM结构域进行多重序列比对, 比对结果显示方格星虫DM结构域与海葵(Exaiptasia pallida)的DM结构域一致性最高, 高达81%。此外,方格星虫与其他海洋软体动物, 如牡蛎(Crassostrea gigas)、珠母贝(Pinctada margaritifera)的DM结构域的相似性也可达到72%, 且与脊椎动物人、小鼠、非洲爪蟾及斑马鱼(Danio rerio)的DM结构域的一致性分别为72%、72%、70%及70%。
为了确定方格星虫dmrt1基因的进化关系, 我们构建了系统进化树。进化树的拓扑结构显示方格星虫dmrt1基因与数据库中已知的脊椎动物或海洋软体动物都没有表现出明显的聚集现象(图 1),暗示方格星虫dmrt1基因与我们找到的这些物种的亲缘关系相对较远。目前, 关于星虫或其近缘物种的dmrt1基因的相关研究尚鲜有报道。
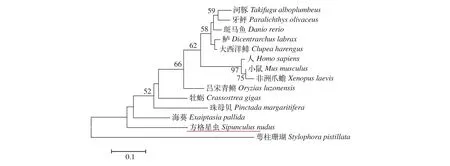
图1 基于NJ法构建的不同物种DMRT1的系统发育树Fig. 1 Phylogenetic tree of DMRT1 in species based on NJ method
2.2 方格星虫dmrt1在雄性个体的体腔液中高表达
我们采用荧光定量PCR方法研究了dmrt1在不同组织(体腔液、神经节、肠道、肌肉、肾管和翻吻肌)中的表达差异。方格星虫dmrt1仅表达于雄虫体腔液中, 在所检测的其他组织包括神经节、肠道、肌肉、肾管和翻吻肌中没有表达(图 2), 且在所检测的雌性个体的各个组织(体腔液、神经节、肠道、肌肉、肾管和翻吻肌)皆不表达。
为了进一步研究dmrt1在成体方格星虫体腔液中的表达图式, 我们抽取方格星虫雌雄个体的体腔液, 采用方格星虫dmrt1正、反义探针进行了体腔液涂片原位杂交实验。结果显示, 杂交信号主要出现在雄性个体体腔液, 且主要集中在精子团附近的滋养细胞中(图 3A), 而在雌性个体体腔液中没有检测到杂交信号(图 3B), 同时使用正义探针在雄性体腔液中也没有检测到杂交信号(图 3C)。
3 讨论
Dmrt1基因作为一个保守的性别相关基因, 广泛参与哺乳类、爬行类、两栖类和鱼类的性别发育和分化过程, 在性别决定和生殖器官的功能维持等方面发挥着重要作用, 但该基因在不同进化地位和不同性别决定机制的物种中的表达特性及功能不尽相同[12—16]。本研究从方格星虫体腔液中克隆得到dmrt1基因, 生物信息学分析显示dmrt1基因具有保守的DM结构域, 同时通过荧光定量PCR, 我们报道了该基因主要表达于方格星虫雄性个体的体腔液中。
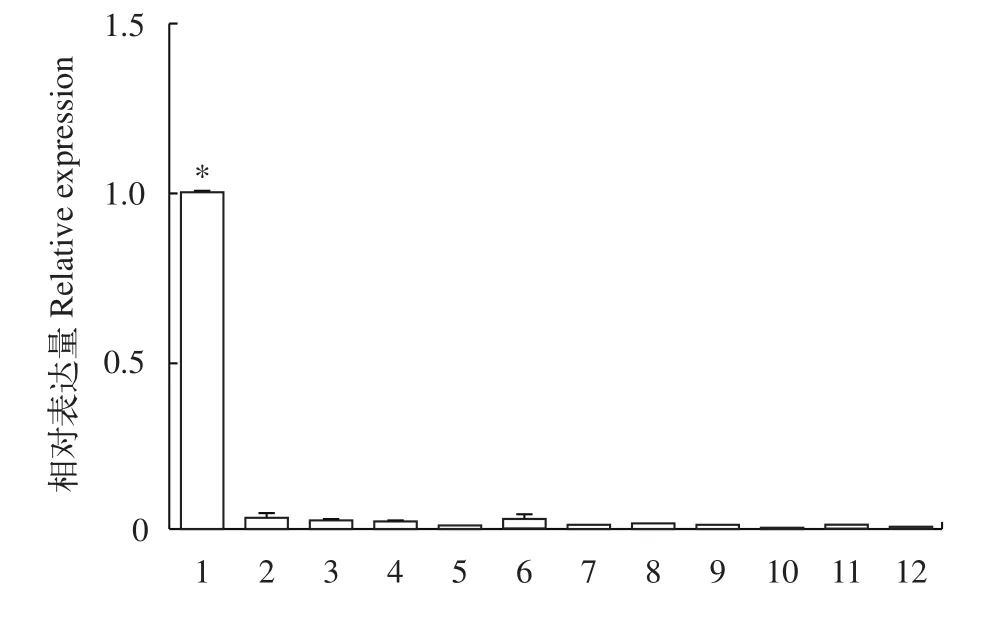
图2 方格星虫dmrt1在不同组织中的荧光定量结果Fig. 2 The relative expression of dmrt1 in adult tissues of Sipunculus nudus
DM结构域最早鉴定于果蝇中, 从无脊椎动物到脊椎动物DM结构域表现出高度的进化保守性[26]。方格星虫DMRT1含有DM结构域, 表明我们克隆的dmrt1基因符合DMRT家族成员的共有特征。生物信息学分析结果显示方格星虫DM结构域与海洋软体动物, 如海葵、牡蛎及珠母贝的一致性可达72%以上, 与脊椎动物人、小鼠和斑马鱼的DM结构域一致性也能达到70%以上, 说明方格星虫DMRT1具有一定的保守性。
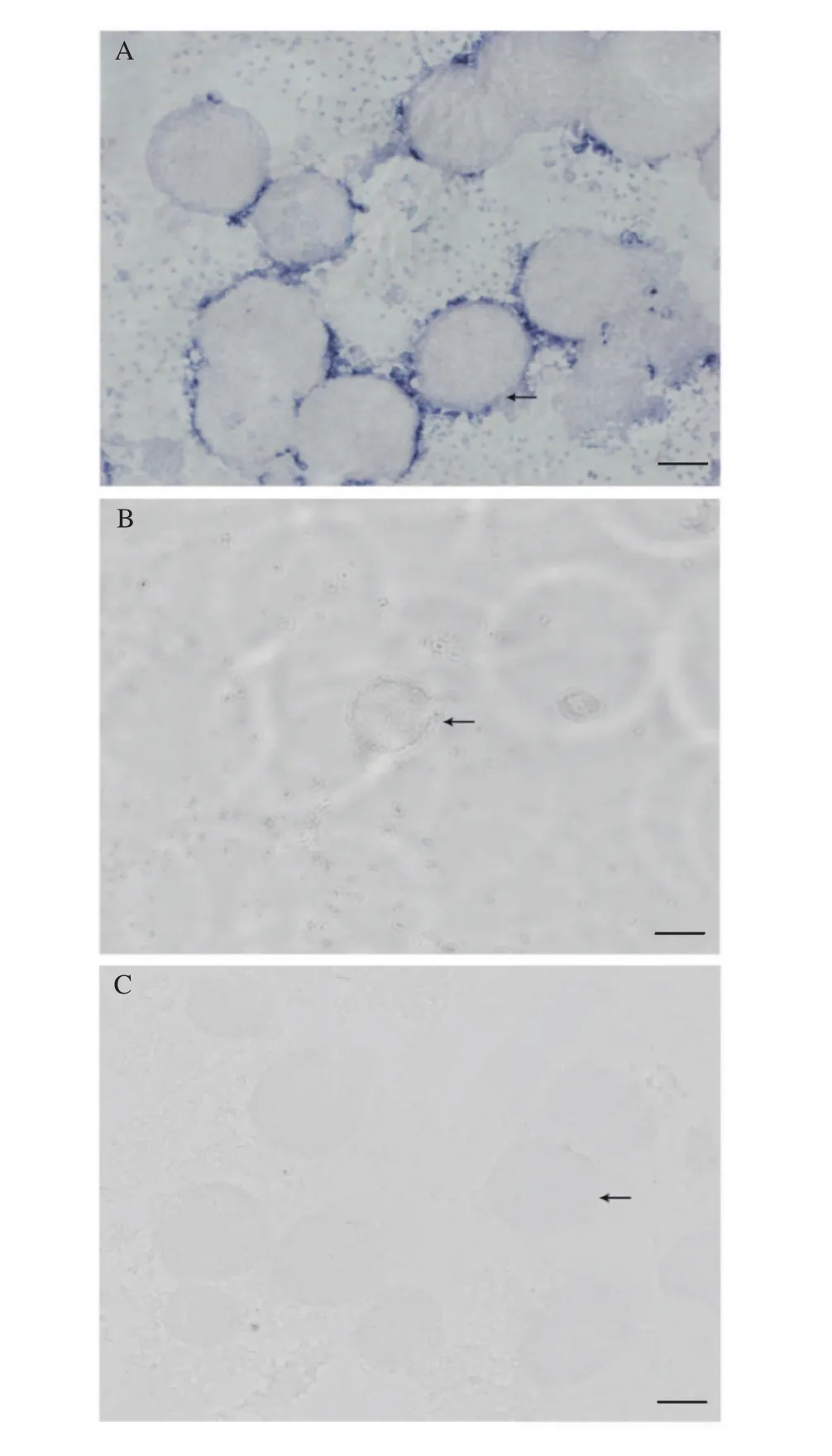
图3 方格星虫dmrt1 mRNA在雌雄体腔液中的细胞定位Fig. 3 Cellular distribution of dmrt1 mRNA in Sipunculus nudus coelomic fluid
早有报道称星虫是一类有体腔、两侧对称、身体不分节及外型像虫的古老的海洋无脊椎动物,化石证据表明星虫至少出现于后寒武纪, 在5.2亿年里, 星虫的形态结构几乎没有发生变化[27]。系统进化树的结果显示方格星虫dmrt1基因与现有数据库中的部分脊椎动物和海洋软体动物都没有聚为一支(图 1), 我们认为其主要原因可能是星虫类动物作为一种古老的海洋软体动物, 尚没有与其遗传距离较近的物种报道克隆出dmrt1基因, 且星虫类物种本身的繁殖生物学研究甚少, 已有研究也仅集中在生殖细胞形态、分类及组织学研究等方面[28—30]。综上所述, 本文开启了方格星虫类动物在性别决定及分化相关基因研究, 为进一步深入研究打下基础。
在已经检测的多数物种中,dmrt1都在雄性性腺或者雌性向雄性转变的性腺中高表达[13]。方格星虫dmrt1在6个所检测的成体(雌虫和雄虫)组织中, 主要表达于雄虫体腔液中(图 2)。星虫动物的原生殖细胞在发育早期以单细胞或细胞团的形式从肉眼难以识别的性腺上脱落进入到体腔液中继续发育, 形成的生殖细胞附着于具有运动能力的滋养细胞基部[3,31]。方格星虫雄性生殖细胞一般以精细胞团形式存在, 卵细胞以单个游离形式存在[31]。原位杂交实验结果显示方格星虫dmrt1的杂交信号主要出现在精子团附近的滋养细胞中(图 3A), 兰宝国等[4]认为滋养细胞带着生殖细胞一起运动, 从而有利于生殖细胞从体腔液中摄取营养。哺乳动物精巢中有一类重要的细胞, 即支持细胞(Sertoli cells), 它为发育中的精子提供保护和营养[32], 我们认为方格星虫雄性体腔液中的滋养细胞可能与哺乳动物精巢中的支持细胞具有类似的功能, 因此推测方格星虫dmrt1可能与其雄性决定和精子发生相关联, 而具体生物学功能仍有待进一步的研究。
