黄颡鱼自噬相关基因 LC3B和Beclin1的原核表达及多克隆抗体制备
2019-11-26魏晓雷叶汉梅
魏晓雷 叶汉梅 罗 智
(华中农业大学水产学院,武汉 430070)
细胞自噬是生物体进化过程中的一种保守机制, 通过降解细胞质中受损细胞器或蛋白以维持生物体的稳态[1]。迄今为止, 在酵母模型系统中已经鉴定出30多种自噬相关基因(Autophagy-related genes, ATGs), 这些自噬相关基因参与了细胞选择或非选择性的自噬功能, 而且这些基因中的大多数在真核生物中具有同源物[2]。微管相关蛋白1轻链3(Microtubule-associated protein 1 light chain 3,MAP1LC3 orLC3)是酵母Agt8基因在哺乳动物中的同源类似物。在黄颡鱼中, LC3有2个亚型, 包括LC3A和LC3B[3]。LC3在细胞中合成后经过加工成为胞质型LC3-Ⅰ。细胞在面临各种应激情况下, 自噬水平改变, LC3-Ⅰ的一部分转换成膜结合型LC3-Ⅱ并与自噬泡结合[4]。LC3-Ⅱ是公认的自噬体存在的标志分子, Western blot检测LC3-Ⅱ蛋白含量变化是目前检测自噬常用的方法[5]。Beclin1是酵母Atg6基因在哺乳动物中的同源类似物, 在多种生物中高度保守[6]。Beclin1通过与ClassⅢ PI3K形成复合物参与自噬体的形成, Beclin1是调节自噬过程的关键性蛋白质, 是自噬启动的标志分子[7]。Beclin1作为调控自噬形成的关键基因, 参与了很多蛋白质的修饰调控, 进而调控自噬体的形成[8,9]。
黄颡鱼(Pelteobagrus fulvidraco)是我国内陆淡水地区重要养殖的经济鱼类, 最近我们实验室克隆得到了黄颡鱼自噬发生关键基因的cDNA序列[3,10],探讨了自噬介导锌影响黄颡鱼脂类代谢的机制[11]。多克隆抗体具有识别抗原表位多、制备时间短、成本低等优点, 可以应用于免疫印迹、酶联免疫吸附实验(ELISA)、免疫组化等实验, 成为科研中不可或缺的一部分。然而, 到目前为止, 还没有高质量的黄颡鱼LC3和Beclin1抗体, 很大程度限制了对黄颡鱼自噬调控的深入研究。本研究成功表达和纯化得到了重组PfLC3B和PfBeclin1蛋白, 并分别制备了鼠抗血清, 以期为深入研究黄颡鱼自噬发生的过程和机制奠定基础。
1 材料与方法
1.1 材料
5周龄SPF级Balb/C小鼠由华中农业大学实验动物中心提供, Ni-NTA预装重力柱(1 mL)购自生工生物工程(上海)股份有限公司, 弗氏佐剂购自Sigma公司,E. coliDH5α和E. coliRosetta(DE3)购自天根生物有限公司, 质粒pET32a(+)由本实验室保存, 黄颡鱼购自武汉市汉南区的五湖渔场。
1.2 方法
pET32a(+)-PfLC3B和pET32a(+)-PfBeclin1重组表达载体的构建根据黄颡鱼LC3B基因序列,设计含有EcoR Ⅰ和XhoⅠ酶切位点的一步法克隆引物PfLC3B-F和PfLC3B-R。引物序列如下,PfLC3B-F: 5′-GCTGATATCGGATCCGAATTCAT GCATTCAGAAAAGATGTTTAAACAA-3′,PfLC3B-R: 5′-GTGGTGGTGGTGGTGCTCGAGT TACTGCGCCGCTCCGAA-3′。
根据黄颡鱼Beclin1基因序列, 设计扩增PfBeclin1全长的引物B-F和B-R。引物序列如下, B-F:5′-AGTACCATGGAGGGCTCCAA-3′, B-R: 5′-GC CAAAACCAGGGATCAGGG-3′。设计含有EcoRⅠ和XhoⅠ酶切位点的一步法克隆引物PfBeclin1-F和PfBeclin1-R。引物序列如下PfBeclin1-F: 5′-GCTGATATCGGATCCGAATTCATGGAGG GCTCCAAGTCATCC-3′和PfBeclin1-R: 5′-GTGGT GGTGGTGGTGCTCGAGTTAACGGTTGTA GAATTGGGATGA-3′。
以黄颡鱼cDNA为模版, 以PfLC3B-R/F引物,对PfLC3B基因进行PCR扩增, PCR产物于1%琼脂糖凝胶电泳检测, 并进行PCR产物回收、纯化。以黄颡鱼cDNA为模版, 以B-F/R引物, 对PfBeclin1基因全长进行PCR扩增; 以上述PCR产物为模版, 以PfBeclin1-F/R引物, 进行PCR扩增, PCR产物于1%琼脂糖凝胶电泳检测, 并进行PCR产物回收、纯化。将pET-32a(+)质粒用EcoR Ⅰ和XhoⅠ限制性内切酶进行双酶切, 采用CloneExpress Ⅱ One Step Cloning Kit将PfLC3B和PfBeclin1基因连接至pET-32a(+)载体中。将原核表达载体转化至DH5α大肠杆菌中, 以pET-32a(+)通用测序引物(T7: 5′-TAATACGACTCACTATAGGG-3′和T7t: 5′-GCTA GTTATTGCTCAGCGG-3′)进行PCR菌落鉴定和武汉擎科测序。
重组PfLC3B和PfBeclin1蛋白表达和纯化将测序正确的重组表达载体分别转化至E. coliRosetta(DE3)大肠杆菌中, 挑取经菌落PCR鉴定阳性的菌落, 接种至5 mL含有AMP的LB培养基中于37℃、200 r/min培养至OD≈0.6, 加入IPTG至终浓度分别为0、0.2、0.4、0.6、0.8、1.0 mmol/L, 16℃、200 r/min诱导表达过夜。收集诱导表达的菌体, 经SDS-PAGE鉴定成功表达后, 对菌体进行高压破碎,4℃、12000 r/min离心30min分别收集上清和沉淀并进行SDS-PAGE鉴定。
经SDS-PAGE鉴定后, 如果重组蛋白表达在上清中, 利用Ni-NTA镍离子亲和层析进行纯化。参照生工生物Ni-NTA纯化树脂预装柱操作说明进行,纯化后的重组蛋白进行SDS-PAGE鉴定。
如果重组蛋白表达在沉淀中, 利用包涵体纯化重组蛋白。包涵体纯化步骤: a. 沉淀使用20 mL buffer A(50 mmol/L Tris-HCl, 5 mmol/L EDTA, pH 8.0)充分悬起, 混匀。4℃离心12000 r/min、20min,去除上清; 重复一次。b. 沉淀用20 mL buffer B(50 mmol/L Tris-HCl, 5 mmol/L EDTA, 2 mol/L脲,pH 8.0)充分悬起, 混匀。4℃离心12000 r/min、20min, 去除上清; 重复一次。c. 1%的Triton X-100分别洗涤, 4℃离心12000 r/min、20min, 去除上清; 重复一次。d. 沉淀用20 mL buffer(0.1 mol/L Tris-HCl, 10 mmol/L DTT, 8 mol/L脲, pH 8.0)充分悬起, 混匀。置于37 ℃恒温摇床上200 r/min快速震荡1h。4℃离心12000 r/min、10min, 保留上清, 去除沉淀。e. 上清装入透析袋中, 置于1 L透析液(0.1 mol/L Tris-HCl, 5 mmol/L EDTA, 5 mmol/L Cysteins, pH 8.0)中, 4℃下透析16h以上。f. 透析袋置于新透析液(1 L)中, 4℃下透析16h以上。4℃离心12000 r/min、10min, 保留上清, 去除沉淀。纯化后的蛋白经超滤离心管浓缩后进行SDS-PAGE鉴定。
鼠抗PfLC3B和PfBeclin1多克隆抗体的制备将纯化的重组PfLC3B和PfBeclin1蛋白分别与等量的完全弗氏佐剂混合, 充分乳化后, 经多点皮下注射免疫小鼠。每隔2周加强免疫1次, 使用同样剂量的重组蛋白和等量的不完全弗氏佐剂充分乳化后进行免疫, 共免疫3次。第3次免疫7d后, 眼球取血, 4℃静置24h, 5000 r/min离心30min, 吸取抗血清。
细胞培养及处理采用0.25%胰蛋白酶消化的方法分离黄颡鱼原代肝细胞, 并用T25细胞瓶培养黄颡鱼原代肝细胞, 培养条件: DMEM培养液, 含有链霉素(100 ng/mL), 青霉素(100 U/mL)和胎牛血清(5%,v/v)。以终浓度为100 nmol/L的雷帕霉素处理肝细胞, 设置未处理的肝细胞为阴性对照, 48h后收集细胞样品。
动物组织和细胞总蛋白提取分别取黄颡鱼肾脏、肝脏和脾脏组织各0.5 g, 以及上述细胞样品, 用RIPA裂解液提取总蛋白, 经BCA法测定蛋白浓度后, 加入SDS上样缓冲液, 煮沸5min, 于1000×g离心5min, 取上清进行Western blot检测。
Western blot检测分别将处理后的重组蛋白样品、细胞蛋白样品或者黄颡鱼组织蛋白样品经SDS-PAGE电泳后, 置湿转电转仪(Bio-Rad, 美国)转印至PVDF膜上, 用5%脱脂奶粉37℃封闭2h,一抗(鼠多抗PfLC3B、PfBeclin1或兔多抗GAPDH)4℃孵育过夜。TBST洗膜3次, 每次5min, 加入HRP标记的的IgG(鼠抗或兔抗, 1:4000稀释), 37℃孵育45min, TBST洗膜3次, 每次5min, 采用ELC化学发光法检测并拍照。
2 结果
2.1 黄颡鱼LC3B和Beclin1基因的克隆
根据已有转录组序列, 找到PfLC3B序列和Pf-Beclin1序列。以黄颡鱼肝脏cDNA作为模版, 进行RT-PCR, 分别扩增得到PfLC3B和PfBeclin1目的片段。利用1%琼脂糖凝胶电泳进行检测, 可见约为372 bp (图 1A)和1344 bp (图 1B)的条带。
2.2 重组PfLC3B和PfBeclin1蛋白的表达和纯化
将测序正确的p E T 3 2 a(+)-P f L C 3 B和pET32a(+)-PfBeclin1重组表达载体转化至E. coliRosetta(DE3)表达菌株中, 在经过16℃不同浓度IPTG诱导重组蛋白表达。SDS-PAGE结果显示, 相对于未经IPTG诱导的E. coliRosetta(DE3)大肠杆菌, 经过IPTG诱导后, 分别在约32 kD (图 2A)和70 kD(图 2B)处出现特异性目的条带, 即重组PfLC3B和PfBeclin1蛋白。在不同浓度IPTG诱导后, 重组PfLC3B和PfBeclin1蛋白表达量并没有发生显著性变化, 所以本实验将PfLC3B和PfBeclin1的IPTG诱导浓度定为0.1 mmol/L。诱导后的E. coliRosetta(DE3)大肠杆菌经过高压破碎后, SDS-PAGE结果显示, 重组PfLC3B蛋白大部分表达于上清中, 而重组PfBeclin1蛋白大部分表达于包涵体中。所以重组PfLC3B蛋白纯化采用Ni-NTA亲和层析的方式,重组PfBeclin1蛋白纯化采用包涵体纯化方式进行。经过SDS-PAGE分析, 两种纯化方式分别得到了纯度较高的重组PfLC3B和PfBeclin1蛋白。
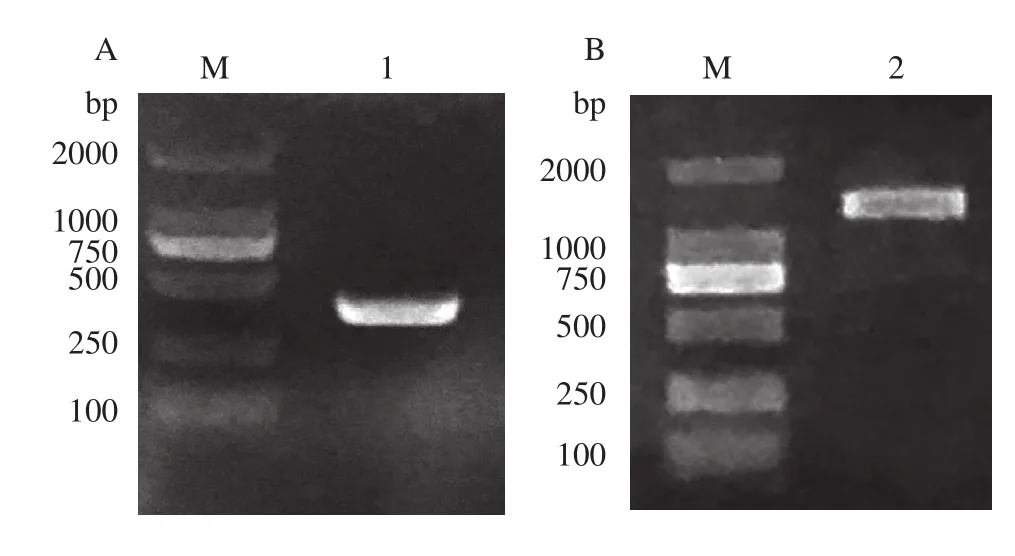
图1 PfLC3B和PfBeclin1基因的PCR扩增结果Fig. 1 PCR amplification of PfLC3B and PfBeclin1 genes

图2 重组PfLC3B和PfBeclin1蛋白的表达和纯化的SDSPAGE分析Fig. 2 SDS-PAGE analysis of expressed and purified recombinant PfLC3B and PfBeclin1 protein
2.3 Western blot检测
经过3次免疫后, 获得鼠源PfLC3B和PfBeclin1抗血清。利用Western blot检测制备的多克隆抗体的特异性, 鼠源PfLC3B抗体可以特异性识别重组PfLC3B蛋白(图 3A), 鼠源PfBeclin1抗体可以特异性识别重组PfBeclin1蛋白(图 3B)。
由于LC3A和LC3B蛋白具有较高的同源性, 且缺乏直接验证抗体特异性实验证据, 故不能排除黄颡鱼LC3B抗体与LC3A和LC3B发生交叉反应的可能。为进一步验证鼠抗PfLC3B和PfBeclin1抗体是否能识别黄颡鱼内源性LC3和Beclin1蛋白, 我们用雷帕霉素处理黄颡鱼原代肝脏细胞诱导细胞自噬,western blot结果显示(图 4), PfLC3B抗体能同时识别LC3-Ⅰ和LC3-Ⅱ, 雷帕霉素处理组LC3-Ⅱ表达量较对照组有明显升高, LC3-Ⅱ/GAPDH比值升高,自噬水平增强, 说明制备的PfLC3B抗体可以用于检测黄颡鱼LC3蛋白; 雷帕霉素处理组Beclin1表达量较对照组有一定水平的升高, 说明制备的PfBeclin1抗体可以识别黄颡鱼Beclin1蛋白。PfLC3B和PfBeclin1抗血清可以用于自噬的检测。
用PfLC3B和PfBeclin1抗血清检测黄颡鱼肾脏、肝脏和脾脏组织中的LC3和Beclin1蛋白表达水平(图 5)。LC3在肝脏组织中表达量明显高于肾脏和脾脏, 并且主要以LC3-Ⅰ形式存在。Beclin1在肝脏中表达量也是最高, 在肾脏和脾脏中有少量表达。

图3 Western blot检测重组PfLC3B和PfBeclin1蛋白Fig. 3 Detection of recombinant PfLC3B and PfBeclin1 protein using Western blotting

图4 Western blot检测内源性LC3和Beclin1蛋白Fig. 4 Western blot detection of endogenous LC3 and Beclin1 proteins
3 讨论
LC3是公认的自噬标志蛋白, 在自噬过程中参与自噬体的形成[4,12], 在LC3的4种亚型中, LC3B应用最为广泛。在LC3合成后, LC3前体经过Atg4在C段切割形成LC3-I, 并在C末端暴露出一个甘氨酸残基。LC3-I与磷脂酰乙醇胺通过泛素样酶促反应,形成膜结合型LC3-II[13]。Beclin1作为调节自噬的关键基因, 可以与许多蛋白互作形成蛋白复合体,从而调节自噬小体的形成[6]; 同时, 其他许多蛋白也可以与该复合体相互作用, 形成一个复杂的蛋白复合物, 从而调节自噬过程[14—16]。

图5 Western blot检测黄颡鱼LC3和Beclin1组织分布Fig. 5 Western blot analysis of LC3 and Beclin1 in different tissue lysates
本研究首次对黄颡鱼LC3B、Beclin1基因分别进行原核表达, 并制备多克隆抗体。本实验选择含有T7启动子的pET32a(+)作为表达载体, 其可以充分利用大肠杆菌内的资源用于表达目的蛋白[17]。经过IPTG诱导表达后, 重组PfLC3B和PfBeclin1蛋白表达量均较高, 重组PfLC3B蛋白是以有活性的可溶性形式存在, 而重组PfBeclin1是以没有活性的包涵体形式存在, 两种形式的重组蛋白均具有较好的免疫原性。通过3次免疫Balb/C小鼠获得的鼠源PfLC3B和PfBeclin1抗体分别可以特异性识别重组PfLC3B和PfBeclin1蛋白, 表明抗体制备成功。
黄颡鱼LC3A基因编码121个氨基酸,LC3B基因编码123个氨基酸, 并且LC3A和LC3B氨基酸序列具有83%的同源性。类似于哺乳动物, LC3A和LC3B均含有LC3家族的识别位点, 由于制备抗体的抗原是重组黄颡鱼LC3B全长蛋白, 理论上PfLC3B抗体可以与LC3A和LC3B发生交叉反应。由于LC3家族的高保守性, LC3B抗体的交叉反应在商品化抗体中也是普遍存在的, 例如, Zhong等[18]研究中的LC3B抗体(Cell Signaling, 3868S)可与其他LC3蛋白发生交叉反应。本文中的LC3B抗体为多克隆抗体, 不是单克隆抗体, 故不一定是特异性的, 故不能排除制备的鼠源LC3B抗体与LC3A和LC3B发生交叉反应的可能。Western blot检测证明PfLC3B抗体能够识别LC3-I和LC3-II两种蛋白。Western blot检测雷帕霉素处理的黄颡鱼原代肝脏细胞中LC3-Ⅱ蛋白表达量明显增加, 证明了自噬的发生。Western blot检测证明PfBeclin1抗体能够识别Beclin1蛋白, PfBeclin1蛋白表观分子量为56 kD, 与预测分子量52 kD有一定偏差, 推测可能与蛋白修饰有关。
用鼠抗PfLC3B和PfBeclin1抗血清对黄颡鱼肾脏、肝脏和脾脏组织进行Western blot检测, LC3和Beclin1均在肝脏组织中有较高表达, 在肾脏和脾脏总表达水平较低。肝脏中LC3主要以LC3-Ⅰ的形式存在, 肾脏和脾脏中未见明显LC3目的条带, 胞质型LC3-Ⅰ在面临应激情况下转化成膜型LC3-Ⅱ形成自噬体产生自噬, 肝脏中LC3-Ⅰ较肾脏和脾脏表达量较高, 我们推测, 机体面临应激时肝脏中LC3-Ⅰ可以迅速向LC3-Ⅱ转化, 形成自噬体产生自噬以维持自身代谢稳态。而肝脏中Beclin1蛋白表达较肾脏和脾脏高意味肝脏具有更强的自噬调节能力, 当机体生存环境发生变化, 例如在饥饿等胁迫条件下, Bcl-2或Bcl-2XL从Beclin-1蛋白质上解离下来, 从而迅速诱导自噬发生[16]。肝脏中的大量代谢过程与自噬有关, 例如蛋白质降解、脂肪代谢等,当机体面临生存环境胁迫时, 例如饥饿等, 诱导肝脏自噬以维持自身代谢稳态[19]。
本研究成功得到可溶性重组PfLC3B和PfBeclin1蛋白, 并采用弗氏佐剂作为免疫增强剂[20], 经过3次免疫后获得可以特异性识别重组PfLC3B和PfBeclin1蛋白的多克隆抗体, 鼠抗PfLC3B和PfBeclin1抗体可以分别特异性识别内源性黄颡鱼PfLC3和Beclin1蛋白, 为后续深入研究黄颡鱼自噬的发生过程和调控机制奠定基础。
