不同性别PyMT自发性乳腺癌小鼠成瘤特点和不同时间肺转移观察
2019-11-26郎佳丽金璐邵霞曹贝贝严楷蕾傅惠英寿旗扬
郎佳丽金璐邵霞曹贝贝严楷蕾傅惠英寿旗扬
1.浙江中医药大学药学院 杭州 310053 2.浙江中医药大学第二临床医学院 3.湖州市中心医院
在女性癌症发病率中,乳腺癌的发病率是首屈一指的[1]。虽然治愈率较高,但仍是重要的致死因素。因此如何进一步研究乳腺癌靶向药物、药物作用的机理及相应的临床治疗手段日益受到广泛重视[2]。在研究乳腺癌的发病机制、生物学特征、药物及治疗方法中,乳腺癌动物模型功不可没。在生物学、病理学和组织学上越贴近人乳腺癌指标的动物模型,提供的实验结果越是客观准确[3-4],其应用范围就越广泛[5]。
目前已建立了多种乳腺癌模型,如诱发性、移植性、自发性以及乳腺癌转基因实验动物模型[6]。但诱发性和移植性乳腺癌模型在实验过程中具有明显的缺点:诱导乳腺肿瘤模型其乳腺癌性质和发病程度受脂肪消耗的影响,同时存在建模耗时长、癌症发生率不高及转移性低等多种弊端[7-9]。相比之下,以小鼠乳腺肿瘤病毒启动子(mouse mammary tumor virus,MMTV)控制下表达多瘤中间T抗原(polyoma middle T-antigen,PyMT)的转基因自发性乳腺癌小鼠具有与人体肿瘤病理相似、试验周期短、癌症自发率良好、成瘤时间短和试验现象明显[10-12]等客观优点而被选为研究乳腺癌的经典模型。故本实验采用MMTV-PyMT乳腺癌转基因小鼠为研究对象来观察在完整生命周期内不同性别、不同周龄下的癌症发展过程与病理变化指标,以研究该模型的客观规律,为乳腺癌药物筛选及治疗方法更新提供研究思路。
1 材料
1.1 实验动物 MMTV-PyMT转基因小鼠购自美国Jackson实验室,品系名为FVB/N-Tg(MMTV-Py VT)634Mul/J。保种培育后,选取SPF级雌性PyMT小鼠10只,雄性PyMT小鼠5只,雌性FVB小鼠5只,共20只(15雌,5雄),均为8周龄,饲养于浙江中医药大学动物实验研究中心屏障实验室[(浙)2013-0184];环境温度:(22±1)℃;相对湿度 50%~60%;光照 12小时明暗交替;噪音:<50dB;小鼠饲养于IVC中,自由饮食;在实验过程中遵循3R原则给予实验动物人道主义关怀。
1.2 仪器及试剂
1.2.1 主要仪器 Bayer2120全自动血液细胞分析仪(德国西门子公司),PCR仪(美国Bio-Rad伯乐),Tanon-2500全自动数码凝胶图像分析仪(上海天能科技有限公司),ASP200S全自动脱水机、半自动切片机(德国Leica公司),AP280-2包埋机(德国MICROM公司),NanoZoomer 2.0 RS数字切片扫描仪(日本滨松光子公司)。
1.2.2 主要试剂 Taq 酶、dNTP Mixture、MgCl2、5×buffer、DNA marker、6×loading buffer等均购自 Takara公司,Biowest琼脂糖粉购自北京艾普立邦科技有限公司,Gelreg凝胶核酸染料购自美国BIOTIUM公司。
1.3 方法
1.3.1 保种及扩群 从Jackson实验室购买的乳腺癌MMTV-PyMT转基因雄性小鼠即转基因PyMT小鼠(+)与正常雌性小鼠FVB(-)合笼配种,通常1:2比例杂交。子代剪尾提取DNA,提取小鼠DNA后,进行PCR扩增,引物序列分别为:5'-CAA ATG TTG CTT GTC TGG TG-3':5'-gTC AGTCGA GTG CAC AGT TT-3':5'-GGA AGC AAG TACTTC ACA AGG g-3':5'-GGA AAG TCA CTA GGAGCA GGG-3'。反应条件为:94℃变性 2min;94℃ 20s,64℃ 1min,72℃ 1min,35个循环;72℃ 2min充分延伸,扩增产物为556bp。基因型鉴定后,选取雄性PyMT小鼠与雌性FVB小鼠全同胞兄妹交配,进行扩群,继续通过以上鉴定方法筛选实验小鼠。
1.3.2 一般观察 每天观察雄性与雌性PyMT小鼠的肿瘤是否长出,记录肿瘤发病时间;每周记录体重变化,并用小鼠游标卡尺测量肿瘤大小,观察肿瘤生长趋势、特征的变化。瘤体积计算:V=(长径×短径2)/2。
1.3.3 雄性与雌性小鼠生存率及生存时间比较 每天观察雄性与雌性PyMT小鼠的精神状态与肿瘤生长情况,且观察是否有死亡情况并记录其自然死亡时间。
1.3.4 血常规检测 观察雌性MMTV-PyMT小鼠肿瘤生长8周后,利用CO2实行安乐死。心脏取适量血液于2ml抗凝管中,血常规检测42项指标,对其中以下7项指标进行比较:白细胞(white blood cell,WBC)、淋巴细胞(lymphcyte,LYMPH)、嗜酸性粒细胞(eosinophils,EOS)、嗜碱性粒细胞(basophil granule,BASO)、中性粒细胞(granulocyte,NUET)、单核细胞(monocyte,MONO)和未染色大细胞(large unstained cell,LUC)数量。
1.3.5 病理检测 PyMT雌性小鼠与FVB雌性小鼠分别观察4周、8周后,取完整肺观察拍照,保存于10%甲醛溶液中,过夜固定,48h后取材,进行常规的脱水包埋后,用石蜡切片机将蜡块切成4μm的薄片,进行苏木素-伊红(hematoxylin-eosin staining,HE)染色,用NanoZoomer数字切片扫描仪对切片进行成像扫描,并用NDP.view软件分析其病理变化。
1.4 统计学方法 所有数据以平均数±标准误(±standard errors of mean,SEM)表示,用 SPSS 22.0 软件进行统计分析,两样本间采用t检验,以P<0.05表示差异具有统计学意义,P<0.001表示差异具有高度统计学意义。
2 结果
2.1 MMTV-PyMT转基因小鼠基因型鉴定图 经聚合酶链式反应(polymerase chain reaction,PCR)扩增后,加入 2μL 6×loading buffer,混匀,上样 10μL 于1.5%琼脂糖凝胶上样孔中,电泳30min后,结果如图1中所示,MMTV-PyMT阳性小鼠基因检测条带为556bp,由此推断样本2、4和9均为MMTV-PyMT阳性小鼠,样本 1、3、4、5、6、7、8 和 10 无条带,为MMTVPyMT阴性小鼠即FVB小鼠。
2.2 雌性与雄性鼠肿瘤生长趋势比较 如图2B、2D中所示,乳腺癌MMTV-PyMT转基因小鼠无论雌雄均会自发性出现肿瘤。雌性小鼠组在第8周出现可扪及的肿瘤,雄性组则在第18周出现可扪及的肿瘤,雌性小鼠出现肿瘤时间远早于雄性小鼠,且雌性小鼠模型组肿瘤发展速度较雄性鼠快。随着时间的推移,肿瘤的体积逐渐增大,数目增多。如图2A、2C所示,两组体重均呈现稳定增长的趋势。
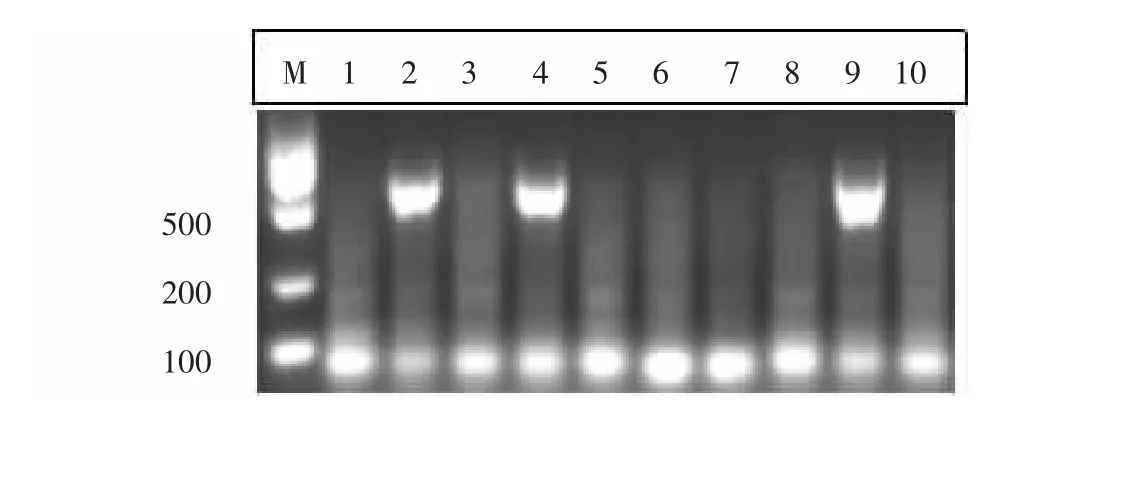
图1 MMTV-PyMT转基因小鼠基因型鉴定图Fig.1 Genotypic identification of MMTV-PyMT mice

图2 乳腺癌MMTV-PyMT小鼠肿瘤生长情况与体重变化Fig.2 Changes of tumor growth and body weight of MMTV-PyMT mice
2.3 雌性与雄性鼠生存率及生存时间比较 如图3所示,在观察雄性与雌性小鼠生存率和生存时间的实验中,雌鼠最早死亡发生在16周,于第20周全部死亡,而雄鼠组最早死亡发生在38周,于第46周全部死亡。
2.4 雌性MMTV-PyMT与FVB小鼠血常规指标比较 在雌性MMTV-PyMT与FVB小鼠血常规指标比较中,如图4A中所示,雌性PyMT的 WBC数量明显高于FVB小鼠,差异有统计学意义(P<0.001)。白细胞分类中,如图4B、4C、4F、4G中所示,PyMT小鼠的 NUET、LYMPH、BASO及 LUC数量均明显高于FVB 小鼠,差异有统计学意义(P<0.001)。如图 4E、4D中所示,PyMT小鼠的EOS也显著高于FVB小鼠,差异有统计学意义(P<0.05),而 PyMT 小鼠的 MONO 数量高于FVB小鼠,但差异无统计学意义(P>0.05)。
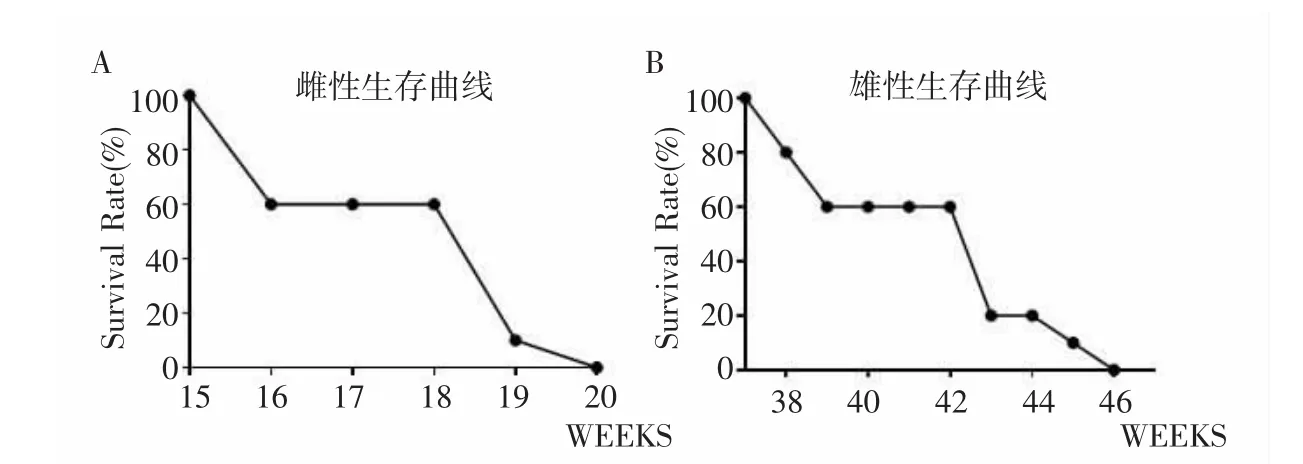
图3 雌性与雄性鼠生存时间比较Fig.3 Comparison of survival time between female and male mice

图4 雌性MMTV-PyMT与FVB小鼠血常规指标比较Fig.4 Comparison of blood routine indexes between MMTV-PyMT and FVB of female mice
2.5 肿瘤肺转移情况 如图5所示,FVB小鼠肺部表面平整边缘光滑,颜色淡红色无异常充血;PyMT小鼠16周时肺部表面出现若干卵石状分布且充血暗红的瘤体,说明该小鼠肺部出现严重的肿瘤转移。
如图6所示,肺HE染色结果显示PyMT小鼠12周龄时肺泡结构部分被破坏,肺组织中大量炎症细胞浸润,气管璧增厚,某些小鼠开始出现肺转移。PyMT小鼠16周龄时肺组织出现严重的肺转移,出现弥漫性分布,大小不等、质实、染色深的癌巢,呈非典型增生,导管受压变窄,细胞间推挤或重叠,细胞大小形态不同,偶尔可见核分裂现象;肿瘤细胞排列紊乱,失去正常的结构和层次,胞核增大,核分裂增多。
3 讨论
在小鼠乳腺癌病毒(mouse mammary tumor virus,MMTV)的转录控制下,特异性表达活化的neu酪氨酸激酶长链重复(long terminal repeat,LTR),形成于整个乳腺上皮细胞有关的腺癌[15]。影响neu酪氨酸激酶活性的另一因素是多瘤病毒(polyoma virus,PyV)中的T抗原。新生小鼠感染PyV会导致大量上皮细胞和间质肿瘤的形成,其中乳腺癌占据相当大比例。将上述两个基因融合整合到小鼠的基因组中,即为乳腺癌MMTV-PyMT转基因小鼠的建立[16]。乳腺上皮中PyMT中T癌基因转化特性的分析提供了对恶性进展过程的重要启示。在四种独立的MMTV/中T转基因小鼠中,转基因的表达最终导致了乳腺上皮的形态转化,进一步证实了乳腺中T抗原的潜在致癌潜力。
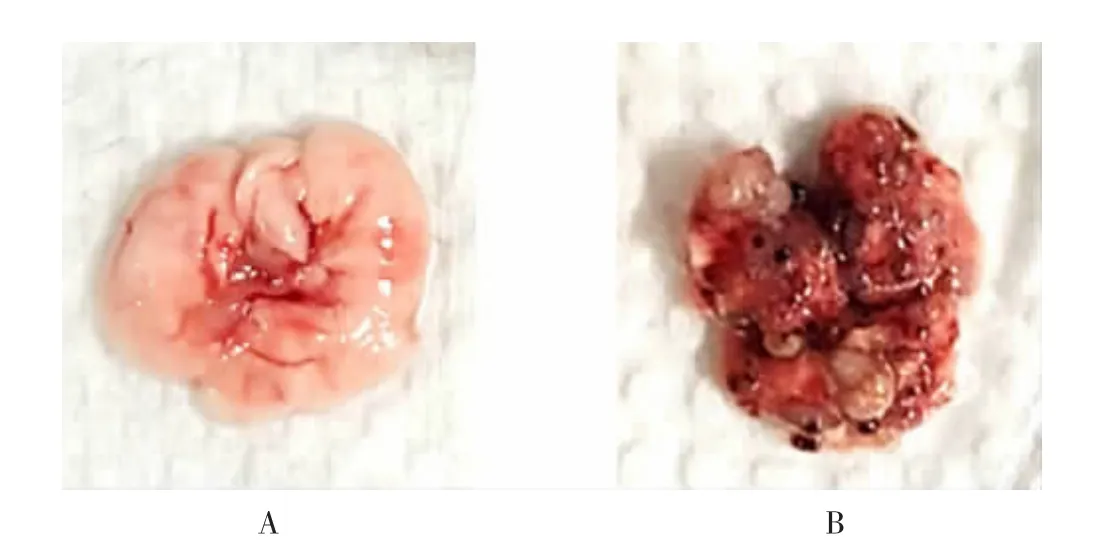
图5 乳腺癌MMTV-PyMT小鼠肺部观察(100×)Fig.5 Observation of lung tissue in MMTV-PyMT mice(100×)
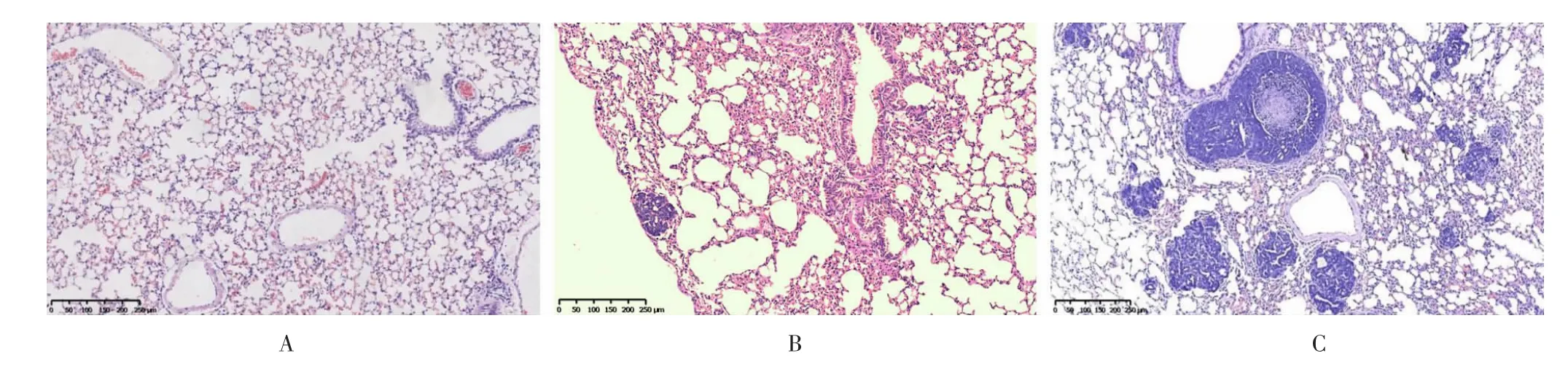
图6 乳腺癌MMTV-PyMT小鼠肺组织HE染色图(100×)Fig.6 HE staining of lung tissue in MMTV-PyMT mice(100×)
本实验在乳腺癌MMTV-PyMT转基因小鼠完整生命期中,系统地观察记录肿瘤的发生、发展和转移。雌性PyMT小鼠约在第8周开始出现可测量的肿瘤,随着小鼠周龄的增加,小鼠体重逐渐增大,同时小鼠的瘤数目与瘤体积同样呈现出上升的趋势,且实验结果显示15周时瘤鼠开始出现死亡,到20周小鼠全部死亡。而雄性鼠约在第18周开始出现可测量的肿瘤,比雌性鼠发病时间晚,生存时间长,导致实验周期长,因此较雄性PyMT小鼠而言,雌性PyMT小鼠是研究乳腺癌发展及转移良好的动物模型。
白细胞分为颗粒细胞与无颗粒细胞,颗粒细胞包括中性粒细胞、嗜酸性细胞及嗜碱性细胞,无颗粒细胞包括单核细胞与淋巴细胞。中性粒细胞与巨噬细胞是炎症反应的主要驱动者。中性粒细胞除了释放细胞因子和趋化因子,还能促进肿瘤生长和侵袭[17]。已有文献证明乳腺癌组织中有嗜酸性粒细胞浸润[18]。单核细胞释放到组织中成为巨噬细胞,肿瘤相关巨噬细胞可使肿瘤细胞免受CD8+细胞杀伤[19]、维持免疫抑制微环境[20]、减少抗原递呈和阻碍T细胞增殖[21]。淋巴细胞可识别肿瘤细胞表面抗原,其数量的增加或与肿瘤细胞入侵有关。本实验血常规检测中发现,雌性PyMT小鼠白细胞及亚群(除单核外)数量均明显高于FVB小鼠,产生明显的炎症反应,导致这种结果的原因可能是肿瘤感染或者是肿瘤细胞不可控地分泌一些激素或者因子,促进白细胞的生成或抑制其凋亡等,但越来越多的实验结果证实炎症促进肿瘤的发生与转移,肿瘤微环境可趋化募集巨噬细胞、粒细胞以及白细胞等[22-23]。
雌性PyMT小鼠12周龄及16周龄肺部病理切片也显示在肿瘤细胞侵袭肺部时会募集大量的炎症细胞浸润肺部组织,其中雌鼠12周时肿瘤细胞入侵肺部,而16周时已检测到发生明显的肺转移,有文献报道11周左右开始出现肺转移瘤,已有多篇文章报道此种自发性乳腺癌出现肺转移现象[24-25],与本实验结果一致。
综上所述,虽然乳腺癌MMTV-PyMT转基因小鼠发病机制与人体的发病机制有所不同,但其自然的发病过程与人体相似,可从动物、细胞、分子等不同层面了解乳腺癌,是筛选抑制肿瘤细胞浸润、转移等药物良好的乳腺癌模型。在多方面可为临床研究乳腺癌的发病机理提供思路,同时在预防、治疗乳腺癌疾病上有一定参考意义。本研究与其他文献不同之处在于从乳腺癌模型实验动物性别选择的角度出发,乳腺癌MMTV-PyMT转基因雌性小鼠相较于雄性小鼠发病早、转移快、生存周期短,有利于节省实验时间及物资,大力度筛选高效抗肿瘤药物,同时也减少了乳腺癌自发性模型肿瘤发生、转移、死亡等关键时间点的偏差。此外,乳腺癌MMTV-PyMT转基因雌性小鼠和普通FVB小鼠比较,血液中白细胞总数及白细胞各个不同分类细胞数量均有上升,说明肿瘤与炎症反应密不可分;比较乳腺癌MMTV-PyMT转基因雌性小鼠12周龄及16周龄肺部病理结果,也可以观察到在肿瘤细胞侵袭肺部组织时产生的炎症反应,为该模型肿瘤发生及肺转移观察提供参考。
