环氧乙烷生产过程中银催化剂部分转化为AgCl的热力学
2019-11-22苏海霞史建公尹国海桂建舟顾松园
苏海霞, 史建公, 任 靖, 尹国海, 桂建舟, 顾松园
(1.天津工业大学 材料科学与工程学院,天津 300387;2.中国石化 催化剂有限公司工程技术研究院,北京 101111;3.中石化催化剂(北京)有限公司,北京 102400;4.中国石化催化剂有限公司,北京 100029)
在银催化剂作用下,乙烯与氧气进行气相氧化反应是目前工业上制备环氧乙烷(EO)的主要方法。在乙烯氧化生成目标产物EO的过程中,会有一系列副反应发生。这些副反应不仅关系到反应的选择性,更影响反应温度的控制。一旦副反应得不到有效控制,反应系统温度就会失控,甚至“飞温”,影响装置的安全,并加速催化剂的失活。
为了有效控制乙烯氧化反应的温度、提高EO的选择性,需要注入一定浓度的有机氯化物作为抑制剂来抑制副反应的发生。常用的抑制剂有1,2-二氯乙烷(EDC)、氯乙烷、氯乙烯等,目前,国内外大部分EO生产厂家都采用1,2-二氯乙烷作为抑制剂。研究表明,在乙烯氧化制EO反应系统中添加适量有机氯化物,如1,2-二氯乙烷,可改变银催化剂的表面吸附性能,有利于吸附氧与乙烯发生选择性氧化,提高EO选择性。然而,随着1,2-二氯乙烷的加入,少量银催化剂也会缓慢转化为AgCl[1]。目前,关于银催化剂与1,2-二氯乙烷作用生成AgCl反应的热力学或动力学研究未见报道。因此,开展对Ag与1,2-二氯乙烷反应的研究,不仅填补了对二者反应条件、反应热力学及反应动力学研究的空白,也有利于优化EO的生产工艺,提高反应的选择性。
为了研究Ag与1,2-二氯乙烷的反应及其热力学过程,首先需要确定该反应的方程式,了解1,2-二氯乙烷的裂解形式及裂解产物。1,2-二氯乙烷的裂解有热裂解和催化裂解两种形式。1,2-二氯乙烷在723~823 K时进行热裂解是制氯乙烯最常用的方法[2]。同时,在催化剂存在的情况下,1,2-二氯乙烷也会在较低温度下发生催化裂解反应。Arthur等[3]以氯化钡为催化剂,在温度为488~508 K时裂解制备氯乙烯,但催化剂寿命较短。Isao等[4]用一种聚丙烯腈基活性炭(PAN-ACF)为催化剂,在573~623 K制备氯乙烯,催化剂寿命仅为100 h[5]。以活性炭为催化剂,在573~673 K制备氯乙烯,1,2-二氯乙烷转化率最高可达99%。Malvina等[6]将纳米级活性炭涂在管式反应器内壁,在493~563 K裂解1,2-二氯乙烷制备氯乙烯。
笔者在简要分析乙烯氧化制环氧乙烷反应热力学和1,2-二氯乙烷热裂解反应机理的基础上,深入分析了1,2-二氯乙烷在EO生产过程中的作用;并根据Ag与1,2-二氯乙烷反应生成AgCl的事实,构建了Ag与1,2-二氯乙烷反应生成AgCl的反应,分析了该反应的热力学,为进一步深入研究该反应的动力学提供参考。
1 乙烯氧化制环氧乙烷反应体系热力学的分析
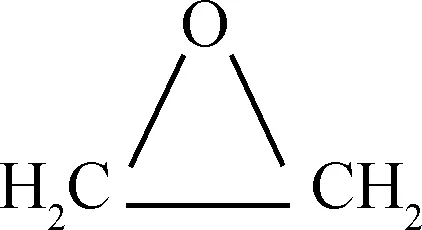
乙烯氧化生成EO的反应过程如反应式(1)~(6)所示。
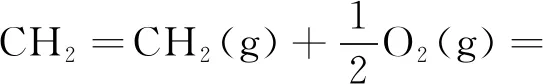
(1)
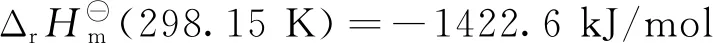
(2)
(3)
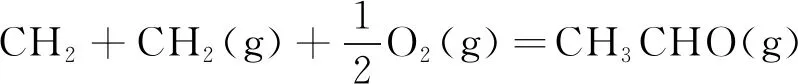
(4)
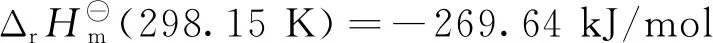
(5)
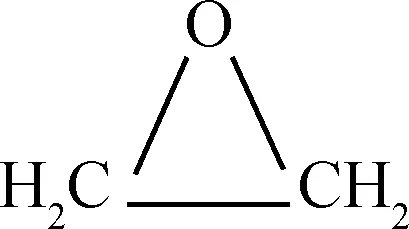
(6)
由式(1)可知,乙烯发生氧化反应时,C=C双键中的1个π键转化为2个C-O σ键,属于强放热反应。在生成目标产物EO的过程中,有一系列副反应发生,如式(2)和式(3)中乙烯和EO的完全氧化反应。在标准状态下,这两个完全氧化反应的反应热分别为主反应的13.48倍和12.48倍,因而从热力学上讲这些副反应更容易进行。此外,乙烯还可以氧化生成甲醛和乙醛,如式(4)和式(5);环氧乙烷可以异构生成乙醛,见式(6)。这些副产物是影响EO水合产物-乙二醇产品质量的主要原因。
2 1,2-二氯乙烷裂解反应分析
2.1 热裂解
1,2-二氯乙烷的热解机理一般是按自由基链式反应进行。首先为链的引发,即在活化中心上生成不均匀链,热裂解反应方程式如式(7)所示。
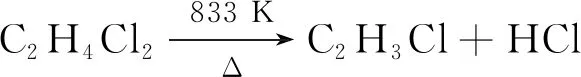
(7)
其次为链的发展和传递,反应式如式(8)~式(11)所示[7]。
(8)
(9)
(10)
(11)
式(8)反应为自由基生成反应,是反应速率的控制步骤;式(9)和式(10)反应为主体反应,不断循环生成氯乙烯和HCl,但自由基总数不变;式(11)为自由基终止反应。严格地说,只有式(8)反应才是化学意义上的热裂解反应,其余反应均为自由基反应。
2.2 催化裂解
张志祥等[8]的研究发现,1,2-二氯乙烷在银催化剂上473 K时已完全分解,但在α-Al2O3载体上直至 533 K仍不分解。这说明1,2-二氯乙烷在银催化剂上的反应过程是催化分解,而不是热分解;Ag可以作为1,2-二氯乙烷分解的催化剂。同时,1,2-二氯乙烷在Ag催化下分解产生氯原子,氯原子会以强吸附和弱吸附两种状态吸附在催化剂上。其中,强吸附态的氯与催化剂中较活泼的Ag作用生成AgCl;弱吸附态的氯在反应温度下与乙烯作用会生成新的1,2-二氯乙烷。1,2-二氯乙烷在反应状态下存在着分解消耗与反应生成两个过程。当这两个过程达到平衡时,维持了催化反应的稳定进行[9]。
因此,在乙烯氧化制备EO的反应中加入1,2-二氯乙烷,其结果是:一方面发生热解反应生成自由基,抑制了乙烯氧化过程中副反应的发生,控制了反应温度,提高了EO的选择性;另一方面在Ag催化下发生催化热解生成氯,促进了AgCl的生成,加速了催化剂的失活。
3 银催化剂上1,2-二氯乙烷裂解反应的热力学分析
3.1 Ag与1,2-二氯乙烷的反应分析
在银催化剂表面上,1,2-二氯乙烷解离形成两种吸附态的氯:强吸附氯和弱吸附氯[1]。强吸附态的氯形态稳定、难以迁移;弱吸附态的氯可以在银催化剂表面自动迁移,并降低Ag的电子输出能。催化剂表面上吸附的氯占据了Ag表面的活泼位置,一方面破坏了相邻Ag原子呈偶数对分布的状态,减小了解离吸附氧的产生几率;另一方面提高了Ag原子的功函数(功函数是把一个电子从固体内部移至固体表面所需的最低能量),使不成偶数对的孤Ag原子增多,有利于提高反应的选择性[10-14]。同时,强吸附态的氯与高度分散的Ag原子相互作用会生成AgCl;AgCl在较高温度下会分解成Ag和Cl。这种反应持续循环进行,会导致Ag颗粒的迁移和长大,从而影响银催化剂的活性、选择性和寿命,导致银催化剂失活。研究表明,在乙烯氧化反应体系中,可以检测出氯乙烯;在失活的催化剂中,也可以检测到AgCl[13]。虽然催化剂不同,生成AgCl的速率不同,但根据2.1节的分析及反应的实际结果,得到Ag与1,2-二氯乙烷反应的方程式,如式(12)所示。
2Ag(s)+2C2H4Cl2(g)→2AgCl(g)+
2C2H3Cl(g)+H2(g)
(12)
此外,为保证反应安全可控,需要在乙烯氧化反应体系中加入摩尔热容大的惰性气体,称为致稳气(工业上的通用说法)。致稳气的加入既可以提高装置的安全性、稳定性,又可以提高EO选择性,降低原料消耗[15]。当工业生产以甲烷为致稳气时,反应中检测到的氯化物主要有氯乙烯、氯乙烷和氯甲烷。
3.2 反应体系各物质的热力学参数
以式(12)反应为研究对象,考察银催化剂与1,2-二氯乙烷反应生成AgCl的热力学。Ag、AgCl及氢气的热力学参数见表1[16];1,2-二氯乙烷及氯乙烯的热力学参数见表2[17]。由表1和表2可见,不同文献中给出的各物质的摩尔热容(Cp)随温度变化的表达式不同。
根据反应时空产率的要求,工业上乙烯氧化制EO反应的起始温度一般为483 K左右;随着催化剂活性的下降,为了保持时空产率的稳定性,需要不断提高反应温度;当反应温度达到543 K时,由于技术经济的原因,需要更换新鲜催化剂。因此,在本研究中,计算各物质摩尔热容的温度选在298~600 K,即可完全包括该反应的各阶段的温度范围。分别根据表1和表2的摩尔热容公式计算了式(12)中各物质在298~600 K下的摩尔热容,列于表3。
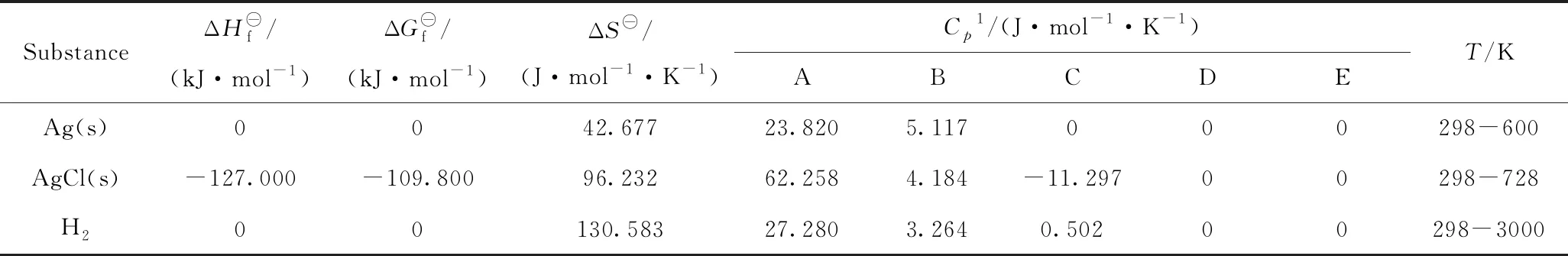
表1 Ag、AgCl及H2的热力学数据[16]Table 1 Thermodynamics data of Ag,AgCl and H2[16]
Cp1=A+B×10-3T+C×105T-2+D×10-6T2+E×108T-3; A、B、C、D、E—Coefficient of molar heat capacity

表2 1,2-二氯乙烷及氯乙烯的热力学数据[17]Table 2 Thermodynamics data of 1,2-CH2ClCH2Cl and CH2CHCl[17]
Cp2=A+B×T+C×T2+D×T3+E×T4; A、B、C、D、E—Coefficient of molar heat capacity
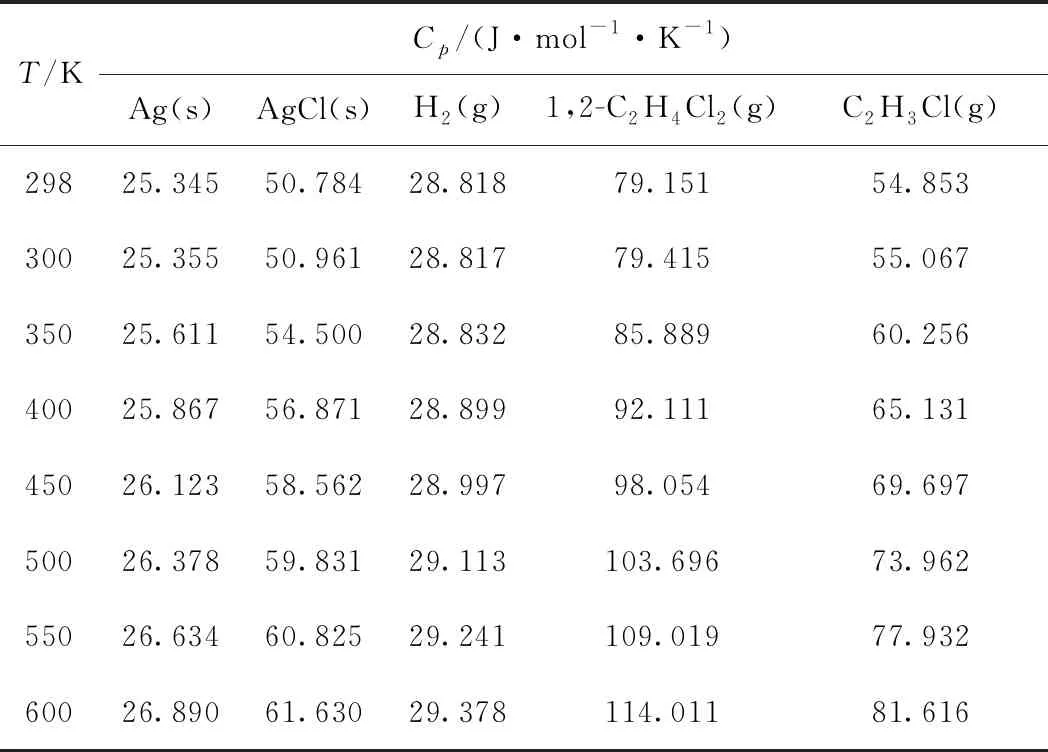
表3 各物质在不同温度下的摩尔热容Table 3 Heat capacity of different components atdifferent temperatures
利用表3的数据将物质的摩尔热容统一回归为相同的表达方程:
Cp=A+BT+CT2
各物质的摩尔热容与温度的拟合参数和线性关系如图1所示。由图1可见,各物质摩尔热容回归方程的相关系数均等于或接近于1。因此,利用回归的摩尔热容方程及其参数数据对式(12)反应进行热力学计算是可行的。
3.3 计算依据
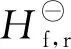

图1 不同物质的摩尔热容与温度的拟合方程及关系曲线Fig.1 Linear fitting equations of different componentsbetween Cp and temperatures
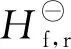
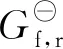
3.4 ΔHf,r及ΔGf,r与温度T的关系
3.4.1 ΔHf,r与温度T的关系
根据Kirchhoff定律[16]:
(13)
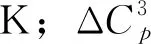
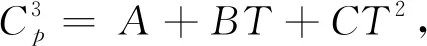
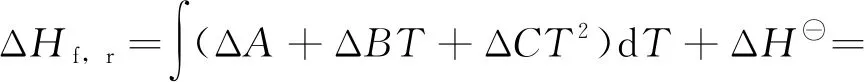
(14)
由图1可得,
ΔA=∑Aproducts-∑Areactants=
-8.122 J/(mol·K)
ΔB=∑Bproducts-∑Breactants=
0.1955 J/(mol·K2)
ΔC=∑Cproducts-∑Creactants=
-0.000195 J/(mol·K3)
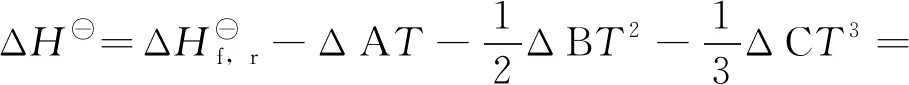
因此,ΔHf,r与温度T的关系为:
ΔHf,r=-8.122T+0.09775T2-
0.000065T3+57754.97
(15)
由式(15)计算了不同温度下式(12)反应的焓变,列于表4。由表4可见,随着反应温度的升高,式(12)反应的ΔHf,r增大,表明反应的吸热量越来越大。对于吸热反应,温度升高有利于式(12)反应向右进行。该反应是吸热反应,同时也是熵增反应。在较高温度下,该反应的吉布斯自由能可能由正转变为负,成为热力学上具有自发进行趋势的反应。因此,该反应发生需要较高的反应温度来提供外在能量,使该反应在热力学上成为可能,且在动力学上具有一定的速率。
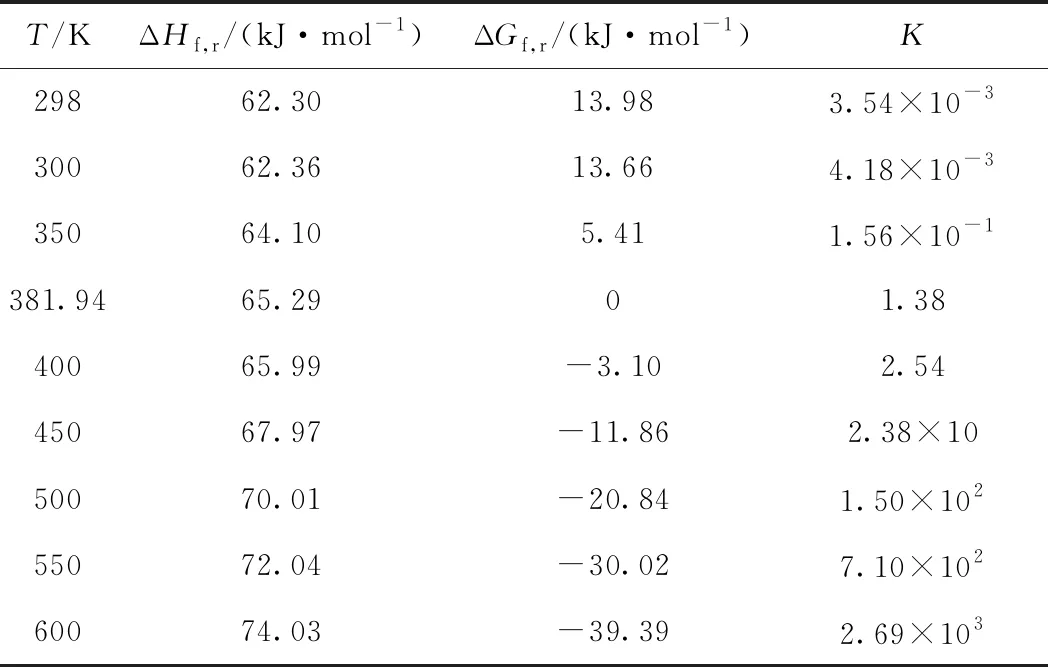
表4 不同温度下式(12)反应的ΔHf,r、ΔGf,r及平衡常数KTable 4 ΔHf,r,ΔGf,r and equilibrium constant K ofreaction equation (12)
3.4.2 ΔGf,r与温度T的关系
根据Gibbs-Helmhots方程,[∂(ΔG/T)/∂T]p=-ΔH/T2[18]。将式(14)代入此式得:
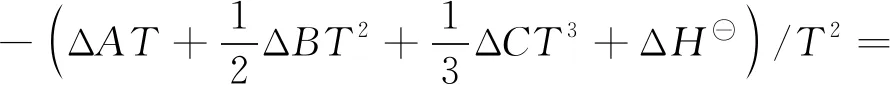
将上式对T进行积分得:
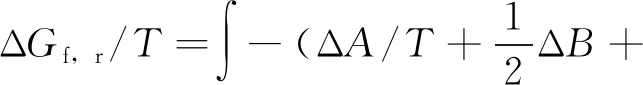
式中,A为积分常数,J/(mol·K)。
因此,
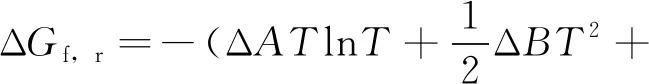
(16)
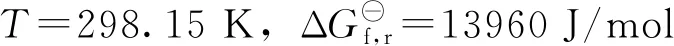
因此,
ΔGf,r=57754.97-166.91T+8.122TlnT-
0.09775T2+0.0000325T3
(17)
由式(17)计算得到不同温度下式(12)反应的自由能,如表4所示。由表4可知,随着反应温度的升高,ΔGf,r逐渐减小;当反应温度达到381.94 K时,式(12)反应处于平衡状态;由于反应的ΔGf,r=-RTlnK,继续升高反应温度,反应的ΔGf,r<0,反应具有了自发进行的趋势;而且随着反应体系温度的升高,反应自发进行的趋势越来越强。对于乙烯氧化制EO反应体系而言,随着银催化剂使用时间的延长,活性逐步降低,需要不断提高反应温度来保证一定的时空产率。此时,1,2-二氯乙烷在银催化剂的作用下开始催化裂解,并与Ag发生反应生成少量AgCl。虽然反应热力学分析的条件与反应的实际状态存在较大区别,但分析结果表明:(1)Ag与1,2-二氯乙烷的反应可以在不太苛刻的条件下发生;(2)在生产过程中,要合理控制反应的温升。因为温度越高,Ag与1,2-二氯乙烷的反应速率越快,银催化剂失活的速率也越快。
3.4.3 平衡常数K与Ag平衡转化率的关系
由ΔGf,r=-RTlnK可知,K=exp(-ΔGf,r/RT)。计算了不同温度下Ag转化为AgCl的平衡常数,也列于表4。由表4知,Ag转化为AgCl反应的平衡常数随温度的升高而变大。因此,Ag转化为AgCl的反应要在高温下才有较快的反应速率。这或许也是高温下银催化剂失活速率更快的原因之一。
4 结 论
在乙烯氧化制EO反应系统中,银催化剂与1,2-二氯乙烷的反应为吸热反应。当反应温度小于381.94 K时,反应的ΔGf,r>0,反应不能自发进行;当反应温度为381.94 K时,反应的ΔGf,r=0;当反应温度大于381.94 K时,反应的ΔGf,r<0,该反应具有自发进行的可能,且随着反应温度的升高,ΔGf,r越来越小,反应自发进行的趋势越来越强。
对于银催化剂与1,2-二氯乙烷的反应,提高反应温度,有利于该反应向产物方向移动。当反应温度大于381.94 K时,1,2-二氯乙烷在银催化剂的作用下发生催化裂解,并与Ag反应生成少量AgCl,反应的速率随着温度的升高呈指数增长。
