施氮量对小麦氮素代谢关键酶活性的影响
2019-11-22赵吉平任杰成郭鹏燕
赵吉平,任杰成,郭鹏燕,许 瑛,任 超
(山西省农业科学院经济作物研究所,山西汾阳 032200)
氮素为麦类作物生长发育的关键营养元素,小麦植株生长发育、籽粒产量、籽粒品质等均受到氮素代谢水平的影响[1]。适宜施氮量可提升小麦氮素代谢关键酶活性,提高氮素向籽粒的分配、转运,提高籽粒产量[2]。过量施氮则可限制氮素代谢关键酶活性,影响氮素代谢,减少氮向籽粒转运量,从而影响籽粒产量。适宜的施氮量可提升氮素代谢关键酶活性,进而提高小麦籽粒产量。
本研究以当地主栽品种晋麦104号为供试材料,检测不同施氮量水平下氮素代谢关键酶活性及产量,分析被测酶活性与籽粒产量的相关性,以探究当地小麦栽培的最佳施氮量及其促高产机理,为合理施氮促增产提供参考依据。
1 材料与方法
1.1 供试材料
供试材料为小麦品种晋麦104号,为山西省农业科学院经济作物研究所自主选育品种。
1.2 试验设计
试验于2017年-2018年在山西省农业科学院经济作物研究所试验基地(汾阳)进行,前茬夏玉米。试验田0~20 cm土壤肥力均匀,含碱解氮56.40 mg·kg-1、速效钾91.55 mg·kg-1、速效磷10.52 mg·kg-1。设置4个施氮水平分别为0 kg·hm-2、120 kg·hm-2、240 kg·hm-2、360 kg·hm-2。氮肥选择尿素,50%于播种前底施,50%于拔节期随灌溉追肥。磷肥(200 kg·hm-2)选择过磷酸钙,钾肥(135 kg·hm-2)选择氯化钾,均全部底施。小区面积10 m2(5 m×2 m),重复3次。
2017年10月9日施肥整地,10月12日开沟点播,22 cm行距,播种密度为225×104株·hm-2,其余田间管理同当地大田。
分别在开花期每小区选择10 穗生长发育状况和开花时间一致的小麦单穗挂牌标记。花后0、7、14、21、28 d采集标记小麦旗叶,重复3次, -40 ℃液态氮速冻保存备用。
1.3 测定指标与方法
1.3.1 GS活性测定[3]
取备用小麦旗叶,去掉首尾及中脉后剪碎,称取0.5 g。冰浴条件下加入pH 8.0的50 mmol·L-1咪唑-HCl缓冲提取液 6 mL,研磨后15 000 r·min-1离心20 min,上清液即为粗酶液。分别取粗酶液50 μL加入pH 7.8的50 mmol·L-1咪唑-HCl缓冲提取液(A)及pH 7.8的50 mmol·L-1咪唑-HCl缓冲提取液+10 mmol·L-1盐酸羟胺混合液(B)中,充分混匀后30 ℃水浴30 min。取出A、B混合液,分别加入显色剂混匀,于5 000 r·min-1离心10 min,分别取上清液测定540 nm处吸光值。以γ-谷氨酰基羟肟酸540 nm处吸光值为标准线,测定A、B液吸光值差值,对应标准线查GS活性。
1.3.2 NR活性测定
采用活体磺胺比色法[4]:在开花后0、7、14、21、28 d取小麦新鲜旗叶,剪段,称取1 g。分别置于5 mL的0.1 M磷酸缓冲液+5 mL的蒸馏水混合液(A)中以及5 mL的0.1M磷酸缓冲液+ 5 mL的0.2 M KNO3混合液(B)中,真空干燥条件抽吸20 min,使旗叶充分浸入混合液, 30 ℃温箱避光保温30 min。取1 mL 5 ng·mL-1亚硝酸钠反应液加入到2 mL 3 mmol·L-1磺胺中摇匀,再加入2 mL 3 mmol·L-1α-萘胺摇匀。 25 ℃水浴保温20 min,540 nm处测定吸光值,以其为标准线。分别取A、B混合液1 mL加入2 mL磺胺中摇匀,再加入2 mL α-萘胺摇匀。25 ℃水浴保温20 min,540 nm比色,测定吸光值,对应标准线查NR活性。
1.3.3 GPT活性测定[5]
分别取开花后0、7、14、21、28 d小麦旗叶 1 g,制取粗酶液,粗酶液提取同1.3.1。取0.1 mL粗酶液分别置于ddH2O(空白对照)及0.5 mL谷丙转氨酶液中,37 ℃水浴30 min后加入0.5 mL 2,4-二硝基苯肼液终止反应。空白对照中加入0.5 mL谷丙转氨酶底物液,两管再次置于37 ℃水浴20 min后加入5 mL 0.4 mol·L-1氢氧化钠溶液混匀,500 nm处测定吸光值。两管吸光值差值对照丙酮酸吸光值标准线查GPT 活性。
1.3.4 GOGAT活性测定[6]
分别取开花后0、7、14、21、28 d小麦旗叶 1 g,制取粗酶液,粗酶液提取同1.3.1。取0.3 mL粗酶液加入到0.4 mL的20 mmol·L-1L-谷氨酰胺+0.5 mL的20 mmol·L-1α-酮戊二酸+0.1 mL的10 mmol·L-1氯化钾+0.2 mL的3 mmol·L-1NADH+1.5 mL pH 7.6的25 mmol·L-1Tris-HCl缓冲液混合液中,340 nm处测定吸光值。对应NADH标准线查GOGAT活性。
1.3.5 产量指标测定
成熟期测定产量、穗粒数、穗粒重以及千 粒重。
1.4 数据处理
数据采用Excel 2016和SPSS 22.0统计 分析。
2 结果与分析
2.1 施氮量对小麦氮素代谢关键酶活性的影响
由表1可知,不同施氮量下,小麦旗叶氮素代谢关键酶GS、NR、GPT、GOGAT的活性均随时间推移呈先升后降趋势,在花后7 d达到峰值。开花至花后28 d,小麦旗叶GS活性随施氮量的增加呈先升后降趋势,在240 kg·hm-2水平下活性最高且与其他处理间差异显著;小麦旗叶NR和GPT活性在240 kg·hm-2、360 kg·hm-2施氮量间差异不显著,但均显著高于其他处理。小麦旗叶GOGAT活性在360 kg·hm-2水平下最高,且花后0~7 d与其处理间差异显著;花后14~28 d, 240 kg·hm-2、360 kg·hm-2处理间差异不显著,二者均显著高于其他处理。
2.2 施氮量对产量及其构成因素影响
由表2可知,随施氮量升高,小麦产量、穗粒数、穗粒重及千粒重均呈先升后降的趋势,均在240 kg·hm-2施氮量水平时最高。240 kg·hm-2、360 kg·hm-2施氮量间的产量、穗粒数、穗粒重及千粒重差异均不显著,二者均显著高于0 kg·hm-2、120 kg·hm-2施氮量水平。
2.3 氮素代谢关键酶活性与产量相关性分析
由表3可知,开花期至花后28 d,小麦旗叶氮素代谢关键酶GS、NR、GPT、GOGAT的活性均与籽粒产量呈显著或极显著正相关,说明氮素代谢关键酶活性越高,籽粒产量越高。
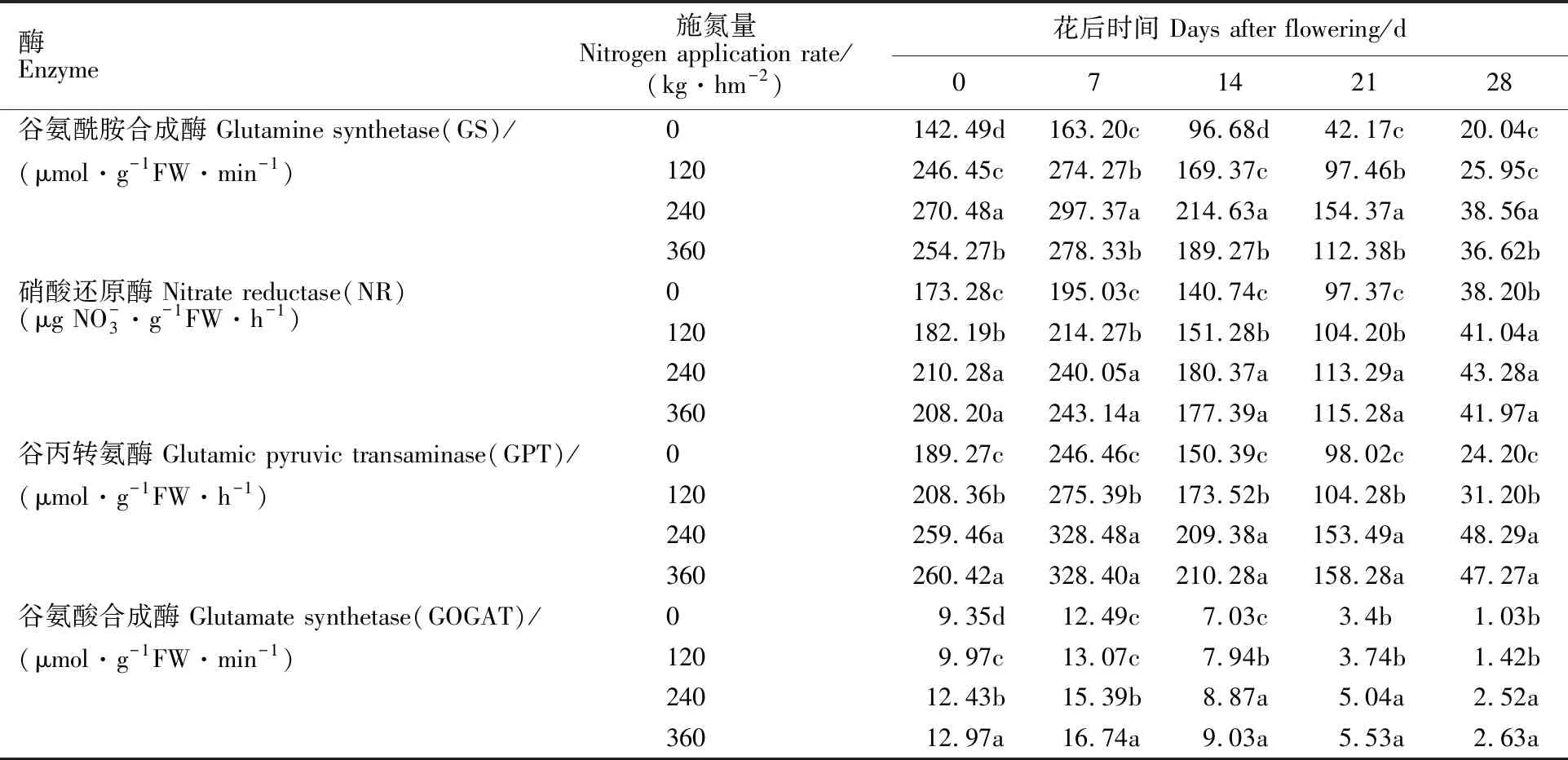
表1 不同施氮量下氮素代谢关键酶活性Table 1 Key enzyme activities of nitrogen metabolism under different nitrogen application rates
相同酶同列数值后不同字母表示处理间差异达到5%显著水平。
Values followed by different letters within same enzyme and column mean significant difference at 5% level.

表2 不同施氮量的产量及其构成因素Table 2 Analysis of yield and yield components under different nitrogen application rates
同列数据后不同字母表示差异达到5%显著水平。
Values followed by different letters within same column mean significant difference at 5% level.

表3 氮素代谢关键酶活性与产量相关性Table 3 Correlation between key enzyme activities of nitrogen metabolism and yield
*:P<0.05; **:P<0.01.
3 讨 论
小麦生长发育过程中,氮素代谢受到谷氨酰胺合成酶(GS)、硝酸还原酶(NR)、谷丙转氨酶(GPT)以及谷氨酸合成酶(GOGAT)等活性的调节[7]。GS以及GOGAT主要参与小麦铵态氮同化过程,通过GS/GOGAT循环可转化利用95%左右铵态氮[8]。张 弦等[9]研究显示,小麦旗叶的GS和NR活性在240 kg·hm-2水平高于180 kg·hm-2及350 kg·hm-2,与本研究结果一致。GS及GOGAT活性提高,则铵态氮同化效率提高,可有效促进小麦籽粒氮素代谢积累,达到增产效果。NR主要参与小麦硝态氮的还原同化过程,促进硝酸盐转化还原为NH3,进而提升小麦植株氨基酸水平。NR活性在一定程度上反映植株氮素营养水平,活性高低对于植物生长发育、产量以及蛋白质品质具有显著影响[10]。GPT为重要转氨酶,主要催化转氨基生成谷氨酸。本研究显示,小麦旗叶GPT活性在240 kg·hm-2、360 kg·hm-2施氮量水平下差异不显著。张 弦等[9]研究显示,被测各氮代谢相关酶活性在开花后14 d处于最高值,与本研究峰值出现在花后7 d有一定差异。这可能与选取小麦品种及生长环境有关。在后期研究中应进一步增加小麦品种类型及环境因素研究。
