健肝消脂方对非酒精性脂肪性肝病胰岛素抵抗、脂质沉积的影响及相关mRNA 差异表达初步分析*
2019-11-22温伟波万春平谢雪华祁燕宋陶丽玲杨云姣
房 昉 ,温伟波,万春平谢雪华祁 燕宋 云,陶丽玲,杨云姣
(1. 云南中医药大学第一附属医院,云南 昆明650021;2. 南京中医药大学,江苏 南京210023;3. 云南中医药大学临床医学院,云南 昆明650500)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已成为我国和发达国家肝脏疾病中的常见病种,严重危害人民健康。NAFLD 是指一种与代谢综合征(metabolic syndrome,MetS)等密切相关的临床病理综合征,该病的主要特征是与酒精等其他明确肝损害因素无关的肝脏脂肪变性,胰岛素抵抗(insulin resistance,IR)是其重要发病机制[1]。而胰岛素敏感性及胰岛素抵抗指数(HOMA-IR)两个指标则通常被用来评价胰岛素抵抗的程度[2]。高胰岛素血症(hyperinsulinism,HIS)一般多指除外胰岛素瘤、使用胰岛素等其他病因后,空腹胰岛素或糖负荷后2 h 胰岛素水平升高,HIS 经常早于或伴随IR 出现,通常被认为是IR 的替代性参数(surrogate variable),而鉴于已有研究证实HIS 与NAFLD 的脂肪浸润程度密切相关[3],所以空腹胰岛素水平也是评价NAFLD 患者IR 的重要指标。同时预防和治疗MetS 是NAFLD 治疗的首要目标之一[4],而减轻IR 又是防治MetS 的一个重要手段[5]。因此,降低空腹胰岛素水平、改善IR在NAFLD 的治疗中具有重要意义。本实验观察健肝消脂方对NAFLD 动物模型空腹胰岛素、空腹血糖、肝脏脂质沉积等的影响,计算IR 相关指标,并通过基因芯片技术观察相关mRNA 表达谱差异,以期深入了解其分子机制。
1 实验材料
1.1 实验动物 健康雄性SD 大鼠,SPF 级,8 周龄,体质量(200±20)g,共30 只,购自重庆腾鑫生物技术有限公司。使用SPF 级动物房饲养动物,温度(22±1)℃,湿度(55±5)%,并予光暗循环12 h,适应性饲养1 周后使用。实验期间,动物自由进食。参照《实验动物管理条例》进行实验。
1.2 药物及制备 健肝消脂方由丹参、三七、莪术、山楂、黄芪、青皮、赤芍、姜黄、菊花、荷叶、甘草等组成,均购自云南省中医医院中药房,并由云南省中医医院制剂室将除三七外其他药物采用传统中药煎煮方法制成水提液,再浓缩至相对密度为1.30~1.35(60~80 ℃)的中药浸膏;三七经粉碎、筛分制成三七超细粉,按处方比例加入浸膏,混匀,于0~4 ℃保存备用。
1.3 主要试剂及仪器 胰岛素酶联免疫吸附实验(ELISA)测定试剂盒(上海酶联生物科技有限公司),葡萄糖测定试剂盒(中生北控生物科技股份有限公司),油红O(上海化学试剂公司),苏木精(美国sigma-aldrich 公司),氨基烯丙基扩增试剂盒(Amino Allyl MessageAmp II aRNA Amplification Kit,AM1753)(美国Ambion 公司)、RNA 6000 nano assay试剂盒(美国Agilent 公司)、离心机(德国Thermo Scientific Heraeus 公司),全自动生化仪(德国罗氏公司),Spectra Maxi3x 酶标仪(美国Molecular Devices公司),NanoDrop 1000 超微量分光光度计(美国Nanodrop 公司)等。
2 实验方法
2.1 NAFLD 大鼠造模方法 参照杨坤等人方法[6]改良高糖高脂饲料(配方为:基础饲料67.5%、猪油10%、蔗糖10%、蛋黄粉10%、食盐1%、胆固醇1%、胆酸钠0.5%)复制NAFLD 大鼠[7]。
2.2 分组及给药[7]根据随机数字表法进行随机分组。首先,随机选取10 只大鼠为空白对照组,予正常饲料喂饲;剩余20 只大鼠使用高糖高脂饲料造模(造模组)。造模组喂养第31 天时,空白对照组与造模组各随机取2 只大鼠处死,行肝脏病理学检测,以确认造模成功。确认造模成功后,造模组所剩18 只大鼠,再次随机分为模型组(M 组)及治疗组(Z 组),每组各9 只,均继续予以高糖高脂饲料,连续60 d。同时Z 组根据10.86 g/kg 的生药量灌胃给药(按照大鼠与人的体表面积比例进行剂量换算),每日给药1 次,连续60 d;M 组给予相应体积的蒸馏水灌胃,每日1 次,连续60 d。
2.3 观察指标
2.3.1 空腹血糖、胰岛素及胰岛素敏感性、HOMA-IR第60 天时,M 组及Z 组大鼠均禁食12 h,鼠尾静脉取血,使用全自动生化仪及葡萄糖测定试剂盒检测空腹血浆葡萄糖水平;眼底静脉丛取血,再使用离心机分离血清,使用胰岛素ELISA 测定试剂盒检测空腹胰岛素含量;胰岛素敏感性=1/[空腹血糖(mmol/L)×空腹胰岛素(mIU/L)],HOMA-IR=[空腹血糖(mmol/L)×空腹胰岛素(mIU/L)]/22.5[2]。
2.3.2 肝脏脂质沉积 M 组及Z 组大鼠剖腹取肝右叶及左叶部分新鲜肝组织进行冷冻切片,厚度7 μm,风干,10%中性甲醛溶液固定,水洗,密封容器内稀释,油红O 染色,60%乙醇分色;二次水洗后苏木精淡染细胞核,1%磷酸氢二钠冲洗,甘油明胶封固。
2.3.3 大鼠肝脏组织mRNA 表达情况[8]根据随机数字表法随机选取M 组中3 只大鼠及Z 组中3 只大鼠进行进行肝组织mRNA 表达谱芯片检测。实验标本取材均为实验动物肝右叶部分肝组织。
(1)RNA 质检方法
使用NanoDrop ND-1000 测定吸光度以检验RNA 样品的纯度,质检标准为:A260/A230≥1.5 同时A260/A280≥1.8,以排除样品中存在蛋白、酚类物质、芳香基团、硫氰酸盐及其他有机物质的污染。RNA 完整值(RNA integrity number,RIN) 以RNA 6000 nano assay 试剂盒检测,质检标准为RIN>6。基因组DNA(genomic DNA,gDNA)的污染情况则通过凝胶电泳判断。
(2)样本制备质控方法
使用AM1753 试剂盒获得氨基-烯丙基反义RNA(aa-aRNA),RNA(aa-aRNA)与NHS-CyDye(Cy5)完成荧光标记与纯化后进行芯片杂交。质控方法:aa-aRNA 符合定量分析相关要求;同时每1000个核苷酸中,Cy5 的标记效率应大于15 个染料分子以上。
(3)芯片杂交质控方法
①平均背景强度:Cy5 以B635 Median 表示,以Cy5<400 为合格。
②内部杂交控制探针(IHCs):以IHC>37 500 为合格。
③外部质控探针(ETQC probes & Spike-ins):利用ETQC 外部质控探针合成spike-ins 序列。设计低、中、高三个浓度,依spike-ins 浓度,ETQC 探针分别呈现理想的高、中、低讯号监控杂交特异性。
④背景噪音:使用48 个阴性控制探针监测非特异性杂交,并使用Rosetta Resolver 软件进行计算,信号强度>400 的阴性探针个数应当小于10 个。
⑤样本制备完整性:使用ITQC 4,5,6 探针监测样本制备的完整性,应至少2 组ITQC 探针满足基因完整性的相关要求。
(4)基因芯片数据分析方法
将GPR 文档加载到Limma(Bioconductor)软件中进行分析。
①合并重复探针:将每张芯片上相同序列的探针为重复探针,取平均值。
②讯号均一化:去除flagged probes 及控制探针后,对检出的探针讯号进行中位数平移。
③差异基因标准:log2|Fold change|≥1 同时P<0.05。
④功能富集分析:生物途径(Pathway)富集分析及基因本体(Gene Ontology,GO)分析程序使用Bioconductor 网站的clusterProfiler 软件进行,并与《京都基因与基因组百科全书》(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行对比。
2.4 统计学处理 定量资料统计方法:采用SPSS 20.0 软件进行分析,定量资料以均数±标准差(表示,进行独立样本t 检验;基因差异表达P 值计算方法为:基因芯片讯号进行线性模型校正(Fit linear model),再使用经验贝叶斯统计(Empirical Bayes Statistics)计算。以上均以P<0.05 为差异具有统计学意义。
基因差异聚类分析方法为:芯片讯号值经数据log 转换及平均数中心化后,采用无监督层次聚类(unsupervised hierarchical clustering analysis)分析实验样本间整体基因表达的相似性。
3 结果
3.1 空腹胰岛素与空腹血糖水平 Z 组与M 组比较,2 组空腹血糖水平无明显变化,但Z 组空腹胰岛素水平降低(P<0.05)。见图1。
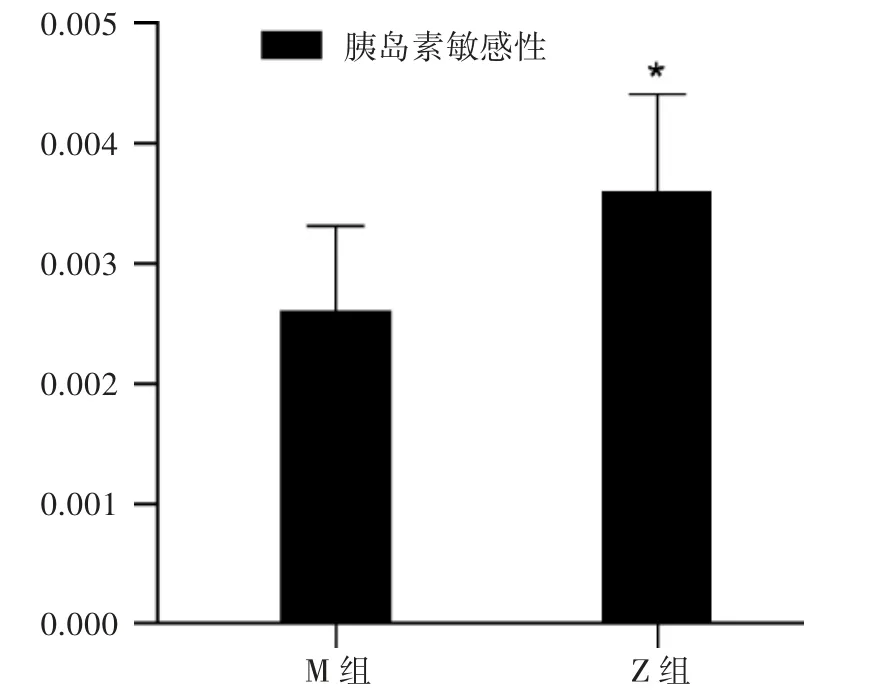
图2 健肝消脂方对胰岛素敏感性的影响
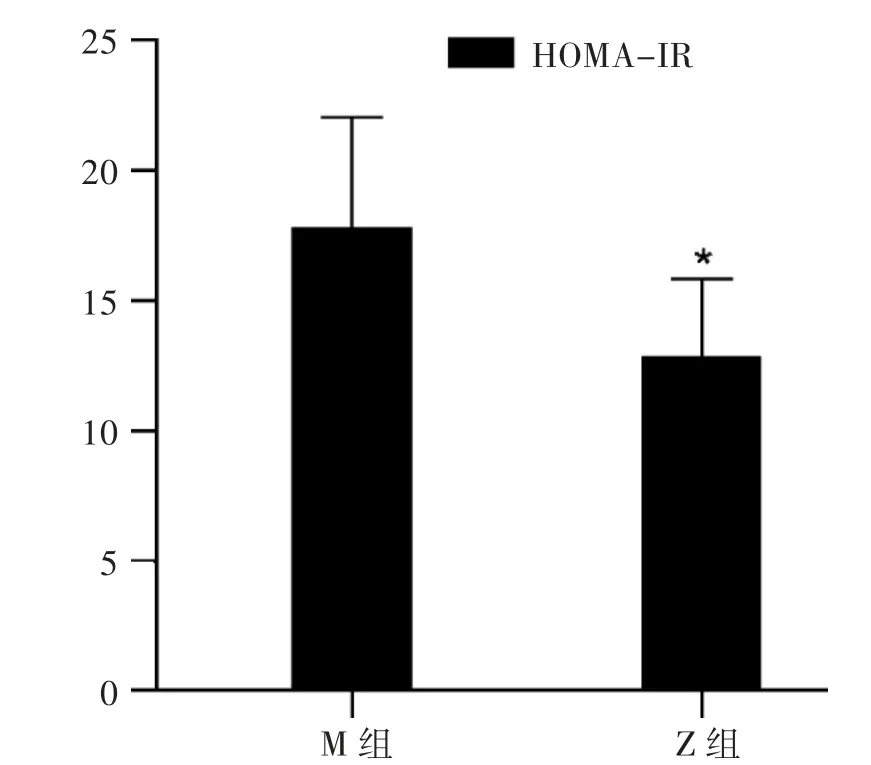
图3 健肝消脂方对HOMA-IR 的影响
3.2 肝脏脂质沉积情况 经油红O 及苏木精染色后,可见治疗组肝脏内大脂滴明显减少,肝脏脂质沉积明显改善。见图4。
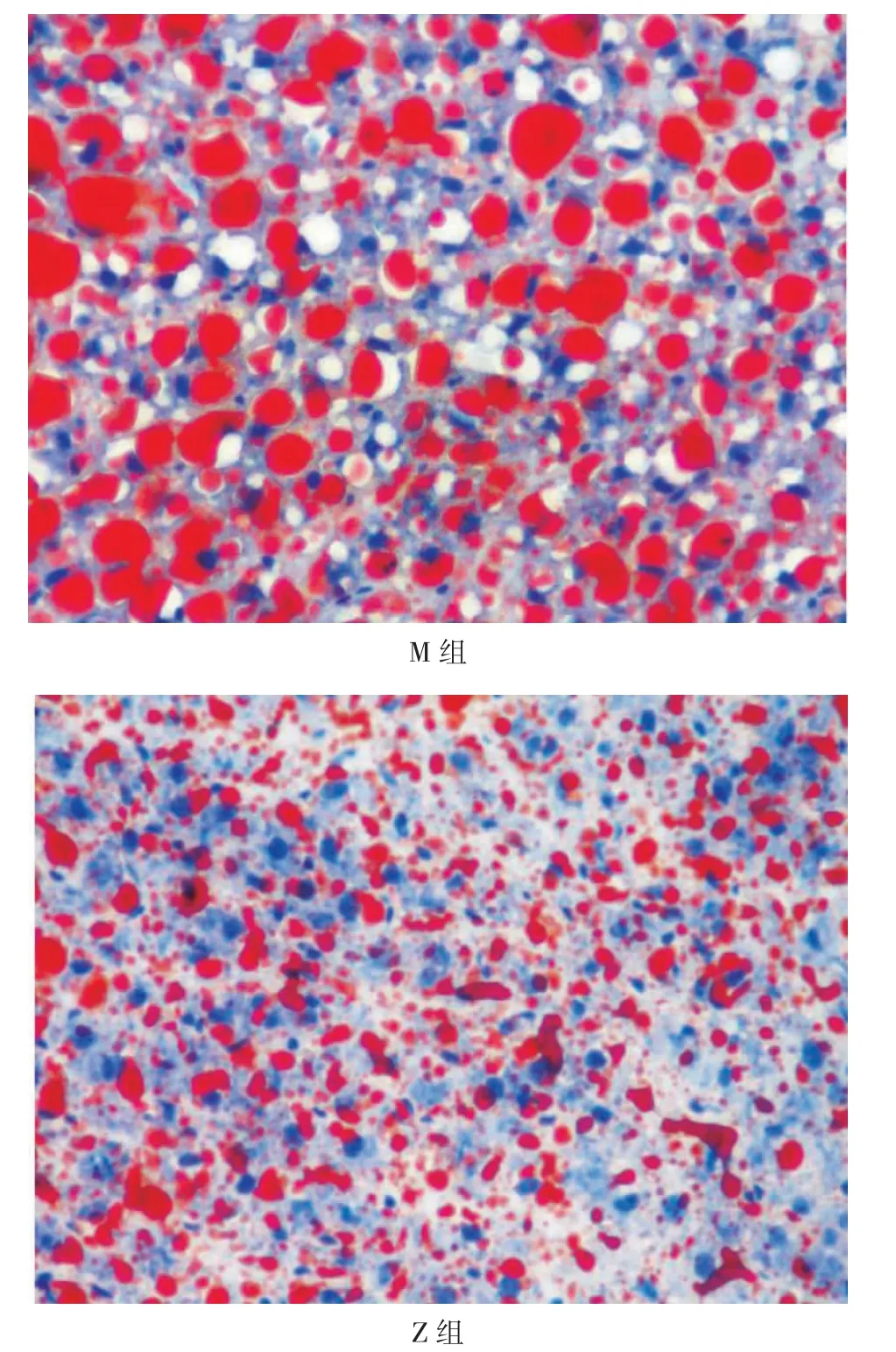
图4 健肝消脂方对肝脏组织脂质沉积的影响
3.3 基因差异表达分析结果 Z 组与M 组比较肝脏mRNA 表达存在明显差异,其中上调的基因有52 个,下调的基因有13 个,差异表达基因共65 个。见图5及表1。

图5 mRNA 差异表达的火山图
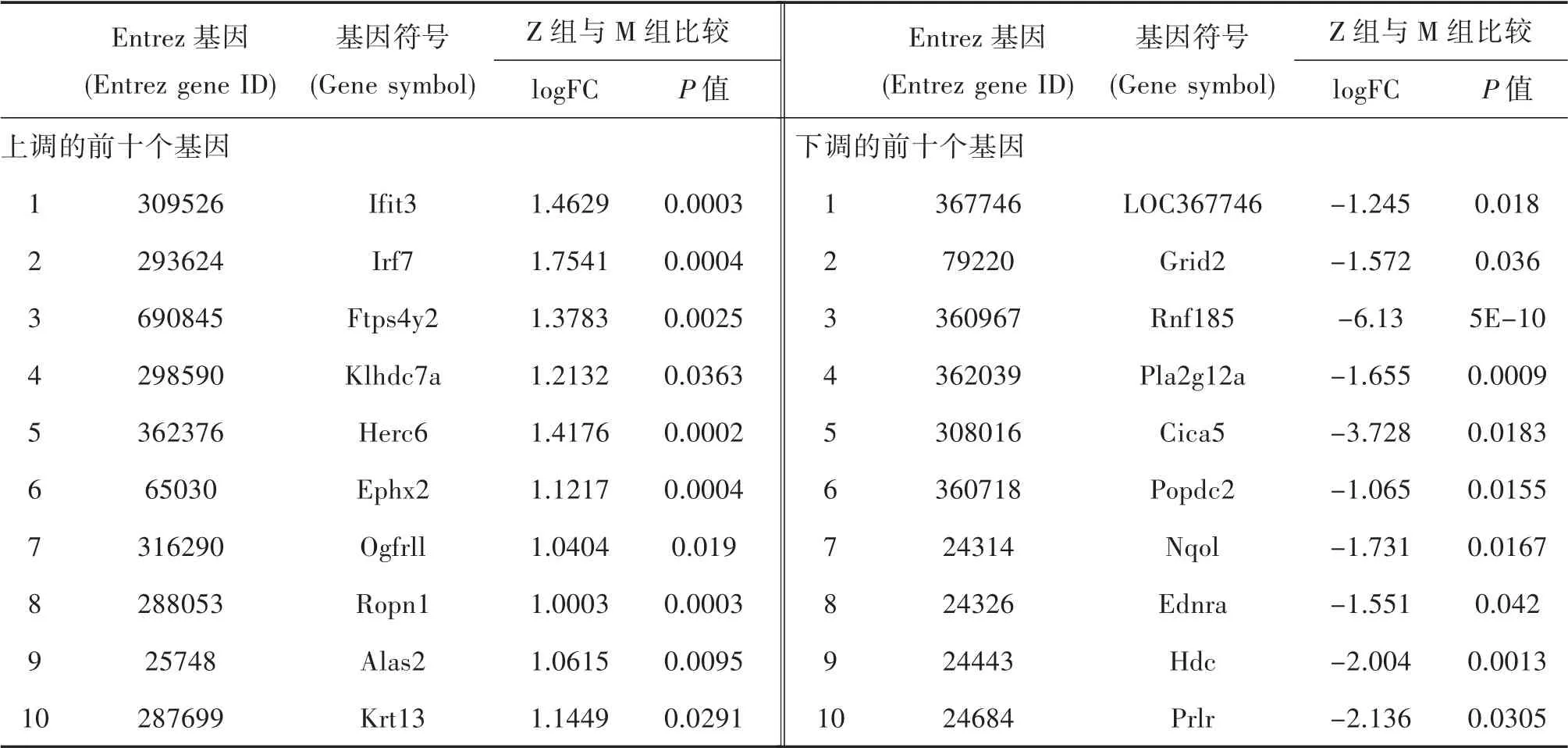
表1 Z 组和M 组差异表达的mRNA(各前10 位)
3.4 聚类分析结果 以差异表达基因探针筛选出的前65 基因探针进行聚类分析,可见M 组与Z 组基因表达有明显差别。见图6。
3.5 功能富集分析结果
3.5.1 生物途径(pathway)富集分析结果 见表2。
3.5.2 基因本体(GO)富集分析结果
(1)GO 分子功能(molecular function)富集结果见表3。
(2)GO 生物过程(biological process)富集结果见表4。
(3)GO 细胞成分(cellular component)富集结果见表5。
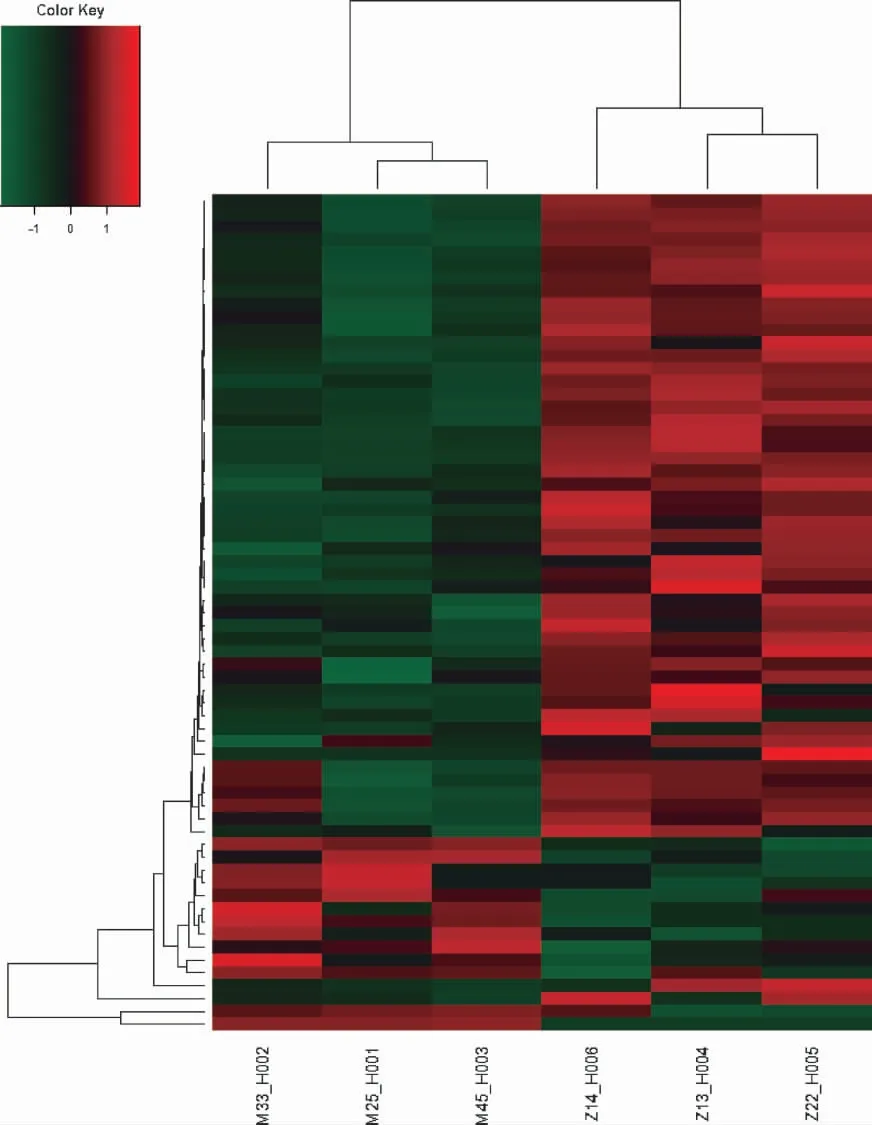
图6 基因差异表达的mRNA 聚类分析图

表2 排序前十的生物途径(pathway)富集结果

表3 GO(molecular function)富集结果

表4 排序前十的GO(biological process)富集结果

表5 GO(cellular component)富集结果
4 讨论
研究结果显示,虽然健肝消脂方对高糖高脂饲料诱导的NAFLD 大鼠模型空腹血糖没有明显影响,但是该方可以明显降低空腹胰岛素,改善胰岛抵抗,并可改善肝脏脂质沉积,其作用机制可能与肝脏基因表达有关。
根据肝脏mRNA 差异表达的功能富集分析及基因本体(GO)富集可知,健肝消脂方可以通过影响生物途径(pathway)及GO 分子功能(molecular function)、GO 生物过程(biological process)、GO 细胞成分(cellular component)改善NAFLD 的病理生理过程。
在排序前十的生物途径富集结果中,Toll 样受体与NAFLD 密切相关,通过调节Toll 样受体信号通路(Toll-like receptor signaling pathway),可以减轻高胰岛素血症,但未能明显降低血糖水平,同时可减轻肝组织纤维化[9],此外还可影响肝细胞脂质沉积[10]。丙型肝炎病毒(Hepatitis C)感染会增加胰岛素抵抗的患病率[11],而丙肝的抗病毒治疗则可以改善非糖尿病、瘦型慢性丙型病毒肝炎患者的外周胰岛素敏感性[12],同时丙型病毒肝炎患者若出现肝细胞脂肪变性,则更容易发生肝纤维化[13]。维甲酸诱导基因I(retinoic acid-induced gene I,RIG-I)样受体信号通路(RIGI-like receptor signaling pathway)的泛素化修饰可激活干扰素调节因子(interferon regulatory factor,IRF)/核因子κB(nuclear factor kappa B,NF-κB)信号通路[14]。再根据肥胖动物模型的肝脏中IRF3 的表达下降,而敲除IRF3 后肥胖动物模型易于出现胰岛素抵抗及脂肪变性,以及其他学者已证实经肝脏过量表达IRF3 的实验动物可保持葡萄糖和脂质稳态,我们可以推测RIG-I 样受体信号通路可能通过激活IRF3而改善IR。IRF3 还可以抑制NF-κB 的活性[15],而NF-κB 活性的抑制则是改善IR 的潜在分子途径[16]。此外,RIG-I 可以激活干扰素β(interferonβ,IFNβ)[17],而已有实验研究证实干扰素β-1a 对肝纤维化模型大鼠的肝纤维化程度有明显的抑制作用[18]。丝裂原活化蛋白激酶(mitogen -activated protein kinase,MAPK)信号通路(MAPK signaling pathway)是IR 的经典信号转导途径之一[19],并参与了肝纤维化的进程[20],还与肝细胞脂质沉积密切相关[21]。血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路(VEGF signaling pathway)与脂质的代谢关系密切,在改善胰岛素抵抗方面具有重要作用[22]。VEGF活性的降低,又可能与抗肝纤维化血管新生有关[23]。并已有研究证实VEGF 基因rs833061、rs3025039 位点多态性与NAFLD 的发病有关[24]。花生四烯酸(arachidonic acid,AA)对胰岛β 细胞合成及分泌胰岛素具有双向调节作用[25],同时AA 及其代谢产物对NAFLD 的脂质沉积及肝纤维化均有影响[26]。
在GO 分子功能方面,上调的IRF7 可能与Toll样受体信号通路有关[27]。而Toll 样受体富含亮氨酸[28],因此GO 分子功能富集中的GO:0016597(amino acid binding)可能也与Toll 样受体信号通路相关。在GO生物过程方面,富集排序前十中的GO:0006952(defense response)可能与MAPK 信号通路有关[29];鉴于众所周知病毒复制与丙型肝炎病毒密切相关,因此GO 生物过程排序前十中的GO:0045069(regulation of viral genome replication)、GO:0019079(viral genome replication)可能均对丙型肝炎病毒有影响。在GO 细胞成分方面,GO:0019867(outer membrane)也可能与丙型肝炎病毒有关[30]。
健肝消脂方由丹参、三七、莪术、山楂、黄芪、青皮、赤芍、姜黄、菊花、荷叶、甘草等构成,具有行气消滞、活血化瘀之功[7]。方中丹参可能对VEGF 信号通路[31]、MAPK 信号通路[32]、Toll 样受体信号通路[33]均有影响,三七可能对VEGF 信号通路有影响[34],莪术可能对VEGF 信号通路、MAPK 信号通路[35]均有影响,黄芪可能对VEGF 信号通路[36]有影响,赤芍可能对Toll 样受体信号通路[37]、MAPK 信号通路[38]均有影响,姜黄可能对VEGF 信号通路[39]、MAPK 信号通路[40]均有影响,荷叶可能对VEGF 信号通路有影响[41]。
Toll 样受体信号通路、丙型肝炎病毒、RIG-I 样受体信号通路、MAPK 信号通路、VEGF 信号通路、花生四烯酸代谢均与IR、肝内脂质沉积有关,同时可能对肝纤维化有影响,其中Toll 样受体信号通路与上调的IRF7 基因、GO 分子功能富集的GO:0016597 有关,而MAPK 信号通路与GO 生物过程富集的GO:0006952 有关。而对现有单味药相关研究进行分析可知丹参、三七、莪术、黄芪、姜黄、荷叶均可能影响VEGF 信号通路,丹参、莪术、赤芍、姜黄均可能影响MAPK 信号通路,丹参、赤芍均可能影响Toll 样受体信号通路。因此VEGF 信号通路、MAPK 信号通路、Toll 样受体信号通路可能是健肝消脂方干预NAFLD的主要分子信号通路。而c-Jun N-末端激酶(c-Jun N-terminal kinase,JNK)作为MAPK 家族中的重要一员,JNK 相关通路值得进行深入研究。
另一方面,肝脏受损时,可能导致胰岛素分泌增多、胰岛素降解减少,易于导致HIS,而且HIS 的持续存在可能还是肝脏损伤时IR 的重要病因之一[42],因此降低空腹胰岛素水平可能在改善NAFLD 的IR 中具有特殊意义;我们的研究则提示了健肝消脂方降低空腹胰岛素水平疗效良好,同时其影响的多个生物途径可能与肝纤维化有关,而目前已有研究证实空腹胰岛素水平是NAFLD 肝纤维化的独立预测因子之一[43],据此推测该方可能对肝纤维化治疗有益。最后,该方还在生物途径、GO 生物过程、GO 细胞成分方面影响了丙型肝炎病毒,据此推测该方可能对于丙型肝炎合并NAFLD 的患者有益。但上述推测仍待进一步的相关研究证实。
5 结论
综上所述,健肝消脂方可以改善IR 及肝脏脂质沉积,其作用机制与肝脏基因表达及相关基因功能有关。其分子机制可能是该方能够调节干扰素调节因子(IRF)7、GO 分子功能GO:0016597、GO 生物过程GO:0006952,并影响了MAPK 信号通路、VEGF信号通路、Toll 样受体信号通路。同时健肝消脂方可能在分子层面上对肝纤维化、丙型肝炎病毒在肝脏内的复制等产生一定影响。另一方面,本研究虽然在寻找中医药治疗NAFLD 的基因靶点方面进行了尝试,初步探讨了健肝消脂方可能影响的相关肝脏基因,但由于NAFLD 是一个与遗传、环境、代谢等多方面有关的复杂疾病,今后仍有待围绕已知差异表达基因,扩大样本量,进一步分析健肝消脂方治疗NAFLD 的基因靶点。
