T细胞免疫球蛋白和ITIM结构域在结直肠癌中的表达及意义*
2019-11-21王伟杰彭根远张宁妹
王伟杰, 彭根远, 姜 韬, 张宁妹, 李 海△
(宁夏医科大学 1总医院结直肠外科, 2临床医学院, 3总医院病理科, 宁夏 银川 750004)
基于免疫检查点的免疫治疗是肿瘤治疗的一线手段,目前研究发现在多种肿瘤细胞膜表面存在程序性死亡受体-配体1(programmed cell death-ligand 1, PD-L1)的高表达,同时在肿瘤浸润的淋巴细胞存在PD-1的高表达,两者结合可以封闭免疫细胞的杀伤作用,诱导免疫细胞凋亡[1-2],而目前PD-1/PD-L1信号已经成为肿瘤免疫治疗的主要靶点。T细胞免疫球蛋白和ITIM结构域(T-cell immunoglobulin and ITIM domain,TIGIT)是2009年鉴定出的一种类似免疫检查点蛋白,是表达在T细胞和NK细胞上的抑制性受体,TIGIT具有多种配体,包括CD155、CD112和CD113,而CD155和CD122同时也是CD226的配体。CD226与TIGIT竞争,刺激T细胞活性。配体与TIGIT之间的相互作用占了上风,使CD226免疫活性受到抑制。肿瘤细胞上调CD155和CD122以逃避免疫介导的破坏作用。上述配体中CD155与TIGIT的亲和力最高,2者结合后可以发挥类似免疫抑制作用,但是目前TIGIT/CD155的研究尚未广泛[3-4],据现有文献报道,TIGIT在黑色素瘤等肿瘤中高表达[5]。
结直肠癌作为一种高发性的实体瘤,目前发病率逐年升高。结直肠癌的治疗主要采用外科手术、放化疗和生物免疫治疗等综合性治疗方式,也有多项研究发现结直肠癌中存在负性免疫调节信号的高表达,包括PD1/PD-L1和CD40/CD40L等,该类信号的高表达直接抑制了淋巴细胞的免疫杀伤功能[6-7],目前TIGIT/CD155在结直肠癌中的作用尚未见报道。 本研究采用免疫组织化学染色法检测结直肠癌组织中TIGIT/CD155的表达水平,并探讨其与结直肠癌发生发展转移的相关性,为结直肠癌免疫治疗提供新思路。
材 料 和 方 法
1 病例来源
选择2016年1月~2018年6月于宁夏医科大学总医院收治的80例结直肠癌患者,患者在接受肠镜-病理检测确诊为结直肠癌,接受手术切除后获得相关肿瘤组织及癌旁正常组织。患者在接受治疗前未经过放疗和化疗等治疗,经过病理确诊为腺癌组织,80例患者中男性49人,女性31人,患者年龄44~76岁,平均58岁。经过诊断,按照《中国结直肠癌诊疗规范(2017版)》进行病理分期(pTNM),其中I期28人、II期26人、III期22人,IV期4人。同时收集患者癌旁正常组织,癌旁组织是距离肿瘤组织5 cm以上的肠黏膜组织。患者均知情同意。
2 方法
2.1免疫组织化学染色法 将肿瘤组织和癌旁组织用3.7%的中性甲醛固定,脱水后采用石蜡包埋,进行4 μm厚度的连续切片。切片经过脱蜡水化后用3%双氧水浸泡,37 ℃浸泡30 min后煮沸5 min, 后采用羊血清封闭30 min,37 ℃水浴15 min后,滴加抗TIGIT抗体(Abcam,工作浓度为1 ∶200)和抗CD155抗体(Abcam,工作浓度为1 ∶ 150)孵育过夜后清洗,继续滴加 II 抗,37 ℃水浴30 min后加入辣根过氧化物酶,37 ℃水浴30 min,PBS洗2次后加入DAB试剂盒显色,苏木精染色,切片进行常规脱水、透明、封片。以PBS代替I抗作为对照。TIGIT和CD155阳性表达在细胞膜,少量表达在胞质内。染色结果以Birner法进行评分,综合染色强度和阳性细胞占总细胞数的百分比进行半定量分析,染色强度的评分标准为:无染色者为0分、染色浅但明显区别于阴性对照为1分,染色深为2分;阳性细胞占细胞数百分比的评分标准为:阳性细胞率低于5%的为0分,5%~25%细胞阳性率为1分,26%~50%细胞阳性率为2分,大于50%为3分。以上两者积分相乘后,0分为阴性染色,1~3分为阳性染色,4~5分为强阳性染色。
2.2Western blot法检测TIGIT和CD155的表达水平 将100 mg的结直肠癌组织和癌旁组织用无菌手术剪剪碎后加入1.0 mL的RIPA裂解液(碧云天生物技术有限公司)在冰上裂解30 min,10 000×g转速下离心15 min,取上清液以BCA试剂盒(碧云天生物技术有限公司)进行蛋白定量检测,根据分子量不同分别配制8~12%的SDS-PAGE凝胶,取蛋白液后用5× loading buffer补充体积至20 μL,煮沸8 min后进行电泳,80 V电压电泳,之后转换为120 V继续电泳,将凝胶去除后进行PVDF膜的转膜,采用300 mA恒流转膜0.5~2 h,PVDF膜使用5%脱脂奶粉封闭2 h,TBST稀释 I 抗,抗TIGIT和CD155抗体(Abcam)的稀释比例为1∶500/1 ∶800,I 抗孵育后PVDF膜用TBST洗2次后,用辣根过氧化物酶标记的山羊抗兔 II 抗孵育(Abcam), II 抗的稀释比例为1 ∶20 000。孵育完成后用化学发光法检测,采用Image Pro-Plus 6.0软件进行吸光度的分析,以GAPDH为内参照,结果以目的蛋白与内参照蛋白吸光度值的比值表示。
2.3ELISA法检测TIGIT和CD155的表达水平 按照上述方法提取肿瘤组织和癌旁组织中的蛋白,BCA法蛋白定量后调整蛋白浓度,参照ELISA试剂盒说明书进行蛋白浓度的检测。
3 统计学处理
实验数据以SPSS 17.0软件进行统计分析,计量资料以均数±标准差(mean±SD)表示,相关性分析采用Pearson分析,计数数据采用2检验,以P<0.05为差异有统计学意义。
结 果
1 TIGIT和CD155在结直肠癌组织和癌旁组织中的表达
TIGIT和CD155在癌旁正常组织的阳性表达率分别为8.8%(7/80)和18.8%(15/80),而在肿瘤组织中的阳性表达率分别为78.8%(63/80)和83.8%(67/80)。TIGIT在癌旁组织中表达均为阳性染色,而肿瘤组织中阳性表达率为28例,强阳性表达率为35例,而CD155在癌旁组织中表达均为阳性染色,肿瘤组织中阳性表达为30例,强阳性为37例。TIGIT和CD155在结直肠癌肿瘤组织中的阳性表达率显著高于癌旁组织(P<0.01)。染色结果见图1。

Figure 1.The expression of TIGIT and CD155 in colon cancer tissues was detected by immunohistochemical staining (×200).
图1 TIGIT和CD155在结肠癌组织中的表达
2 结直肠癌及癌旁组织中TIGIT和CD155蛋白的表达水平
Western blot和ELISA实验结果显示,TIGIT和CD155的表达水平随着病理分期的增高而增高,且TIGIT和CD155的表达呈正相关(r=0.867,P<0.01),见图2、3。
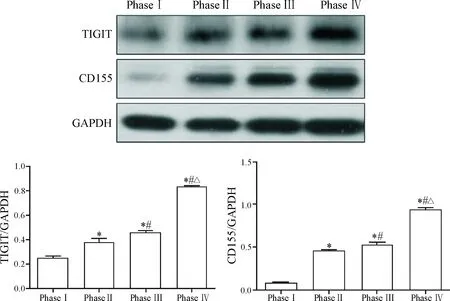
Figure 2.Relative protein expression of TIGIT and CD155 was detected by Western blot. Mean±SD.n=3.*P<0.05vsphase I group;#P<0.05vsphase II group;△P<0.05vsphase III group.
图2 Western blot法检测TIGIT和CD155蛋白的表达水平
3 结直肠癌组织中TIGIT和CD155的表达水平与临床病理-生理因素的相关性分析
结直肠癌组织中TIGIT和CD155阳性表达率与患者的年龄和性别无关(P>0.05),与肿瘤大小、淋巴结转移、肿瘤分化及病理分期具有显著相关性(P<0.05),见表1。肿瘤较大、有淋巴结转移、肿瘤分化程度低及病理分期较高的患者出现TIGTT和CD155强阳性比例高,而肿瘤较小、无淋巴结转移、肿瘤分化程度高及病理分期低的患者强阳性比例低(P<0.05),见表2。
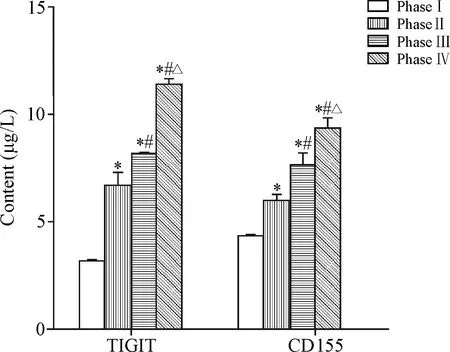
Figure 3.The protein expression of TIGIT and CD155 was detected by ELISA. Mean±SD.n=3.*P<0.05vsphase I group;#P<0.05vsphase II group;△P<0.05vsphase III group.
图3 ELISA实验检测检测TIGIT和CD155蛋白的表达水平
讨 论
TIGIT是I型跨膜蛋白,在细胞外区有免疫球蛋白的结构域,胞内含有ITIM结构域,是2008年被鉴定发现的,而TIGIT在T细胞上的功能是最早被发现和报道的,TIGIT高表达于CD45RO+T细胞上,Naive T细胞经过CD3/CD28抗体刺激后可以上调TIGIT[8-9]。同时还发现TIGIT缺失会导致小鼠实验性自身免疫性脑脊髓炎的病理状况加剧,机制的研究中发现TIGIT的缺失导致MOG肽段免疫后T细胞应答增强,这揭示了TIGIT是一种T细胞的抑制性受体[10]。目前认为TIGIT对T细胞的抑制功能主要是通过2条信号通路实现,一种是TIGIT作用于T细胞自身,通过下调T细胞抗原受体α(T cell receptor α, TCRα)链的作用抑制TCR介导的信号传导,一种是通过触发抗原呈递细胞(antigen-presenting cell, APC)上的配体PVR下游信号,增强信号分子ERK磷酸化水平,增强APC分泌抗炎因子白细胞介素10(interleukin-10, IL-10)的表达,同时IL-10继续作用T细胞,抑制T细胞免疫应答[11-12]。
表1 结直肠癌组织中TIGIT和CD155的表达水平与临床病理-生理特征的关系
Table 1.Relationship between TIGIT and CD155 and clinicopathological and physiological characteristics in colorectal cancer (%)
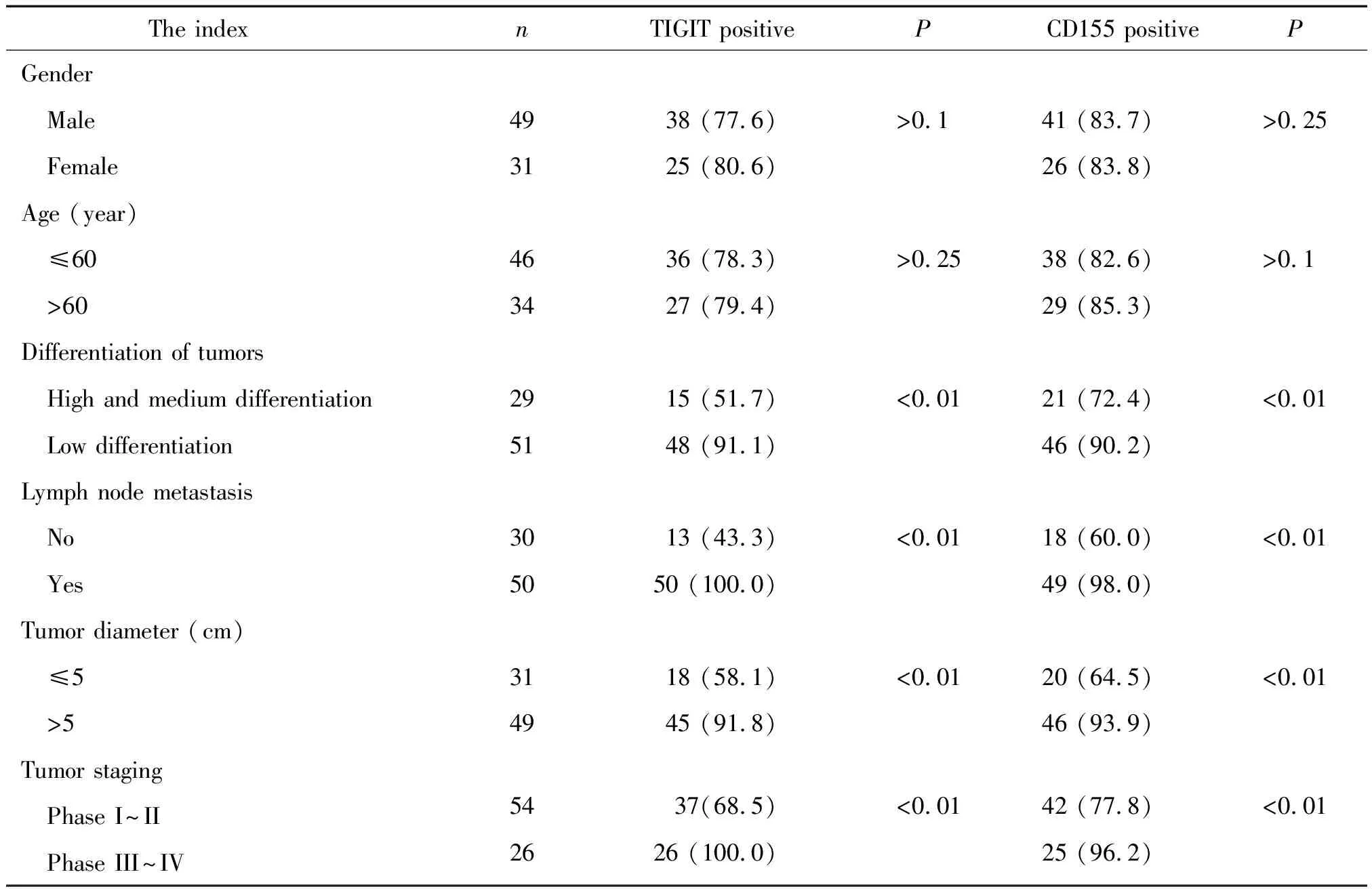
The indexnTIGIT positiveP CD155 positivePGender Male4938 (77.6)>0.141 (83.7)>0.25 Female3125 (80.6)26 (83.8)Age (year) ≤604636 (78.3)>0.2538 (82.6)>0.1 >603427 (79.4)29 (85.3)Differentiation of tumors High and medium differentiation2915 (51.7)<0.0121 (72.4)<0.01 Low differentiation5148 (91.1)46 (90.2)Lymph node metastasis No3013 (43.3)<0.0118 (60.0)<0.01 Yes5050 (100.0)49 (98.0)Tumor diameter (cm) ≤53118 (58.1)<0.0120 (64.5)<0.01 >54945 (91.8)46 (93.9)Tumor staging Phase I~II5437(68.5)<0.0142 (77.8)<0.01 Phase III~IV2626 (100.0)25 (96.2)
表2 结直肠癌组织中TIGIT和CD155强阳性表达与临床病理-生理特征的相关性分析
Table 2.The correlation between strong positive expression of TIGIT and CD155 and clinicopathological-physiological characteristics in colorectal cancer (%)
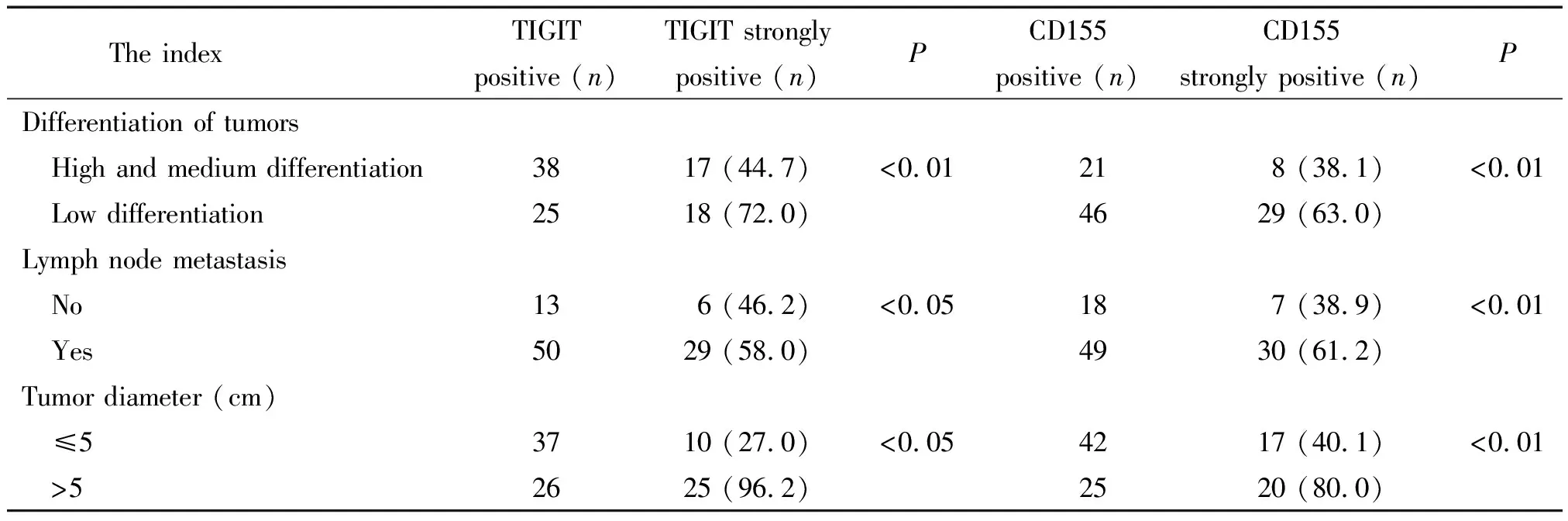
The indexTIGIT positive (n)TIGIT strongly positive (n)PCD155positive (n)CD155strongly positive (n)PDifferentiation of tumors High and medium differentiation3817 (44.7)<0.0121 8 (38.1)<0.01 Low differentiation2518 (72.0)4629 (63.0)Lymph node metastasis No13 6 (46.2)<0.0518 7 (38.9)<0.01 Yes5029 (58.0)4930 (61.2)Tumor diameter (cm) ≤53710 (27.0)<0.054217 (40.1)<0.01 >52625 (96.2)2520 (80.0)
研究表明,某些肿瘤组织中NK细胞的浸润与预后相关,NK细胞的重要功能是参与细胞免疫、肿瘤免疫和病毒感染等过程。肿瘤浸润淋巴细胞中NK细胞的数目在机体肿瘤免疫中有着重要的作用[13],Ishigami等[14]发现胃癌组织中浸润的NK细胞比例在高浸润组中显著高于低浸润组,且在淋巴结转移的患者中比例较高,同时和生存期相关,Thota等[15]研究发现NK细胞浸润的III期结直肠癌患者的预后仅次于淋巴结的转移,高浸润组5年生存率显著低于中、低浸润组。NK细胞与巨噬细胞一样,在肿瘤免疫中发挥着双刃剑的作用,通过激活不同的信号可以发挥促肿瘤/抑肿瘤的作用。在肿瘤发生的初期,NK细胞作为毒性细胞可攻击肿瘤细胞,清除少量的肿瘤细胞,而随着肿瘤的进展,NK细胞受到免疫抑制信号的影响,发挥促肿瘤作用,所以NK细胞在肿瘤中的作用是和肿瘤进展有关的。人源的NK细胞表达TIGIT,有研究发现NK细胞系中过表达TIGIT可以明显抑制NK细胞对于过表达其配体PVR的靶细胞杀伤作用[16],而通过人外周血来源的NK细胞与高表达PVR的成纤维细胞系杀伤实验中用抗体阻断TIGIT后发现,TIGIT的抑制效应弱于NK细胞上HLA受体KIR,因为认为TIGIT是NK细胞共抑制受体,而肿瘤细胞上一般会表达CD155,CD155是TIGIT的竞争性配体,当肿瘤细胞中CD155和NK细胞上的TIGIT结合后,可以发挥免疫抑制作用,降低NK细胞的杀伤作用,而这种作用和配体表达水平优势相关。另一个研究小组发现TIGIT通过其细胞内的免疫受体ITT样结构域可以介导NK细胞杀伤效应的抑制功能,TIGIT-PVR作用后,ITT样结构域通过225位磷酸化,招募Grb2接头蛋白,进一步结合SHIP1,终止PI3K和MAPK的信号,下调NK细胞的活性[5, 17]。
肿瘤细胞和抗原呈递细胞表面可以高表达CD155分子,CD155可以和NK细胞和T细胞表面的TIGIT、CD96和CD226等结合,影响细胞的免疫功能,CD155是免疫球蛋白超家族的I型跨膜糖蛋白,是NK细胞活化性受体CD226的配体,而CD226是启动NK细胞杀伤肿瘤细胞的主要活化性受体之一。目前已经发现CD155和TIGIT结合后可以抑制NK细胞的抗肿瘤作用,进一步的研究还发现TIGIT/CD155可以促进 Treg细胞的免疫抑制作用[18],增强其IL-10的释放,这种作用类似于免疫检查点PD-1/PD-L1的作用。CD155和CD122同时也是CD226的配体,与TIGIT可以结合,CD122是细胞因子受体亚基,与CD132(γc;IL-2Rγ)结合形成低亲和力IL-2受体;与CD25(IL-2Rα)和CD132结合形成高亲和力IL-2受体;与IL-2结合促进淋巴细胞增殖,分化以及参与外周耐受的调节。
结直肠癌是一种高发的恶性肿瘤,已有的研究发现,在结直肠癌中存在一定程度的免疫抑制,但是其确切的机制尚未被揭示,通过本研究的结果发现,TIGIT及其配体CD155在结直肠癌组织中存在高表达,由于TIGIT高表达于NK细胞,而CD155的结合可以抑制NK细胞的肿瘤杀伤作用,所以认为,在结直肠癌中存在TIGIT/CD155信号的高表达,而从临床数据来看,TIGIT和CD155与肿瘤分期、肿瘤体积以及淋巴结转移等密切相关,随着分期的增高,TIGIT和CD155的表达水平显著上调,与肿瘤进展存在正相关;其次,TIGIT和CD155在低分化癌表达水平高,在淋巴细胞转移的结直肠癌中表达水平增高,这暗示TIGIT与分化水平及淋巴结转移有关,因此TIGIT/CD155可以作为结直肠癌预后的预测指标。目前尚未见文献报道TIGIT/CD155在结直肠癌中的作用机制,虽然临床样本中发现TIGIT/CD155在结直肠癌中高表达,但是确切的作用还有待进一步深入研究。
综上所述,本研究发现TIGIT/CD155在结直肠癌中高表达,与肿瘤的发生发展有关,有望成为结直肠癌治疗的新靶点。
