长链非编码RNA ZFAS1/miR-150/ROCK1调控血管平滑肌细胞增殖和迁移*
2019-11-21黄伟剑
王 秋, 黄伟剑
(温州医科大学附属乐清医院, 浙江 温州 325000)
动脉粥样硬化是心肌梗死、中风、不稳定心绞痛和心脏猝死的潜在原因[1]。血管平滑肌细胞(vascular smooth muscle cells, VSMCs)是动脉壁的主要成分之一,最近的研究证明VSMCs的异常增殖和迁移是动脉粥样硬化发生发展中重要的病理生理基础[2]。因此,抑制VSMCs增殖和迁移可能在预防动脉粥样硬化的病理过程中起着重要作用,并可能成为一种新的治疗策略。
长链非编码RNA(long noncoding RNA,lncRNA)是一类长度超过200个核苷酸的非编码RNA。研究表明,lncRNA在动脉粥样硬化中表达异常,在动脉粥样硬化的发病机制中扮演着重要的角色[3]。ZNFX1 (zinc finger NFX1-type containing 1) antisense RNA 1 (ZFAS1)是位于染色体20q13的lncRNA,被报道作为肿瘤抑制基因参与肿瘤的发生发展[4]。Zhang等[5]报道ZFAS1在小鼠心肌梗死模型中表达升高,导致心脏收缩功能障碍。但是,ZFAS1在动脉粥样硬化中对血管平滑肌细胞的作用尚未见报道。本项工作探讨ZFAS1对VSMCs增殖和迁移的影响,及其在动脉粥样硬化发生发展中的可能作用机制。
材 料 和 方 法
1 实验材料
大鼠VSMCs购自ATCC。胎牛血清及DMEM培养液购自Gibco;血小板源性生长因子BB(platelet-derived growth factor-BB,PDGF-BB)购自Sigma;MTT购自上海碧云天生物技术有限公司;EdU试剂盒购自广州锐博生物公司;Transwell小室购自Corning;Lipofectamine 2000、TRIzol和qPCR引物购自Invitrogen;抗ROCK1 (Rho-associated coiled-coil-containing protein kinase 1)和GAPDH抗体及Ⅱ抗、ECL发光液购自Santa Cruz。
2 实验方法
2.1细胞分组 血管平滑肌细胞用含10%胎牛血清的培养液培养,放置于5%CO2、37℃的恒温培养箱中培养,当细胞汇合度达80%时进行传代。当细胞达到80%的汇合度时,对细胞进行无血清培养24 h。将细胞随机分组为对照(control)组、PDGF-BB组、PDGF-BB+对照siRNA(si-NC)组和PDGF-BB+ ZFAS1-siRNA(si-ZFAS1)组。Control组不做任何干预,PDGF-BB组加入20 μg/L PDGF-BB干预;PDGF-BB+si-NC组和PDGF-BB+si-ZFAS1组分别转染对照siRNA和ZFAS1-siRNA后用20 μg/L PDGF-BB干预。为了进一步验证ZFAS1和miR-150的调控作用,再将细胞随机分组为以下4组:PDGF-BB组、PDGF-BB+si-ZFAS1组、PDGF-BB+si-ZFAS1+anti-NC组和PDGF-BB+si-ZFAS1+anti-miR-150组。前2组处理如前所述,后2组在转染ZFAS1-siRNA的同时分别转染miR-150抑制剂对照(anti-NC)和miR-150抑制剂(anti-miR-150)。
2.2细胞转染 将VSMCs接种于培养液中培养,放置在5%CO2、37℃的恒温培养箱中过夜,然后按照Lipofectamine 2000转染试剂盒说明书进行操作,将si-NC、si-ZFAS1、anti-NC和anti-miR-150转染到细胞中,转染48 h后,加入20 μg/L PDGF-BB继续培养24 h。
2.3Real-time PCR检测ZFAS1、miR-150和ROCK1表达水平 用 TRIzol提取细胞的总RNA,分光光度计测定RNA浓度,按照逆转录试剂盒说明书进行反转录成cDNA。以cDNA为模板,在TaqDNA聚合酶催化下进行PCR扩增。ZFAS1上游引物序列为5’-ACGTGCAGACATCTACAA-3’,下游引物序列为5’- TACTTCCAACACCCGCAT-3’;miR-150上游引物序列为5’-GAAGATCTTCTACTTTGCGCA-3’,下游引物序列为5’-CCGCTCGAGCGGCCCTTGCTG-3’;内参照U6 上游引物序列为5’-CTCGCTTCGGCAGCACATATACT-3’,下游引物序列为5’-ACGCTTCACGAATTTGCGTGTC-3’;ROCK1上游引物序列为5’-AACATGCTGCTGGATAAATCT-3’,下游引物序列为5’-TGTATCACATCGTACCATGCC-3’;内参照GAPDH上游引物序列为5’-GAAGGTGAAGGTCGGAGT-3’,下游引物序列为5’-GAAGATGGTGATGGGATT-3’。PCR条件:94 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,扩增40个循环。用2-ΔΔCt法进行结果分析。
2.4MTT实验检测VSMCs活力 将按上述分组要求处理的细胞调整浓度为1×107/L,取100 μL接种于96孔板,每组重复4个孔,置于37 ℃、5%CO2的细胞培养箱中过夜,每孔加入10 μL MTT溶液,孵育2 h,测定450 nm处各孔的吸光度(A)值,计算出细胞活力。
2.5EdU染色检测VSMCs增殖 将按上述分组要求处理的细胞调整浓度为1×107/L,取100 μL接种于96孔板培养24 h后,加入含50 μmol/L EdU的培养液孵育2 h。根据试剂盒进行细胞固定以及DNA染色,荧光显微镜下观察,每孔随机选择3个视野,计算染色细胞核占相应总细胞的百分比。
2.6Transwell实验检测VSMCs迁移能力 将转染48 h后的细胞调整浓度为1×108/L,在上室加入200 μL细胞悬液,下室加入500 μL含有10%胎牛血清的DMEM培养液,在细胞培养箱中培养24 h。取出小室,PBS清洗3次,用甲醛固定10 min,加入0.1%的结晶紫溶液进行染色15 min,PBS洗3次,用棉签轻轻拭去小室膜内侧细胞,取下室膜平铺于载玻片上,显微镜下随机观察3个视野的细胞数量。
2.7Western blot检测ROCK1蛋白的表达水平 按上述分组要求处理细胞后,提取细胞蛋白,用BCA法检测蛋白浓度。取40 μg总蛋白进行SDS-PAGE,电泳结束后将其转至PVDF膜,室温下用5%的BSA脱脂奶粉封闭30 min,加抗ROCK1和GAPDH Ⅰ抗置于4℃孵育过夜,TBST洗膜后加入Ⅱ抗于室温下孵育2 h,TBST洗膜后用ECL液进行化学发光反应并曝光。以GAPDH为内参照,用Quantity One软件对条带灰度值进行测量并分析。
2.8萤光素酶报告基因实验 构建野生型和突变型的ROCK1萤光素酶报告质粒载体,将VSMCs按每孔1×105接种于24孔板,24 h后用Lipofectamine 2000分别与anti-NC 和anti-miR-150共转染进入VSMCs,24 h后用双萤光素酶报告系统检测海肾和萤火虫萤光素酶活性,以海肾萤光素酶为内参照,实验重复3次。
3 统计学处理
实验数据分析采用SPSS 20.0软件,采用均数±标准差(mean±SD)表示,每组实验重复3次,多组间比较采用单因素方差分析(one-way ANOVA),各组均数间的两两比较采用SNK-q法,以P<0.05为差异具有统计学意义。
结 果
1 PDGF-BB诱导ZFAS1表达上调
通过real-time PCR检测VSMCs中的ZFAS1表达,结果显示,与control组相比,PDGF-BB组VSMCs中的ZFAS1表达显著上调(P<0.05),见图1。
2 下调ZFAS1表达可抑制PDGF-BB诱导的VSMCs增殖
用siRNA干扰ZFAS1的表达后用real-time PCR检测VSMCs中ZFAS1的表达水平,结果显示,与PDGF-BB组相比,PDGF-BB+si-ZFAS1组中ZFAS1表达水平显著下调(P<0.05),见图2A。MTT结果显示,与control组相比,PDGF-BB组的VSMCs活力显著增强(P<0.05);与PDGF-BB组相比,PDGF-BB+si-ZFAS1组VSMCs活力显著降低(P<0.05),见图2B。EdU染色结果显示,与control组相比,PDGF-BB组的VSMCs增殖能力显著增强(P<0.05);与PDGF-BB组相比,PDGF-BB+si-ZFAS1组VSMCs增殖能力显著降低(P<0.05),见图2C。
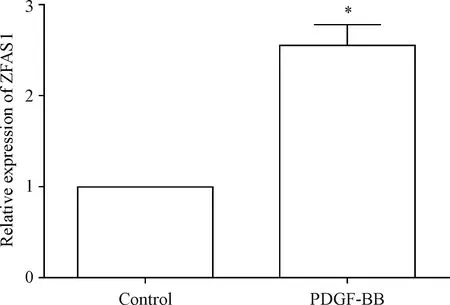
Figure 1.PDGF-BB promoted ZFAS1 expression in vascular smooth muscle cells. Mean±SD.n=3.*P<0.05vscontrol group.
图1 PDGF-BB促进血管平滑肌细胞ZFAS1表达
3 下调ZFAS1表达可抑制PDGF-BB诱导的VSMCs迁移
Transwell实验观察VSMCs的迁移能力,结果显示,与control组相比,PDGF-BB组的VSMCs迁移数目显著增多(P<0.05);与PDGF-BB组相比,PDGF-BB+si-ZFAS1组VSMCs迁移数目显著降低(P<0.05),见图3。
4 ZFAS1下调miR-150的表达
Real-time PCR检测miR-150的表达,结果显示,与control组相比,PDGF-BB组miR-150表达显著降低(P<0.05);与PDGF-BB组相比,PDGF-BB+si-ZFAS1组miR-150表达显著增加(P<0.05),见图4。
5 ZFAS1上调ROCK1的表达
Real-time PCR和Western blot检测ZFAS1对ROCK1 mRNA和蛋白表达的影响,结果显示,与control组相比,PDGF-BB组ROCK1 mRNA和蛋白表达显著增加(P<0.05);与PDGF-BB组相比,PDGF-BB+si-ZFAS1组ROCK1 mRNA和蛋白表达显著下降(P<0.05),见图5。
6 miR-150与ROCK1相结合并抑制ROCK1表达
生物信息学软件预测miR-150和靶基因ROCK1有结合位点,见图6A。萤光素酶报告基因实验结果显示,在野生型萤光素酶中转入anti-miR150后,萤光素酶活性显著高于anti-NC组的萤光素酶活性(P<0.05);而对于突变型萤光素酶,2组的萤光素酶活性无显著变化,见图6B。用Western blot实验检测到转入anti-miR-150后,VSMCs中的ROCK1蛋白表达水平显著上升(P<0.05),见图6C。
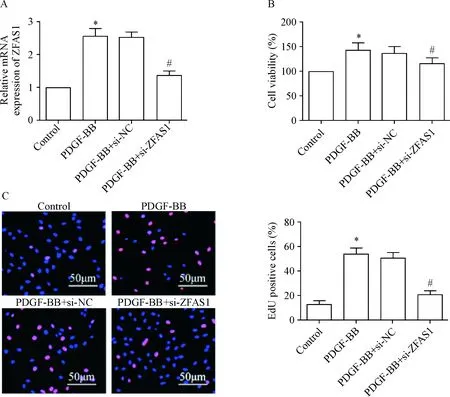
Figure 2.si-ZFAS1 inhibited PDGF-BB-induced proliferation of vascular smooth muscle cells. A: the mRNA expression of ZFAS1 was detected by real-time PCR; B: the cell viability was detected by MTT assay; C: the cell proliferation was detected by EdU staining. The nucleus is blue and the EdU is red. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPDGF-BB group.
图2 si-ZFAS1抑制PDGF-BB诱导的血管平滑肌细胞增殖
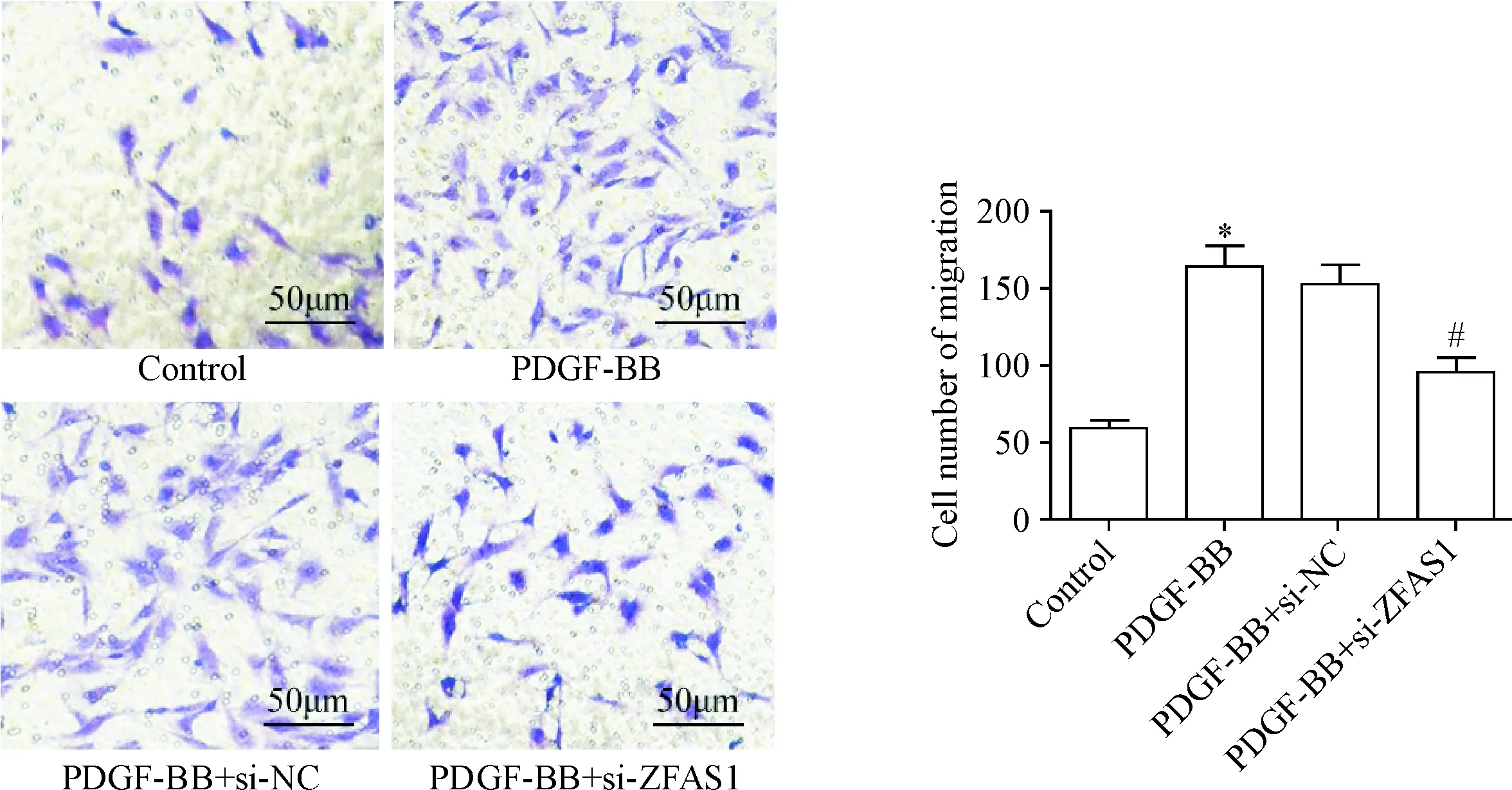
Figure 3.si-ZFAS1 inhibited PDGF-BB-induced migration of vascular smooth muscle cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPDGF-BB group.
图3 si-ZFAS1抑制PDGF-BB诱导的血管平滑肌细胞迁移

Figure 4.ZFAS1 down-regulated the expression of miR-150. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPDGF-BB group.
图4 ZFAS1下调miR-150的表达
7 ZFAS1通过调节miR-150/ROCK1调控VSMCs增殖和迁移
用Starbase和TargetScan软件分析得到,ZFAS1和RCOK1与miR-150具有相同的结合位点,见图7A。用real-time PCR检测加入anti-miR-150的VSMCs中的miR-150表达水平,结果显示,与PDGF-BB+si-ZFAS1组相比,PDGF-BB+si-ZFAS1+anti-miR-150组中miR-150表达显著下降(P<0.05),见图7B。进一步用real-time PCR检测ROCK1 mRNA表达,结果显示,与PDGF-BB+si-ZFAS1组相比,PDGF-BB+si-ZFAS1+anti-miR-150组中RCOK1 mRNA表达显著上调(P<0.05),见图7C。此外,与PDGF-BB+si-ZFAS1组相比,PDGF-BB+si-ZFAS1+anti-miR-150组中VSMCs增殖和迁移能力显著增强(P<0.05),见图7D~F。
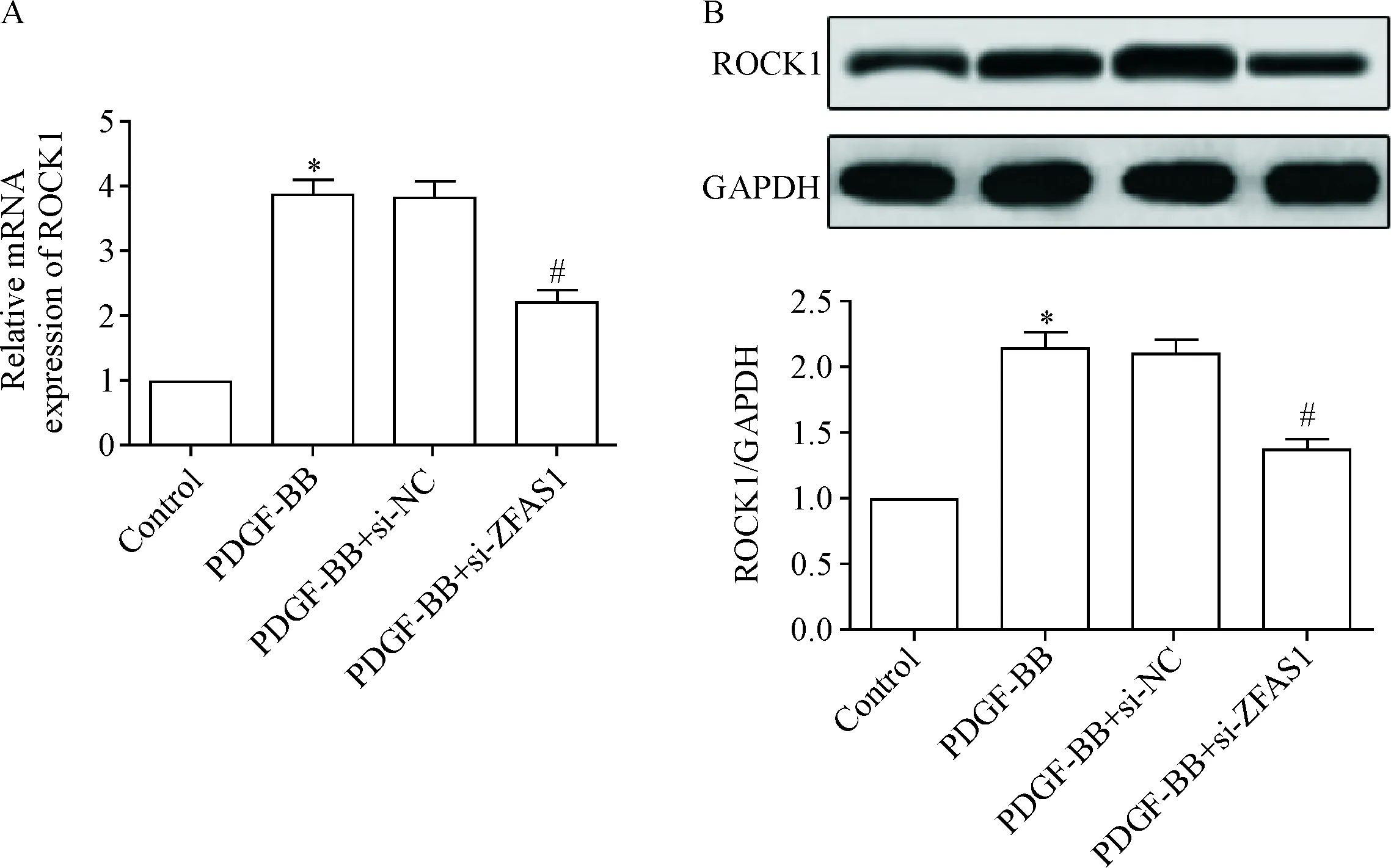
Figure 5.ZFAS1 up-regulated the expression of ROCK1. A: the mRNA expression of ROCK1 was detected by real-time PCR; B: the protein expression of ROCK1 was detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPDGF-BB group.
图5 ZFAS1上调ROCK1的表达
讨 论
VSMCs的增殖和迁移是动脉粥样硬化的重要机制之一,抑制VSMCs增殖和迁移可以延缓动脉粥样硬化进展。本研究通过PDGF-BB诱导VSMCs增殖和迁移,显示增殖和迁移的VSMCs中ZFAS1的表达上调,而下调ZFAS1后,VSMCs的增殖和迁移受到抑制。这些结果表明ZFAS1在动脉粥样硬化中起着促进VSMCs增殖和迁移的作用。
ZFAS1作为新的lncRNA在乳腺癌患者中被首次报道,随后被报道在多种肿瘤中扮演致癌基因角色[6]。近年来ZFAS1在心血管疾病中的作用也被报道。已有研究报道ZFAS1可以作为急性心肌梗死的独立预测因子[7]。Wu等[8]报道ZFAS1/miR-150轴通过调节CRP参与急性心肌梗死诱导的心肌细胞凋亡的分子机制。lncRNA可以作为竞争性内源RNA(competing endogenous RNAs,ceRNA)与miRNA相互作用,参与调控靶基因的表达,在心血管疾病的发生发展中起重要作用[9]。lncRNA TUG1在自发性高血压大鼠的主动脉中高表达,TUG1通过调控miR-145/FGF10促进VSMCs在高血压状态下的增殖和迁移[10]。Ahmed等[11]表明lncRNA NEAT1促进VSMCs
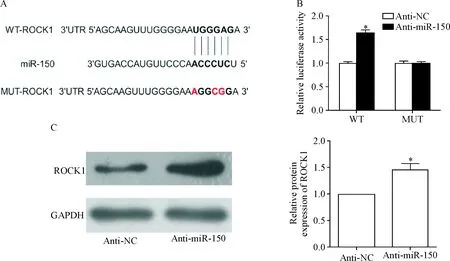
Figure 6.miR-150 bound to the 3’-UTR of ROCK1 and regulated the protein level of ROCK1 in VSMCs. A: the binding sites of miR-150 on the ROCK1 mRNA 3’-UTR; B: the relative luciferase activity was detected by dual-luciferase reporter assay; C: the expression of ROCK1 protein was detected by Western blot. Mean±SD.n=3.*P<0.05vsanti-NC group.
图6 miR-150靶向调控ROCK1的表达
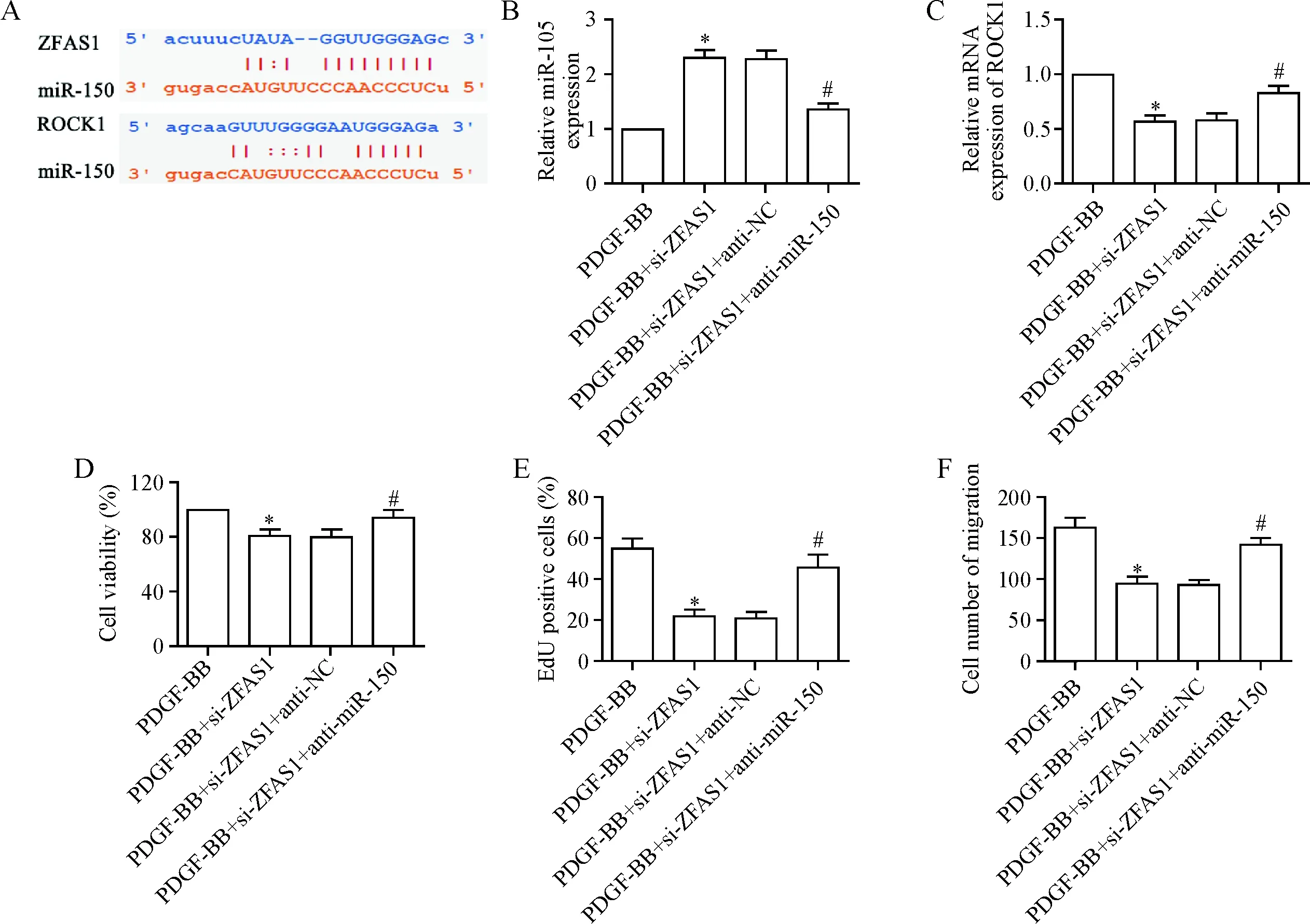
Figure 7.ZFAS1 regulated proliferation and migration of VSMCs by regulating miR-150/ROCK1. A: bioinformatic analysis for the binding sites of ZFAS1 or ROCK1 to miR-150; B: the expression of miR-150 was detected by RT-PCR; C: the expression of ROCK1 mRNA was detected by RT-PCR; D: the VSMC viability was detected by MTT assay; E: the VSMC proliferation was detected by EdU staining; F: the VSMC migration was detected by Transwell assay. Mean±SD.n=3.*P<0.05vsPDGF-BB group;#P<0.05vsPDGF-BB+si-ZFAS1 group.
图7 ZFAS1通过调节miR-150/ROCK1调控VSMCs增殖和迁移
增殖和迁移。本研究观察到ZFAS1促进VSMCs增殖和迁移,但是,ZFAS1在动脉粥样硬化中对VSMCs的具体作用尚未报道,ZAFS1可以下调miR-150的表达同时上调ROCK1的蛋白表达水平,进一步通过生物信息学检测到ZFAS1和miR-150具有结合位点,揭示ZAFS1或许是通过调节miR-150/ROCK1轴参与动脉粥样硬化的发展。
微小RNA(microRNA,miRNA)是一类内源性小的非编码RNA分子,通过结合靶基因,降解靶基因mRNA或者抑制靶基因mRNA的翻译,从而在转录后水平调控基因的表达[12]。miRNA在细胞分化、增殖、迁移和凋亡中起关键作用,参与各种疾病的发展,包括心血管疾病,并被作为临床诊断和治疗靶点来研究[13]。miR-214通过抑制靶基因NCKAP1表达抑制VSMCs增殖和迁移[14]。 miR-132通过调控靶基因PTEN表达降低VSMCs增殖和迁移[15]。ROCK是丝氨酸苏氨酸蛋白激酶,调节肌动蛋白细胞骨架,已有越来越多的研究证据表明ROCK1在心血管系统中扮演重要作用[16]。ROCK1缺乏可抑制巨噬细胞趋化,减少修饰LDL摄取和防止泡沫细胞形成从而减轻动脉粥样硬化[17]。miR-145通过调控ROCK1减轻高糖导致的VSMCs增殖和迁移[18]。本研究通过生物信息学检测到ROCK1是miR-150的靶基因,并用萤光素酶报告基因实验证实了靶向关系,并进一步观察到在VSMCs中抑制ZFAS1后,anti-miR-150可以上调ROCK1表达,促进VSMCs的增殖迁移,由此可以推测ZFAS1可能通过抑制miR-150表达促进VSMCs增殖和迁移。
综上所述,本研究明确了ZFAS1通过调控miR-150/ROCK1促进VSMCs增殖和迁移。这表明抑制ZFAS1表达可能是防治动脉粥样硬化的新靶点。但是,关于ZFAS1是否在动脉粥样硬化动物体内发挥相关作用及其具体机制尚不清楚,仍需进一步深入研究。
