黄芪甲苷抑制血管紧张素II诱导的心肌 H9c2细胞凋亡*
2019-11-21孟凡静张金国尉希清
聂 佩, 孟凡静, 张金国, 尉希清
(1济宁医学院临床医学院, 山东 济宁 272067; 2济宁医学院附属医院心内二科, 山东 济宁 272092)
心肌细胞凋亡参与多种心血管疾病的发生与发展,如心肌梗死(myocardial infarction,MI)和心力衰竭(heart failure,HF)等,凋亡通路的激活导致了心肌细胞的丢失从而导致心脏功能障碍。血管紧张素II(angiotensin II,Ang II)是由血管紧张素Ⅰ在血管紧张素转化酶的作用下,水解产生的多肽物质。既往研究发现高血压合并心血管疾病及心力衰竭患者中Ang II水平显著升高,并表明Ang II参与了心肌细胞肥大及凋亡[1-2]。黄芪甲苷(astragaloside IV,ASIV)是从中药黄芪中提取出的有效活性物质,具有抗炎、抗氧化和免疫调节等多种药理学作用[3-4]。有研究表明ASIV可逆转Ang II诱导的心肌细胞肥大[5],但其对Ang II介导的心肌细胞凋亡是否具有保护作用,及其具体机制尚不明确。本研究以Ang II诱导心肌细胞凋亡为基础,发现ASIV对Ang II诱导的心肌细胞具有保护作用,并初步探讨了其相关机制,为ASIV在心血管疾病方面的应用提供了更有力的证据,为心血管疾病的治疗提供了新方向。
材 料 和 方 法
1 细胞及试剂
心肌H9c2细胞购自中科院上海细胞生物学研究所。DMEM高糖培养基、胎牛血清、0.25%胰蛋白酶购自 Gibco;ASIV购自南京春秋生物技术有限公司;Ang II购自上海源叶生物技术有限公司;二甲基亚砜(dimethyl sulfoxide, DMSO)购自北京Apuris生物技术有限公司;Bax兔多克隆抗体、Bcl-2兔多克隆抗体、核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2)兔多克隆抗体、血红素加氧酶1(heme oxygenase-1, HO-1)兔多克隆抗体、β-actin兔多克隆抗体和羊抗兔IgG-HRP均购自ABclonal Technology;一步法 TUNEL细胞凋亡检测试剂盒、DAPI和ECL 显影液购自碧云天生物技术研究所;Lipofectamine 2000 转染试剂盒购自Invitrogen。
2 方法
2.1心肌H9c2细胞的培养 心肌H9c2细胞置于含10%胎牛血清的高糖DMEM 培养基中,在 5% CO2、37 ℃培养箱中培养。待细胞生长至培养瓶底面积的90%左右时,加入0.25%胰蛋白酶消化传代或冻存。
2.2Ang II及ASIV的配制 Ang II溶于PBS中,配制成1 000 μmol/L母液,根据需要浓度再行稀释。ASIV粉剂先用DMSO溶为溶剂,再溶于含有 10%胎牛血清的高糖DMEM 培养基中,DMSO浓度不得超过0.1%[4]。
2.3shRNA转染 构建并筛选Nrf-shRNA质粒,以3 μg质粒转染H9c2细胞,转染方法参照 Lipofectamine 2000 试剂盒说明书进行,转染 4 h 后更换有血清 DMEM 培养液继续培养24 h。
2.4H9c2细胞的分组及处理 取对数生长期细胞,0.25%胰蛋白酶消化后铺于6孔板或96孔板,待细胞长至80%左右时进行药物干预。转染前实验分为以下6组:(1)对照(control)组:心肌 H9c2细胞普通培养基培养24 h,未做任何处理;(2)ASIV组:心肌 H9c2细胞中加入100 μmol/L浓度ASIV培养24 h;(3)Ang II组:心肌 H9c2细胞加入1 μmol/L浓度Ang II培养24 h;(4)Ang II+ASIV 25 μmol/L组:用25 μmol/L浓度ASIV预处理心肌 H9c2细胞30 min,再加入1 μmol/L浓度Ang II培养24 h;(5)Ang II+ASIV 50 μmol/L组:用50 μmol/L浓度ASIV预处理心肌 H9c2细胞30 min,再加入1 μmol/L浓度Ang II培养24 h;(6)Ang II+ASIV 100 μmol/L组:用100 μmol/L浓度ASIV预处理心肌 H9c2细胞30 min,再加入1 μmol/L浓度Ang II培养24 h。转染后分为以下8组:(1)NC+control组:NC质粒转染后,普通培养基培养24 h,未做任何处理;(2)NC+Ang Ⅱ组:NC质粒转染后,加入1 μmol/L浓度AngⅡ培养24 h;(3)NC+ASIV组:NC质粒转染后,加入100 μmol/L浓度ASIV培养24 h;(4)NC+Ang Ⅱ+ASIV组:NC质粒转染后,用100 μmol/L浓度ASIV预处理H9c2心肌细胞30 min,再加入1 μmol/L浓度Ang Ⅱ培养24 h;(5)shRNA+control组:shRNA质粒转染后,普通培养基培养24 h,未做任何处理;(6)shRNA+Ang Ⅱ组: shRNA质粒转染后,加入1 μmol/L浓度Ang Ⅱ培养24 h;(7)shRNA+ASIV组:shRNA质粒转染后,加入100 μmol/L浓度ASIV培养24 h;(8)shRNA+Ang Ⅱ+ASIV组:shRNA质粒转染后,用100 μmol/L浓度ASIV预处理H9c2心肌细胞30 min,再加入1 μmol/L浓度Ang Ⅱ培养24 h。
2.5CCK-8法检测细胞活力 取对数生长期细胞,0.25%胰蛋白酶消化铺于96孔板中,使最终密度为每孔4×103,培养12 h后给予药物干预,24 h后加入CCK-8试剂继续孵育2 h后用酶标仪于450 nm测定吸光度(A)值,630 nm作为参考波长进行双波长测定。
2.6TUNEL检测细胞凋亡 取对数生长期细胞,0.25%胰蛋白酶消化后种于6孔板的玻璃爬片上,给予不同药物干预后,用PBS洗涤1次,再用4%多聚甲醛固定。每张玻片上加入100 μL TUNEL检测液,37 ℃避光孵育60 min,PBS洗3次后加入含DAPI的抗荧光淬灭封片剂,在激光共聚焦荧光显微镜下观察拍片。
2.7DCFH-DA标记法检测活性氧簇(reactive oxygen species,ROS)的水平 在6孔板的玻璃爬片中给予不同药物干预,去除培养基后,加入DCFH-DA 1 mL在37 ℃下培养20 min,然后在激光共聚焦荧光显微镜下观察拍片。
2.8Western blot检测蛋白的表达水平 心肌H9c2细胞按上述方法进行药物干预后,每孔加入蛋白裂解液裂解,提取各组H9c2细胞的蛋白,BCA法进行蛋白浓度检测,蛋白定量及变性后通过 Western blot 检测各组心肌细胞中Bax、Bcl-2、Nrf2和HO-1的蛋白表达水平,具体操作参考文献[6]。
3 统计学处理
实验数据采用 SPSS 13.0 进行统计学分析。数据以均数±标准差(mean±SD)表示。首先通过单因素方差分析明确各组数据有无统计学差异,对于有统计学差异的采用SNK-q检验进行组间多重比较,明确哪两组间存在差异。以P<0.05表示差异有统计学意义。
结 果
1 ASIV对Ang II诱导的心肌 H9c2细胞活力及生长情况的影响
分别用0、0.01、0.1、1、10和100 μmol/L浓度的Ang II干预心肌 H9c2细胞24 h,CCK-8法检测结果显示,Ang II可抑制心肌 H9c2细胞的活力,且呈浓度依赖性,其中1、10和100 μmol/L较对照组显著降低(P<0.05),见图1。后续实验以1 μmol/L的Ang II为干预浓度。以0、6.25、12.5、25、50和100 μmol/L的ASIV预处理心肌 H9c2细胞30 min, 再使用1 μmol/L Ang II干预24 h,结果显示ASIV可逆转Ang II对心肌 H9c2细胞活力的抑制作用,且呈浓度依赖性,其中(6.25~100)μmol/L与0 μmol/L(即Ang II组)相比差异均具有统计学意义(P<0.05),见图2。后续实验以25、50和100 μmol/L的ASIV为梯度干预浓度。图3为对照组、ASIV组、Ang II组和Ang II+ASIV(25、50和100 μmol/L)组心肌 H9c2细胞的生长状态,可以看出:对照组与ASIV组的细胞形态大致相同,呈长梭状,胞浆丰富,排列有序;Ang II组心肌细胞呈短梭形,排列紊乱,可见漂浮死亡细胞;Ang II+ASIV组的细胞可见100 μmol/L ASIV预处理组的细胞状态与对照组细胞相似。
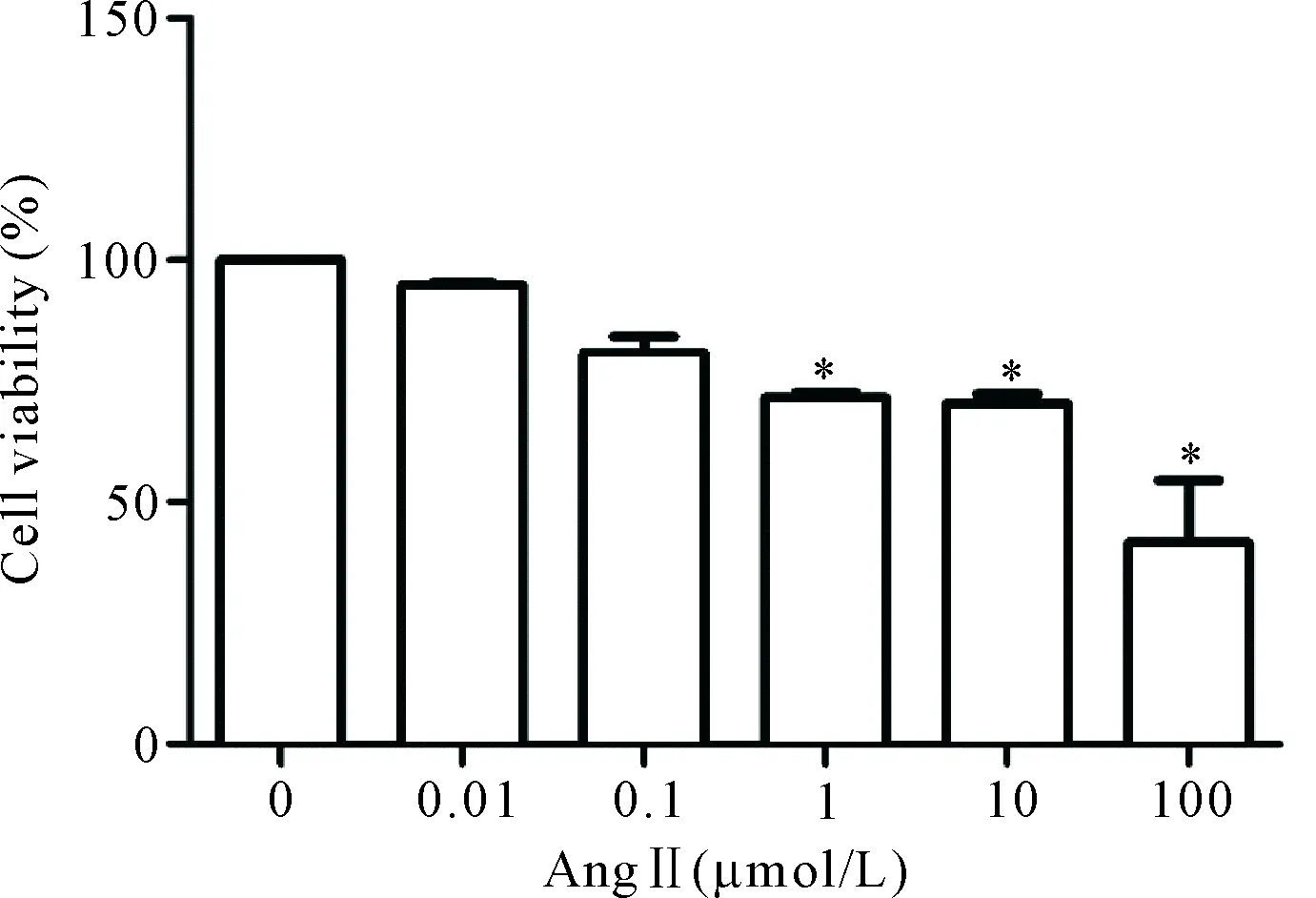
Figure 1.The effects of Ang II at different concentrations on the viability of H9c2 cardiomyocytes. Mean±SD.n=5.*P<0.05vs0 μmol/L group.
图1 不同浓度Ang II对H9c2心肌细胞活力的影响
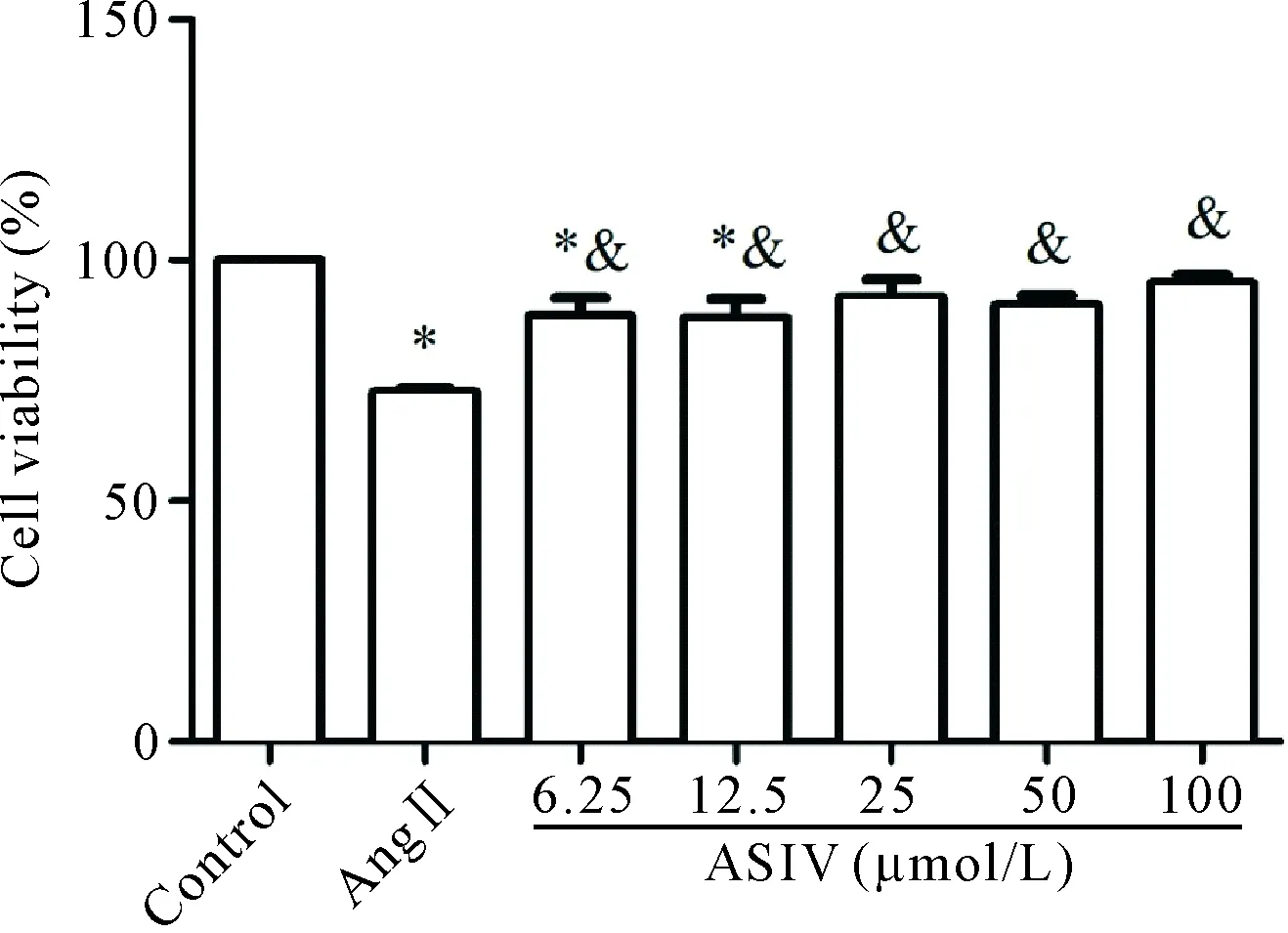
Figure 2.The effects of ASIV at different concentrations on the viability of H9c2 cardiomyocytes induced by Ang II. Mean±SD.n=5.*P<0. 05vscontrol group;&P<0.05vsAng II group.
图2 不同浓度ASIV对Ang II诱导的心肌 H9c2细胞活力的影响
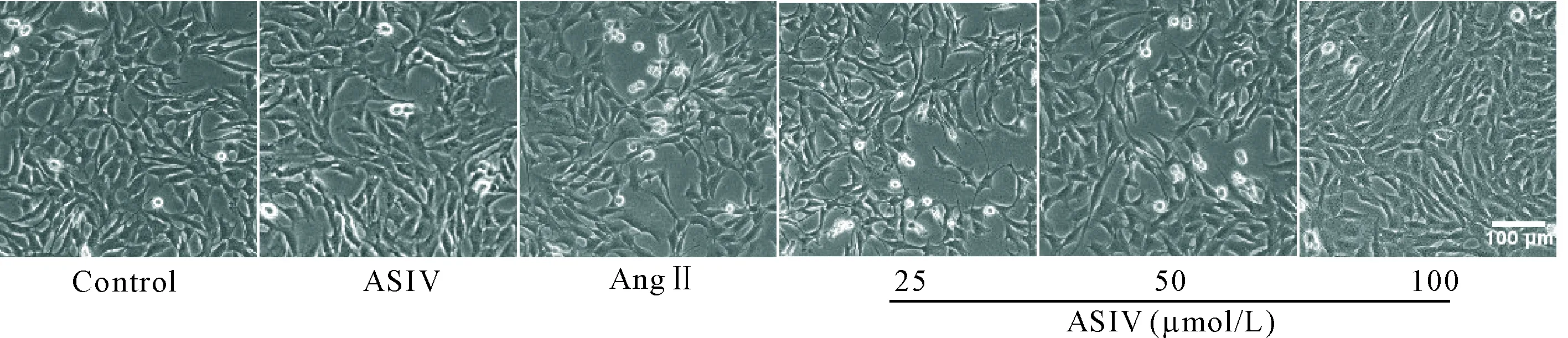
Figure 3.The effects of ASIV on the growth of H9c2 cardiomyocytes treated with Ang II.
图3 ASIV对Ang II干预的心肌 H9c2细胞生长情况的影响
2 ASIV对Ang II诱导的心肌 H9c2细胞凋亡的影响
TUNEL法检测细胞凋亡率显示,与对照组相比,Ang II组的细胞凋亡率明显增高,ASIV可呈浓度依赖性降低Ang II诱导的心肌细胞凋亡(P<0.05),见图4。Ang II组的Bax蛋白表达较对照组呈明显上升趋势(P<0.05),Ang II+ASIV组则较Ang II组下降(P<0.05),Bcl-2蛋白表达则与之相反(P<0.05),且随ASIV干预浓度不同呈剂量依赖性,见图5。
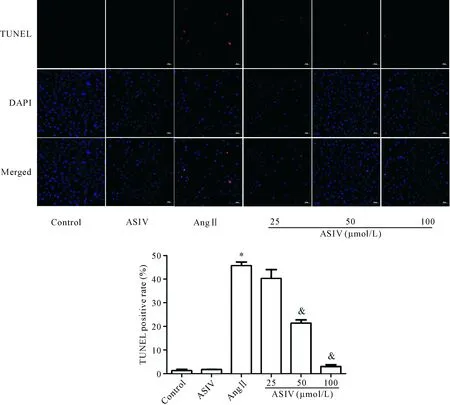
Figure 4.The effects of ASIV on the apoptosis of H9c2 cardiomyocytes induced by Ang II (×100). Mean±SD.n=5.*P<0.05vscontrol group;&P<0.05vsAng II group.
图4 ASIV对Ang II诱导的心肌 H9c2细胞凋亡的影响
3 ASIV对Ang II诱导的ROS产生的影响
与对照组相比,ASIV组ROS水平的差异无统计学显著性(P>0.05),Ang II组的ROS水平显著增加,Ang II+ASIV组的ROS水平较Ang II组呈浓度依赖性降低(P<0.05),见图6,表明ASIV可降低Ang II诱导的ROS产生。
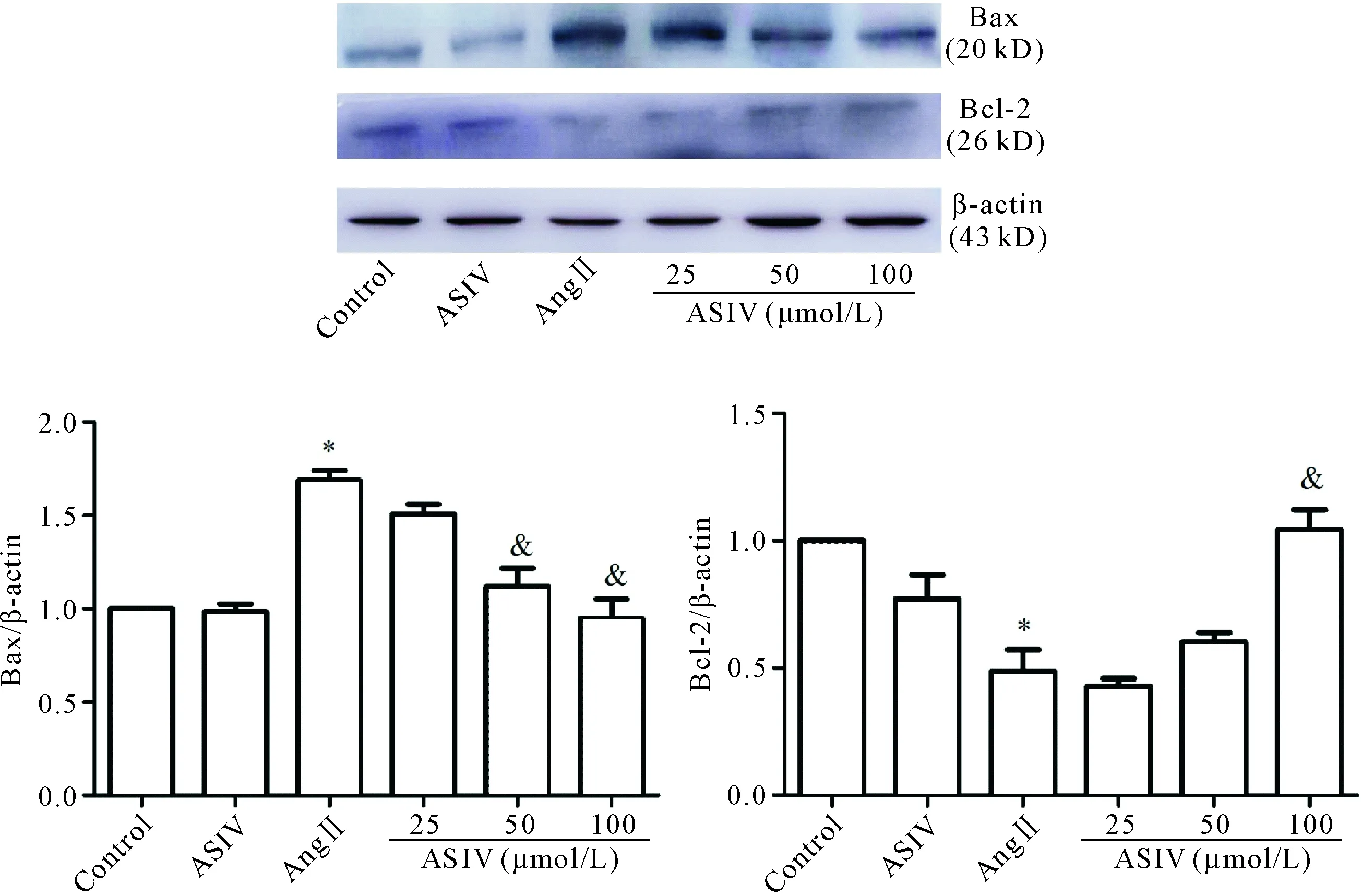
Figure 5.The effects of ASIV on the levels of apoptosis-related proteins in the H9c2 cardiomyocytes induced by Ang II were determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;&P<0.05vsAng II group.
图5 Western blot检测ASIV对Ang II诱导的心肌 H9c2细胞凋亡相关蛋白表达的影响

Figure 6.The effects of ASIV on ROS production in the H9c2 cells induced by Ang II (×200). Mean±SD.n=5.*P<0.05vscontrol group;&P<0.05vsAng II group.
图6 ASIV对Ang II诱导心肌 H9c2细胞ROS生成的影响
4 ASIV对Nrf2/HO-1信号通路相关蛋白表达的影响
Ang II组的Nrf2和HO-1蛋白表达较对照组呈明显下降趋势,Ang II+ASIV组则可上调Nrf2和HO-1蛋白表达(P<0.05),且随ASIV干预浓度不同呈剂量依赖性,见图7。这一结果提示ASIV抑制心肌细胞凋亡的作用可能与Nrf2/HO1信号通路有关。
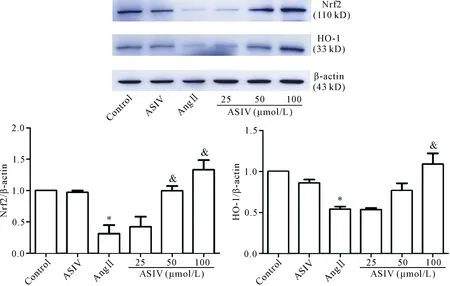
Figure 7.The effects of ASIV on the protein expression of Nrf2 and HO-1 in the H9c2 cells were determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;&P<0.05vsAng II group.
图7 Western blot检测ASIV对Nrf2和HO-1蛋白表达的影响
5 转染后ASIV对ROS水平及Nrf2/HO-1信号通路的影响
为进一步验证ASIV是通过调节Nrf2/HO-1信号通路而发挥作用,我们对H9c2细胞进行Nrf2-shRNA质粒转染。转染后干预显示,与NC+control组相比,NC+AngⅡ组及shRNA+AngⅡ组ROS水平升高,Nrf2和HO-1 蛋白的表达水平降低(P<0.05);与NC+AngⅡ组相比,NC+Ang II+ASIV组ROS水平降低,Nrf2和HO-1蛋白的表达水平升高(P<0.05),shRNA+AngⅡ组及shRNA+AngⅡ+ASIV组ROS水平升高,Nrf2和HO-1蛋白的表达水平降低(P<0.05),见图8。这一结果提示ASIV是通过介导氧化应激,调节Nrf2/HO1信号通路而发挥细胞保护作用。
讨 论
黄芪是一种传统中药,其有效成分ASIV具有强大的抗炎、抗纤维化、抗氧化应激、抗哮喘、抗糖尿病和免疫调节等多重药理作用[7]。此外,ASIV还可逆转心肌细胞肥大,抑制心肌纤维化,改善心室重塑,从而发挥保护心脏的作用,但其具体作用机制仍不够明确。本研究利用Ang II诱导心肌H9c2细胞凋亡,发现ASIV对Ang II诱导的心肌H9c2细胞凋亡具有浓度依赖性的抑制作用,并进一步探讨其对ROS水平及Nrf2/HO-1通路蛋白的影响,发现ASIV能降低Ang II诱导的ROS产生,上调Nrf2和HO-1的表达水平,且这一作用在Nrf2-shRNA转染后被消除,表明ASIV可能通过降低ROS水平,并介导Nrf2/HO-1信号通路发挥细胞保护作用。
细胞凋亡是维持正常细胞更新及组织内稳定的重要部分,是受损细胞死亡、正常细胞替代的运行机制,是一个活跃的、具有能量依赖性的细胞死亡机制[8]。心肌细胞凋亡导致的心肌细胞丢失是影响心脏结构和功能的重要因素,在HF的发展进程中占主导地位。心肌细胞凋亡参与了心肌肥厚大鼠模型的建立及HF患者的心肌损害发生[9]。有研究表明,在心脏肥大的进展过程中,心脏多由同心性肥大向偏心性肥大发展,导致心肌纤维化和心肌细胞凋亡,最终导致心力衰竭[10]。另有研究表明,心肌细胞凋亡与心肌成纤维细胞的活化及肌成纤维细胞的转化导致心肌细胞的丢失,造成心功能恶化,最终导致心室重塑甚至心力衰竭[11]。Ang II是RAAS系统的主要介导者,其可通过引起血压升高,从而影响心血管功能。此外,它还可以直接调节心肌细胞生理学,对心肌的收缩,心肌细胞的代谢,心肌细胞的凋亡及心肌的肥厚性生长均有明显作用[12]。本研究通过Ang II诱导H9c2心肌细胞凋亡,结果表明ASIV可提高心肌 H9c2细胞活性,降低Ang II诱导的细胞凋亡率,下调促凋亡蛋白Bax的表达,上调抗凋亡蛋白Bcl-2的表达,从而发挥抗凋亡作用,这与以往的研究相一致。Mei等[4]通过构建大鼠心肌肥厚模型,验证了ASIV可抑制心肌细胞凋亡,其机制可能为减轻氧化应激、降低calpain活性,及抑制calpain-1蛋白表达。Guan[13]等发现ASIV可抑制氧化应激导致的心肌细胞凋亡, 并进一步证实其与激活线粒体上ATP敏感性钾通道及减轻心肌细胞内钙超载相关。

Figure 8.The effects of ASIV on ROS level (A) and Nrf2/HO-1 signaling pathway (B) after transfection. Mean±SD.n=3.*P<0.05vsNC+control group;&P<0.05vsNC+Ang II group;△P<0.05vsshRNA+control group;▲P<0.05vsNC+Ang II+ASIV group.
图8 转染后检测ASIV对ROS水平及Nrf2/HO-1信号通路的影响
氧化应激被认为是心脏病发病机制的关键因素之一,参与了心肌肥厚、心肌重塑、糖尿病性心肌病甚至心力衰竭的发生及发展[14-15],其中ROS水平的增加是诱导氧化应激损害的主要因素之一[16]。有研究表明,ROS是正常细胞有氧代谢的副产物,对维持细胞内信号转导及机体内环境稳定具有重要作用,但过量的ROS将通过细胞氧化应激反应诱导细胞凋亡甚至坏死。在Ang II的介导的蛋白质、细胞器、DNA等细胞内结构的破坏过程中可见ROS的大量产生[17]。另有研究表明,Ang II可直接抑制心肌细胞存活机制,导致心肌细胞凋亡,并诱导ROS和转化生长因子(transforming growth factor, TGF)大量产生,最终诱导心肌纤维化[18-19]。本研究通过检测Ang II对心肌细胞内ROS水平的影响,发现Ang II可诱导心肌细胞内ROS的产生,而ASIV可降低ROS水平,减轻氧化应激,从而发挥抗心肌细胞凋亡作用,这与既往研究结果相一致。既往有研究通过构建缺氧/复氧模型,发现ASIV可通过降低心肌细胞内ROS水平、上调心肌细胞Hes1蛋白表达而调控心肌细胞Notch1/Hes1信号通路,从而发挥对心肌细胞的保护作用[20]。
Nrf2是氧化还原稳态和细胞抗氧化防御的关键调节因子,在内源及外源性应激下,通过与启动子区ARE结合,调节抗氧化防御基因如HO-1的表达[21-22]。在动脉粥样硬化、高血压和糖尿病型心肌病等心血管疾病中,细胞氧化还原平衡被打破,Nrf2表现出高度敏感性[25]。另有研究通过构建心肌肥厚模型发现,Nrf2的介导抑制了Ang II诱导的心肌肥厚,进一步表明Nrf2/HO-1信号通路参与了心脏损伤的调控进程[24]。既往研究表明,细胞间过量产生的ROS诱导Nrf2的靶向抗氧化基因发挥保护作用;相反,Nrf2防御系统激活通过调节ROS和炎症过程减轻氧化应激损伤[25-26]。另有研究表明,杨梅素可通过增强Nrf2和HO-1基因的表达对糖尿病心肌病具有潜在的保护作用,从而减轻氧化应激、炎症、凋亡和纤维化[27]。此外,有研究证实,人参皂苷Rg1可通过激活Nrf2/HO-1信号通路来保护心肌细胞免受缺氧/复氧损伤,其作用与保护心肌细胞免受氧化应激损害相关[28]。ASIV作为一种抗氧化剂,已被证实在神经元中通过抑制ROS生成并激活Nrf2信号通路发挥作用,但在心肌细胞中作用机制尚不明确。本研究通过Ang II诱导心肌细胞凋亡,检测Nrf2及其下游基因HO-1的蛋白表达,发现ASIV可抑制Ang II诱导心肌细胞中Nrf2及HO-1蛋白水平的下降,上调Nrf2和HO-1蛋白的表达,转染后这一作用被消除,从而表明ASIV通过Nrf2/HO-1信号通路发挥心肌细胞保护作用。
综上所述,我们通过对凋亡率的检测、ROS水平、凋亡蛋白及Nrf2/HO-1信号通路蛋白表达的研究,发现ASIV对Ang II诱导的心肌细胞凋亡具有抑制作用,其作用与降低ROS水平,减轻氧化应激,并介导Nrf2/HO-1信号通路相关。但本研究仅从心肌细胞株即H9c2细胞层面探讨了ASIV对心肌细胞保护作用及其机制,仍需进一步从原代心肌细胞及大鼠体内进行探究,以期为ASIV对心血管疾病的保护作用提供新的理论依据,为ASIV在心血管疾病领域的应用开拓了更广阔的前景。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
