ω-3多不饱和脂肪酸对重型颅脑损伤患者术后免疫功能影响的研究
2019-11-19汤崇辉方战舰胡益岚单钰栋童云陈梦丹魏晓捷
汤崇辉 方战舰 胡益岚 单钰栋 童云 陈梦丹 魏晓捷

[摘要] 目的 探讨ω-3多不饱和脂肪酸对重型颅脑损伤患者术后营养状况及免疫功能的影响。 方法 采用隨机数字法将2017年7月~2018年6月入住本院符合研究条件的82例重型颅脑损伤患者分为两组:常规肠内营养组(对照组,40例)和ω-3多不饱和脂肪酸组(ω-3组,42例)。对照组给予常规肠内营养制剂瑞代,ω-3组给予富含ω-3多不饱和脂肪酸的肠内营养制剂瑞能。分别检测患者第1天、第4天、第7天和第14天的血清白蛋白、前白蛋白、免疫球蛋白(IgG、IgA和IgM)水平,测定CRP的变化、GCS评分和感染的发生率。 结果 给予肠内营养支持后,两组患者的血清白蛋白和前白蛋白均有升高,第14天与第1天比较,差异有统计学意义(P<0.05),组间比较差异无统计学意义(P>0.05);与对照组相比,ω-3组免疫球蛋白的增加差异有统计学意义(P<0.05);两组患者CRP比较差异有统计学意义(P<0.05),ω-3组下降多于对照组,差异有统计学意义(P<0.05);两组患者GCS评分均有改善,组间比较差异无统计学意义(P>0.05);ω-3组肺部感染的发生率低于对照组,差异有统计学意义(P<0.05)。 结论 ω-3多不饱和脂肪酸能够改善重型颅脑损伤患者的营养状况,促进免疫功能的恢复,减少患者术后肺部感染的发生率。
[关键词] 颅脑损伤;肠内营养;免疫营养;ω-3多不饱和脂肪酸;免疫功能
[中图分类号] R651.15 [文献标识码] A [文章编号] 1673-9701(2019)25-0018-05
Effect of omega-3 polyunsaturated fatty acids on postoperative immune function in patients with severe head injury
TANG Chonghui FANG Zhanjian HU Yilan SHAN Yudong TONG Yun CHEN Mengdan WEI Xiaojie
Department of Neurosurgery, Cixi Hospital Affiliated to Wenzhou Medical University, Cixi 315300, China
[Abstract] Objective To explore the effect of omega-3 polyunsaturated fatty acids on postoperative immune function in patients with severe head injury. Methods 82 patients with severe head injury treated in our hospital from July 2017 to June 2018 were randomly divided into two groups, the routine enteral nutrition group(control group, 40 cases) and the ω-3 polyunsaturated fatty acid group(ω-3 group, 42 cases). The control group was given a conventional enteral nutrition preparation, and the omega-3 group was given an enteral nutrition preparation rich in omega-3 polyunsaturated fatty acid. The serum albumin, prealbumin, and immunoglobulin (IgG, IgA, and IgM) levels were measured on day 1, day 4, day 7, and day 14, respectively, and CRP changes, GCS scores, and incidence of infection were measured. Results After administration of enteral nutrition, albumin and prealbumin were increased in both groups. On the 14th day compared with the first day, the difference was statistically significant(P<0.05). There was no significant difference between the two groups(P>0.05). The immunoglobulin in ω-3 group was more increased than that in the control group, with the difference statistically significant (P<0.05). The difference of CRP between the two groups was statistically significant(P<0.05). The ω-3 group decreased more than the control group, with statistical significance(P<0.05). The GCS scores of the two groups were improved. There was no significant difference between the two groups(P>0.05). The incidence of pulmonary infection in the omega-3 group was lower than that in the control group(P<0.05). Conclusion Omega-3 polyunsaturated fatty acids can improve the nutritional status of patients with severe craniocerebral injury, promote the recovery of immune function, and reduce the incidence of postoperative pulmonary infection.
[Key words] Craniocerebral injury; Enteral nutrition; Immune nutrition; Omega-3 polyunsaturated fatty acid; Immune function
近年来,尽管颅脑损伤患者的预后有所改善,但重型颅脑损伤患者的死亡率和致残率仍居高不下[1]。重型颅脑损伤患者术后常存在意识及吞咽功能障碍、急性应激反应、激素分泌及内脏功能失衡等代谢紊乱,导致营养不良和免疫功能下降,继而使患者感染、脏器功能障碍、死亡风险增加,影响临床结局[2]。已有研究发现,免疫增强型肠内营养制剂能调节机体免疫系统,既能防止免疫功能低下,又能防止出现过度的炎性反应,维持机体免疫稳态,从而进一步改善蛋白代谢,维护肠黏膜屏障,以达到免疫营养的目的[3]。但免疫营养制剂对颅脑外伤术后患者的有效性尚未见系统性研究。本研究主要针对ω-3多不饱和脂肪酸(ω-3PUFAs)对重型颅脑损伤术后患者免疫功能、炎症反应及肺部感染的发生率进行研究,现报道如下。
1 资料与方法
1.1一般资料
选取2017年7月~2018年6月我院神经外科收治的重型颅脑损伤患者。纳入标准:①临床明确诊断的急性重症颅脑损伤开颅手术患者;②伤后48 h内入院;③术前GCS评分[4]4~8分;④年龄18~70岁;⑤患者家属知情同意参与研究。排除标准:①双瞳散大固定、无自主呼吸者;②严重复合伤,或主要损伤部位不在颅脑者;③术中急性脑膨出,血压需大剂量升压药维持或多次开颅手术者;④基础脏器疾病,如严重心脏病、肝肾功能异常者;⑤糖尿病及其他影响内分泌代谢疾病者;⑥消化道严重器质性疾病或肠内营养支持治疗禁忌证者;⑦恶性肿瘤者;⑧妊娠期女性[5,6]。根据纳入和排除标准,共入组患者82例,采用随机数字表法分为常规肠内营养组(对照组)和ω-3多不饱和脂肪酸组(ω-3组)。对照组40例,其中男27例,女13例,年龄(42.6±10.1)岁;术前格拉斯哥昏迷(GCS)评分(5.5±1.0)分;脑挫裂伤12例,急性硬膜下血肿7例,脑内血肿7例,急性硬膜外血肿8例,急性硬膜下血肿合并脑挫裂伤6例;ω-3组42例,其中男26例,女16例,年龄(43.5±12.4)岁;术前GCS评分(5.6±0.9)分;脑挫裂伤11例,急性硬膜下血肿10例,脑内血肿7例,急性硬膜外血肿7例,急性硬膜下血肿合并脑挫裂伤7例。两组间一般资料比较差异无统计学意义(P均>0.05),具有可比性。
1.2 方法
两组患者均在入院第1天留置鼻胃管,使用营养泵经鼻胃管匀速泵入营养液。ω-3组首日给予400 mL的瑞能(华瑞制药有限公司,国药准字:H20040722)提供肠内营养(每100 mL瑞能中含ω-3多不饱和脂肪酸0.3 g),以后每天增加200 mL,至1 000 mL/d。对照组首日给予400 mL瑞代(华瑞制药有限公司,国药准字:J20140077)提供肠内营养能量,以后每天增加200 mL,至1 000 mL/d。所有患者供给目标为25 kcal/(kg·d)。控制血糖在(7.8~10.0)mmol/L。不足的热量两组患者均通过中心静脉给予。所有患者均根据颅脑创伤指南予以静脉营养、降颅压、预防感染、神经营养、预防癫痫等同质化治疗[7]。
1.3并发症处理
患者出现腹胀或呕吐,减慢营养液泵入速度,减少泵入总量,可加用胃肠道动力药物。患者出现腹泻(稀便>3 次),减慢泵入速度,减少泵入总量。患者出现上消化道出血,静脉滴注奥美拉唑(辰欣药业股份有限公司,国药准字:H20083922)40 mg,2次/d。若血性胃内容物>100 mL,暂停肠内营养;若血性胃内容物<100 mL,减速泵入,每天查胃内容物潜血,直至2次潜血阴性。患者出现胃动力不全,若胃液残留>200 mL,加用甲氧氯普胺(上海现代哈森药业有限公司,国药准字:H20044996)10 mg肌肉注射治疗,若持续潴留,置入鼻空肠管给予肠内营养[8]。
1.4观察指标
两组患者分别于手术后第1天、第4天、第7天和第14天测定血清白蛋白、前白蛋白、IgG、IgA、IgM、C-反应蛋白的含量(日立全自动生化仪7600DDP,日本),评估GCS评分,统计住院期间肺部感染的发生率。
1.5 统计学分析
应用SPSS16.0统计学软件进行统计分析,计量资料以均数±标准差(x±s)表示,采用t检验,组内各时间点比较采用单因素方差分析,并进一步用LSD检验作两两比较;计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
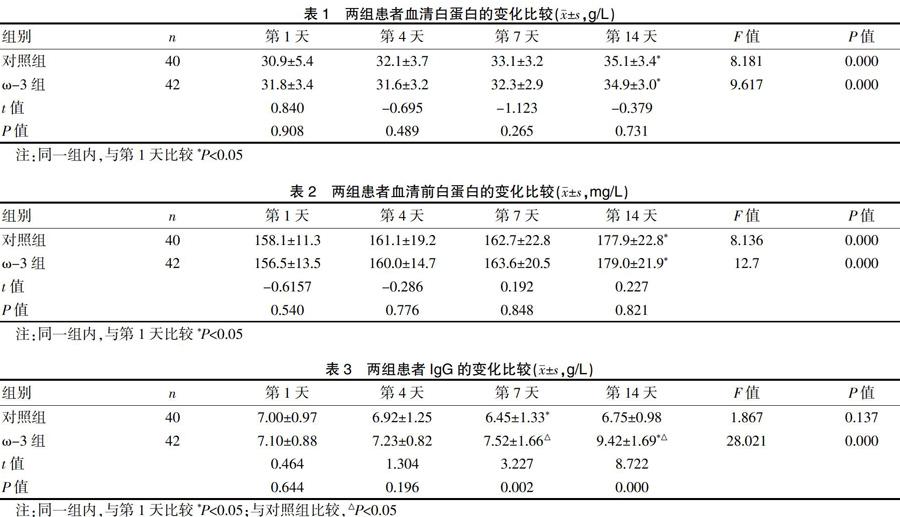
2.1 兩组患者血清白蛋白的变化比较
经肠内营养治疗,两组患者的白蛋白均逐步升高,对照组从第1天的(30.9±5.4)g/L升高到第14天的(35.1±3.4)g/L。ω-3组从第1天的(31.8±3.4)g/L升高到第14天的(34.9±3.0)g/L。两组第14天与第1天比较,差异有统计学意义(P<0.05),ω-3组与对照组患者的血清白蛋白比较差异无统计学意义(P>0.05),见表1。
2.2 两组患者血清前白蛋白的变化比较
经肠内营养治疗,两组患者的前白蛋白均逐步升高,对照组从第1天的(158.1±11.3)mg/L升高到第14天的(177.9±22.8)mg/L,ω-3组从第1天的(156.5±13.5)mg/L升高到第14天的(179.0±21.9)mg/L。两组第14天与第1天比较,差异有统计学意义(P<0.05),ω-3组与对照组患者的血清前白蛋白含量比较差异无统计学意义(P>0.05),见表2。
2.3 两组患者IgG的变化比较
在治疗过程中,对照组IgG的含量有所下降,第7天与第1天比较差异有统计学意义(P<0.05),其余各时间点与第1天比较差异无统计学意义(P>0.05);ω-3组IgG的含量有所升高,第14天与第1天比较差异有统计学意义(P<0.05);在第7天和第14天,ω-3组与对照组IgG含量比较,差异有统计学意义(P<0.05),见表3。
2.4 两组患者IgA的变化比较
在治疗过程中,对照组IgA的含量稍有增加,第14天与第1天比较差异有统计学意义(P<0.05),其余各时间点与第1天比较差异无统计学意义(P>0.05);ω-3组IgA的含量有升高,第4天、第7天和第14天与第1天比较差异有统计学意义(P<0.05);在第4天、第7天和第14天,ω-3组与对照组IgA含量比较,差异有统计学意义(P<0.05),见表4。
2.5 两组患者IgM的变化比较
在治疗过程中,对照组IgM含量的变化差异无统计学意义(P>0.05);ω-3组IgM的含量有升高,第7天和第14天与第1天比较差异有统计学意义(P<0.05);在第7天和第14天,ω-3组与对照组IgM含量比较,差异有统计学意义(P<0.05),见表5。
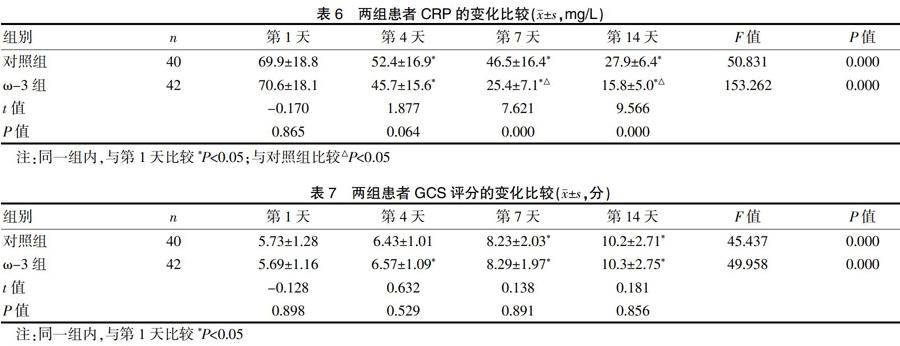
2.6 两组患者CRP的变化比较
两组患者的CRP均有下降,各时间点与第1天比较差异均有统计学意义(P<0.05);在第7天和第14天,ω-3组下降多于对照组,差异有统计学意义(P<0.05),见表6。
2.7 两组患者GCS评分的变化比较
两组患者GCS评分均有改善,对照组在第7天和第14天与第1天相比较,差异有统计学意义(P<0.05);ω-3组在第4天、第7天和第14天与第1天比较,差异有统计学意义(P<0.05);两组间比较差异无统计学意义(P>0.05)。见表7。
2.8 两组患者肺部感染的发生率
对照组发生肺部感染19例,发生率47.5%;ω-3组发生肺部感染11例,发生率26.2%,组间比较差异有统计学意义(χ2=4.010,P<0.05)。
3 讨论
颅脑损伤(TBI)是一种常见的神经外科疾病,是全球人群致死和致残的主要原因,并且颅脑外伤术后患者预后相对较差[9]。重型颅脑损伤术后患者常存在意识障碍,无法自主进食,导致营养不良和免疫功能下降[10],而患者的营养状况与感染的发生密切相关,重型颅脑损伤术后患者的营养不良、低蛋白血症是导致机体免疫功能低下、易感性增强的重要因素[11]。因此如何有效改善患者营养状态,控制低蛋白血症,维持正常的免疫功能,减少伤后感染率的发生是目前治疗重度颅脑损伤重点。既往营养支持主要通过提供充足的能量和氮源,适应机体代谢需要,维持正常蛋白代谢,以达到促进患者康复的目的[12]。由于危重患者多存在顽固的高分解代谢,严重的酸碱失衡和水电解质紊乱,对营养底物的利用和耐受程度降低,使传统营养支持对重症患者疗效不甚理想,最终造成机体营养不良和免疫力低下[13]。近年随着临床营养学的发展和对机体代谢规律的深入研究,提出了免疫营养(immunonutrition)这一概念[14]。其根据脏器组织不同的代谢特征进行代谢调理,并强调特殊营养素的营养效应,认为可通过提供一些特殊营养素,利用其药理作用达到调节机体代谢和提高免疫功能的目的[15]。将特殊营养素添加到肠内营养中的制剂称之为免疫增强型肠内营养制剂(immuneenhancing diets,IEDs),其实质就是通过调节机体免疫系统,既防止免疫功能低下,又防止出现过度的炎性反应,即维持机体免疫稳态[16]。从而进一步改善蛋白代谢,维护肠黏膜屏障,以达到免疫营养的目的[17]。目前,免疫营养制剂研究的热门是ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3PUFAs)。多不饱和脂肪酸包括ω-3PUFAs、ω-6PUFAs和亚油酸,是前列腺素、前列腺环素、血栓素和白三烯等花生四烯酸代谢产物的前体。ω-3PUFAs在深海鱼油中含量丰富,代谢产物主要是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等[18];ω-6PUFAs主要来自大豆、菜籽等植物油,主要为亚油酸,均是细胞膜磷脂的主要成分;作为花生四烯酸代谢产物的前体,实验证明ω-6PUFAs和亚油酸能促进促炎性反应因子如IL-1、TNF-α和IL-6的释放,而ω-3PUFAs正好相反,可抑制亚油酸转变成花生四烯酸,并且ω-3PUFAs可取代细胞膜磷脂中的ω-6PUFAs,减少前列腺素、白三烯的形成,从而降低促炎因子的产生,降低超敏反应,增强机体免疫能力,减少内毒素移位等,因此ω-3是免疫营养剂中的关键成分[19]。
在肿瘤患者围手术期或术后给予ω-3PUFAs强化饮食,可降低IL-1和IL-6的可溶性受体,增加IL-2可溶性受体,延迟超敏反应,降低感染率的发生[20]。对严重腹部损伤的患者给予含有Gln、Arg和ω-3PUFA的免疫营养液,对照组给予常规营养液,发现使用免疫营养液组的患者败血症的发生率明显降低,同时也减少了住院费用[21]。研究含Arg、鱼油和核苷酸的营养剂对严重创伤患者的SIRS和MOF的影响,结果实验组SIRS时间缩短和MOF的发生率显著降低,脓毒血症的发生率也明显降低[22]。2016年ASPEN重症患者营养支持治疗指南认为含免疫调节成分配方可以在创伤性脑损伤患者中使用[23]。
血浆蛋白水平是反映机体蛋白质营养状况的重要指标,不仅可提供客观的营养评价结果,而且不易受主观因素影响[24]。常用的指标包括血清白蛋白(albumin,Alb)和前白蛋白(prealbumin,PA),并且PA虽由肝细胞合成,但体积较小、半衰期较短,其浓度的变化能够早期而敏感地反映肝脏蛋白质合成功能,故已作为检测营养治疗效果的指标而得到广泛使用。本研究发现,给予肠内营养支持后,两组患者的白蛋白和前白蛋白均有升高,第14天与第1天比较有明显升高,但两组间比较差异无统计学意义。故免疫肠内营养制剂与常规肠内营养制剂一样能满足重型颅脑损伤患者的营养要求。但早期腸内营养液存在一些并发症,如呕吐、胃潴留、腹泻等,需注意预防和及时处理。
IgG、IgA、IgM是体液免疫的常用指标,在治疗过程中,对照组IgG、IgA、IgM含量的变化均不明显,ω-3组IgG、IgA、IgM的含量均有升高,与对照组比较,ω-3组在第7天和第14天IgG、IgA、IgM的含量有明显升高。这说明ω-3PUFAs能够提高免疫球蛋白水平。
CRP是炎症标志物,以糖蛋白的形式存在于血液中,在健康人群血液中水平极低,当机体处于感染、创伤等应激状态时,CRP显著升高,且升高程度与损伤程度呈正比,可以用来评估感染的危重程度及预后[25]。研究证实细菌可经过组织学正常的肠道易位,细菌及其毒素易位肠外器官可造成毒性递质或细胞因子释放。在治疗过程中,两组患者的CRP均有明显下降,并且ω-3组下降明显多于对照组,说明ω-3PUFAs能够减少炎症反应。同时研究结果也显示,尽管两组患者的GCS评分无明显差异,但ω-3组肺部感染的发生率明显低于对照组。
综上所述,重型颅脑损伤患者术后由于早期代谢明显升高、热量消耗增加,机体呈负氮平衡,免疫功能低下,易导致感染等并发症的发生。给予重型颅脑损伤患者ω-3PUFAs能够满足营养需求,保持代谢平衡,纠正免疫异常,减少感染的发生率。
[参考文献]
[1] Singh AK,Jena RK,Pal R,et al. Morbidity audit of 704 traumatic brain injury cases in a dedicated South Indian Trauma Center[J]. Asian J Neurosurg,2018,13(3):714-720.
[2] 中华医学会神经外科分会. 中国神经外科重症患者消化与营养管理专家共识(2016)[J].中华医学杂志,2016, 96(21):1643-1647.
[3] Peker KD,Ozkanli SS,Akyuz C,et al. Preoperative immunonutrition regulates tumor infiltrative lymphocytes and increases tumor angiogenesis in gastric cancer patients[J]. Arch Med Sci,2017,13(6):1365-1372.
[4] 吴孟超. 外科学[M]. 北京:人民卫生出版社,2013:196-197.
[5] Chapple LA,Chapman M,Shalit N,et al. Barriers to nutrition intervention for patients with a traumatic brain injury:Views and attitudes of medical and nursing practitioners in the acute care setting[J]. JPEN J Parenter Enteral Nutr,2018,42(2):318-326.
[6] Duraski SA,Lovell L,Roth EJ. Nutritional intake,body mass index,and activity in postacute traumatic brain injury:A preliminary study[J]. Rehabil Nurs,2014,39(3):140-146.
[7] Palm NM,McKinzie B,Ferguson PL,et al. Pharmacologic stress gastropathy prophylaxis may not be necessary in at-risk surgical trauma ICU patients tolerating enteral nutrition[J]. J Intensive Care Med,2018,33(7):424-429.
[8] Justo Meirelles CM,de Aguilar-Nascimento JE. Enteral or parenteral nutrition in traumatic brain injury:A prospec-tive randomisedtrial[J]. Nutr Hosp,2011,26(5):1120-1124.
[9] 高亮. 顱脑创伤和脑科危重症治疗学[M]. 上海:上海科学技术出版社,2012:1.
[10] Mazaherpur S,Khatony A,Abdi A,et al. The effect of continuous enteral nutrition on nutrition indices,compared to the intermittent and combination enteral nutrition in traumatic brain injury patients[J]. J Clin Diagn Res,2016,10(10):JC01-JC05.
[11] Colleen N,Bodnar,Josh M,et al. Depression following a traumatic brain injury:Uncovering cytokine dysregulation as a pathogenic mechanism[J]. Neural Regen Res,2018, 13(10):1693-1704.
[12] Araki T,Yokota H,Morita A. Pediatric traumatic brain injury:Characteristic features,diagnosis,and management[J].Neurol Med Chir (Tokyo),2017,57(2):82-93.
[13] Diaz-Arrastia R,Kochanek PM,Bergold P,et al. Pharmacotherapy of traumatic brain injury:State of the science and the road forward:Report of the Department of Defense Neurotrauma Pharmacology Workgroup[J]. J Neurotrauma,2014,31(2):135-158.
[14] Lucas W,Thornblade,Thomas K,Varghese,et al. Preoperative immunonutrition and elective colorectal resection outcomes[J]. Dis Colon Rectum,2017,60(1):68-75.
[15] Xu J,Sun X,Xin Q,et al. Effect of immunonutrition on colorectal cancer patients undergoing surgery:A meta-analysis[J]. Int J Colorectal Dis,2018,33(3):273-283.
[16] Bharadwaj S,Trivax B,Tandon P,et al. Should perioperative immunonutrition for elective surgery be the current standard of care?[J]. Gastroenterol Rep (Oxf),2016,4(2):87-95.
[17] Klek S,Szybinski P,Szczepanek K. Perioperative immunonutrition in surgical cancer patients:A summary of a decade of research[J]. World J Surg,2014,38(4):803-812.
[18] McCowen KC,Bistrian BR. Immunonutrition:Problematic or problem solving?[J]. Am J Clin Nutr,2003,77(4):764-770.
[19] Alexander JW,Supp DM. Role of arginine and omega-3 fatty acids in wound healing and infection[J]. Adv Wound Care,2014,3(11):682-690.
[20] Song GM,Liu XL,Bian W,et al. Systematic review with network meta-analysis:Comparative efficacy of different enteral immunonutrition formulas in patients underwent gastrectomy[J]. Oncotarget,2017,8(14):23376-23388.
[21] Kudsk KA,Minard G,Croce MA,et al. A randomized trial of isonitrogenous enteral diets after severe trauma. An immune-enhancing diet reduces septic complications[J]. Ann Surg,1996,224(4):531-543.
[22] Binkowska AM,Michalak G,Sotwiński R. Current views on the mechanisms of immune responses to trauma and infection[J]. Cent Eur J Immunol,2015,40(2):206-216.
[23] McClave SA,Taylor BE,Martindale RG,et al.Guidelines for the provision and assessment of nutrition support therapy in the adult critically Ⅲ patient:Society of critical care medicine(SCCM)and American Society for parenteral and enteral nutrition(ASPEN)[J]. J Parenter Enteral Nutr, 2016,40(2):159-211.
[24] Xu J,Sun X,Xin Q,et al. Effect of immunonutrition on colorectal cancer patients undergoing surgery:A meta-analysis[J]. Int J Colorectal Dis,2018,33(3):273-283.
[25] Dietrich WD,Bramlett HM. Therapeutic hypothermia and targeted temperature management for traumatic brain injury:Experimental and clinical experience[J]. Brain Circ,2017,3(4):186-198.
(收稿日期:2019-01-10)
