改良硼替佐米联合地塞米松治疗初发多发性骨髓瘤的疗效及安全性
2019-11-19翁翔陈丽章敬成胡慧仙朱逸霞
翁翔 陈丽 章敬成 胡慧仙 朱逸霞
[摘要] 目的 探討改良硼替佐米联合地塞米松(BD)治疗初发多发性骨髓瘤(MM)的临床疗效及安全性。 方法 选取2013年6月~2015年6月在我院血液科接受诊治的40例初发MM患者为研究对象,按照治疗方案分为两组,改良BD方案治疗组17例,VAD(长春瑞滨+吡柔比星+地塞米松)方案治疗组23例。疗效判定采用欧洲骨髓移植协作组(EBMT)制定的统一标准评价,并按照美国国立癌症研究所不良事件通用命名标准(NCICTCAE)观察毒副作用。比较两组患者化疗后临床疗效,观察两组患者化疗前后血红蛋白、M蛋白、β-2微球蛋白、血清肌酐的水平变化并比较两组患者化疗毒副反应情况。 结果 改良BD组总有效率为88.24%,VAD组总有效率为52.18%,两组比较差异有统计学意义(P<0.05)。化疗后,两组患者M蛋白、β-2微球蛋白、血清肌酐水平均低于化疗前(P<0.05),且与VAD组相比,改良BD组患者化疗后M蛋白、β-2微球蛋白、血清肌酐水平显著降低,差异有统计学意义(P<0.05)。改良BD组出现的毒副作用轻微,均为≤2级毒副作用,经积极症状治疗后均可缓解,未发生严重的不良事件。改良BD组中白细胞下降、血小板降低发生率低于VAD组,差异具有统计学意义(P<0.05)。改良BD组在消化道副作用、乏力、感染、周围神经毒性、心脏毒性等方面发生率均低于VAD组,但差异无统计学意义(P>0.05)。 结论 改良硼替佐米联合地塞米松方案治疗初发多发性骨髓瘤疗效与标准剂量硼替佐米联合地塞米松方案疗效相似,优于传统VAD化疗方案,并且毒副作用轻微,患者耐受性好,值得临床推广应用。
[关键词] 初发;多发性骨髓瘤;硼替佐米;地塞米松
[中图分类号] R733.3 [文献标识码] A [文章编号] 1673-9701(2019)25-0008-06
Efficacy and safety of modified bortezomib combined with dexamethasone in the treatment of primary multiple myeloma
WENG Xiang1 CHEN Li1 ZHANG Jingcheng1 HU Huixian1 ZHU Yixia2
1.Department of Hematology, Jinhua Central Hospital in Zhejiang Province, Jinhua 321000, China; 2.Jinhua Second Hospital in Zhejiang Province, Jinhua 321000, China
[Abstract] Objective To explore the efficacy and safety of modified bortezomib combined with dexamethasone(BD) in the treatment of newly diagnosed multiple myeloma(MM). Methods A total of 40 newly diagnosed MM patients treated in Hematology Department of our hospital from June 2013 to June 2015 were selected as the subjects of study. According to the treatment method, they were divided into modified BD group (17 cases) and VAD (Vinorelbine+pirarubicin+dexamethasone) group (23 cases). Efficacy was assessed using a standardized standard developed by the European Society for Bone Marrow Transplantation(EBMT) and the side effects were observed according to the National Cancer Institute Common Criteria for Adverse Events (NCICTCAE). The clinical efficacy of the two groups were compared after chemotherapy, the changes of hemoglobin, M protein, β-2 microglobulin and serum creatinine levels were observed before and after chemotherapy, and the toxicity and side effects of chemotherapy were compared between two groups. Results The total effective rate was 88.24% in the modified BD, and 52.18% in the VAD group, the difference was statistically significant(P<0.05). After chemotherapy, the levels of M protein, β-2 microglobulin and serum creatinine in the two groups were lower than those before chemotherapy (P<0.05). Compared with the VAD group, the M protein, β-2 microglobulin and serum creatinine levels in the modified BD group were significantly lower after chemotherapy(P<0.05). The BD group showed mild toxic side effects, all of which were ≤grade 2, which were all relieved after treatment, and no serious adverse events occurred. The incidence of leukopenia and thrombocytopenia in the modified BD group was lower than that in the VAD group, and the difference was statistically significant(P<0.05). The incidence of digestive tract side effects, fatigue, infection, peripheral neurotoxicity and cardiotoxicity in the modified BD group was lower than that in the VAD group, but the difference was not statistically significant(P>0.05). Conclusion The efficacy of modified bortezomib combined with dexamethasone in the treatment of primary multiple myeloma is similar to that of standard dose of bortezomib combined with dexamethasone, and superior to traditional VAD chemotherapy, with mild side effects and good tolerance, thus is worthy of promotion.
[Key words] Primary; Multiple myeloma; Bortezomib; Dexamethasone
多发性骨髓瘤(multiple myeloma,MM)是浆细胞恶性克隆增殖性疾病,多发生于中老年人,根据流行病学数据显示其发病率约占血液系统肿瘤的15%[1]。其主要特征是骨髓中单克隆性浆细胞异常增生,分泌单克隆免疫球蛋白(M蛋白)或其片段,并导致相关器官或组织损伤,常见临床表现包括血钙增高、肾功能损害、贫血、骨质病变、免疫力低下导致的反复感染及高黏滞血症等靶器官损伤[2]。
多发性骨髓瘤的发病机制极其复杂[3],迄今为止仍被认为是一种不可治愈的疾病。目前化疗仍然是多发性骨髓瘤的主要治疗手段,常见的化疗方案有:VAD(长春新碱+吡柔比星+地塞米松)、M2(卡莫司汀+环磷酰胺+美法仑+泼尼松+长春新碱)、MP(马法兰+泼尼松)等,但是其缓解率低,疗效欠佳[4-7]。近年来,靶向治疗已成为肿瘤领域的一个研究热点。硼替佐米(Bortezomib),商品名“万珂”,是一种26S蛋白酶体抑制剂,为人工合成的丙氨酸基硼酸衍生物,最初被称为“蛋白酶体抑制剂”,它作为世界上首个以蛋白质酶体作为治疗目标的癌症药物,其可以通过多种不同机制发挥强大的抗骨髓瘤作用。2003年5月,硼替佐米被美国食品药品监督管理局(FDA)批准用于复发、难治性MM的治疗,并取得了满意的疗效[8]。2007年美国国家综合癌症网(NCCN)诊治指南已将硼替佐米推荐为MM患者的一线用药。国外多个硼替佐米治疗多发性骨髓瘤的临床研究结果显示其疗效显著,并且发现其与地塞米松联合应用可增加总有效率[9]。不仅如此,最近国外研究发现硼替佐米不仅对复发/难治多发性骨髓瘤有效,而且对于初发MM患者也有着良好的疗效[10-11]。
目前临床多采用硼替佐米联合化疗方案对MM患者进行治疗[12]。但是目前标准剂量(1.3 mg/m2)硼替佐米的毒副作用,尤其是周围神经毒性,影响了患者的生活质量,并且该药费用昂貴,很多患者难以接受。本文选取2013年6月~2015年6月在我院血液科诊断为初发的40例多发性骨髓瘤患者进行研究,比较改良BD(硼替佐米+地塞米松)方案与采用传统VAD方案化疗治疗初发MM患者的疗效及相关毒副作用,以期为今后治疗多发性骨髓瘤提供一定的临床经验,现报道如下。
1 资料与方法
1.1 一般资料
选取2013年6月~2015年6月在我院血液科接受诊治的40例MM患者为研究对象,其中男27例,女13例;所有患者均符合多发性骨髓瘤的诊断标准[13],分期参照Durie-Salmon(DS)分期和国际分期系统(ISS)[14];按照治疗方案分为两组,改良BD组17例,其中男11例,女6例;平均年龄(48.12±8.43)岁;IgG 9例,IgA 5例,IgD 1例,轻链型2例;传统VAD组23例,其中男16例,女7例;平均年龄(49.57±7.98)岁;IgG 14例,IgA 6例,IgD 1例,轻链型2例。两组患者性别、年龄、分型等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
改良BD组方案:硼替佐米1.0 mg/m2于第1、4、8、11天在3~5 s内快速静脉推注给药,地塞米松20~40 mg/d于第1、2、4、5、8、9、11、12天加入生理盐水250 mL内静脉滴注,21 d为1个疗程。
VAD组方案:长春瑞滨40 mg/d,吡柔比星10~20 mg/d,地塞米松20~40 mg/d,第1~4天静脉滴注,28 d为1个疗程。两组患者治疗期间均予以抑酸、护肝、护胃、预防骨质疏松、止吐、碱化尿液、预防高尿酸血症、纠正电解质紊乱等支持治疗,继发感染者用经验性抗生素抗感染,红细胞或血小板降低明显者,予以积极输血,将血象控制在安全范围内。治疗过程中密切监测毒副作用的发生,若患者无法耐受则及时暂停治疗,症状缓解后再继续治疗。所有患者均接受至少2个疗程治疗。
1.3 观察指标
疗效评定主要采用EBMT(European group for blood and marrow transplantation,EBMT)标准[14],分为完全缓解(CR)、部分缓解(PR)、微小缓解(MR)、没有变化(NC)、疾病进展(PD)。总有效率(ORR)=CR+PR+MR。
化疗前后进行血常规、超敏CRP、生化、肝功能、免疫固定电泳、β-2微球蛋白、骨髓穿刺涂片等检查。观察两组患者化疗前后血红蛋白、M蛋白、β-2微球蛋白、血清肌酐的水平变化。
依照NCI-CTCAEv3.0(National cancer institute common terminology criteria for adverse events,version3.0)[15]观察评价相关的毒副作用。
1.4 统计学方法
采用SPSS17.0统计软件进行统计学分析,计量资料以均数±标准差(x±s)表示,采用t检验进行组间比较;计数资料用率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗情况
17例患者接受了中位3.5(2~5)个疗程的改良BD方案的治疗,其中2例完成2个疗程,6例完成3个疗程,7例完成4个疗程,2例完成5个疗程;23例患者接受了中位4(2~7)个疗程的VAD方案的治疗,其中3例完成2个疗程,6例完成3个疗程,5例完成4个疗程,4例完成5个疗程,4例完成6个疗程,1例完成7个疗程。
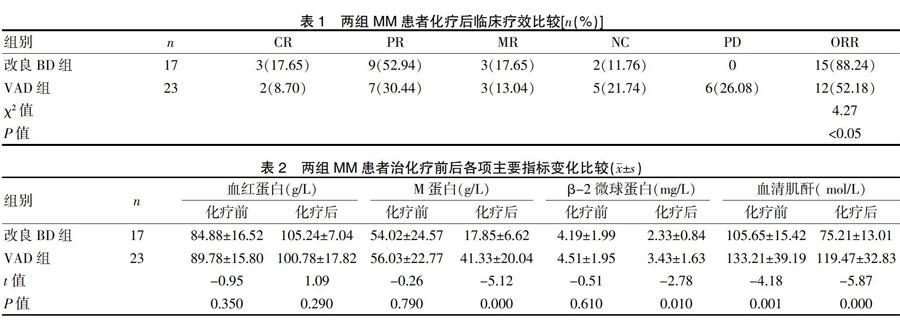
2.2 两组MM患者化疗后临床疗效比较
改良BD组17例患者中14例病情得到不同程度的缓解,其中3例(17.65%)达到CR,PR 9例(52.94%),MR 3例(17.65%),NC 2例(11.76%),PD 0例,总有效率为88.24%。VAD组23例患者中12例患者病情得到不同程度的缓解,其中2例(8.7%)达到CR,PR 7例(30.44%),MR 3例(13.04%),NC 5例(21.74%),PD 6例(26.08%),总有效率为52.18%。改良BD组总有效率明显高于VAD组,差异有统计学意义(P<0.05),见表1。
2.3 两组MM患者化疗前后各项主要指标变化比较
化疗前,两组患者血红蛋白、M蛋白、β-2微球蛋白水平比较,差异无统计学意义(P>0.05)。化疗后,两组患者血红蛋白水平明显高于化疗前,但是两组血红蛋白水平比较,差异无统计学意义(P>0.05);化疗后,两组患者M蛋白、β-2微球蛋白、血清肌酐水平均低于化疗前(P<0.05),且与VAD组相比,改良BD组患者化疗后M蛋白、β-2微球蛋白、血清肌酐水平显著降低,差异有统计学意义(P<0.05)。见表2。
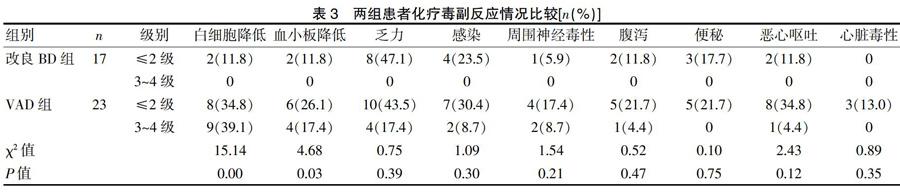
2.4 两组患者化疗毒副反应情况比较
根据NCI-CTCAE标准,表3为改良BD组和VAD组相关毒副作用发生情况。改良BD组最常见的毒副作用为乏力(47.1%)、感染(23.5%)、便秘(17.7%)、白细胞降低(11.8%)、血小板降低(11.8%)、恶心呕吐(11.8%)、腹泻(11.8%)、周围神经毒性(5.9%),以上毒副作用均≤2级。乏力患者8例,治疗结束约7 d后乏力症状消失。感染患者4例,其中上呼吸道感染2例,肺部感染2例,予以积极抗生素抗感染及对症支持治疗后好转。便秘患者3例,予以改善饮食、莫沙必利促进胃肠动力、乳果糖及开塞露通便治疗后便秘好转。白细胞降低患者2例,程度较轻,无患者出现粒细胞缺乏,未予特殊处理;2例血小板减少,程度轻微,不需要输注单采血小板,白细胞和血小板计数下降到谷值后可自动恢复,到下次化疗前均能回到基线水平,所有患者均未出现严重的出血不良事件。恶心呕吐患者2例,治疗结束后好转,未予特殊处理。腹泻患者2例,为水样便,予黄连素、易蒙停(盐酸洛哌丁胺)止泻后腹泻缓解。周围神经病变患者1例,主要表现为肢体麻木和不适,上肢较下肢明显,予以弥可保及改善循环等对症支持治疗,疗程结束后症状消失。
传统VAD组毒副作用则明显增加,其中白细胞下降程度以3~4级毒副作用为主;23例患者中有17例(73.9%)出现白细胞下降,14例(60.9%)乏力,10例(43.5%)血小板下降,9例(39.1%)恶心呕吐,9例(39.1%)感染,6例(26.1%)腹泻,6例(26.1%)周围神经病变,5例(21.7%)便秘,3例(13.0%)出现心脏毒性。
改良BD组患者白细胞下降、血小板降低发生率低于VAD组,差异具有统计学意义(P<0.05)。改良BD其他消化道副作用、乏力、感染、周围神经毒性、心脏毒性等毒副作用均低于VAD组,但差异无统计学意义(P>0.05)。见表3。
3 讨论
多发性骨髓瘤(MM)属于浆细胞来源的恶性血液系统肿瘤,约占血液系统恶性肿瘤的15%,以骨髓中克隆性浆细胞不断恶性增殖为特征,主要临床表现为高钙血症、肾功能损害、贫血、骨质破坏、高黏滞血症以及由于免疫力低下造成的反复感染等。常见的化疗方案如VAD(长春新碱+吡柔比星+地塞米松)、M2(卡莫司汀+环磷酰胺+美法仑+泼尼松+长春新碱)、MP(马法兰+泼尼松)等緩解率低下,疗效欠佳,至今仍然是难以治愈的恶性血液病[16]。近年来,蛋白酶体抑制剂硼替佐米等治疗新药物的出现,使得MM患者的生存期得到了显著改善[17]。
硼替佐米(Bortezomib),商品名万珂(Velcade),属于可逆性蛋白酶体抑制剂,为丙氨酸基硼酸衍生物。它作为世界上首个以蛋白质酶作为治疗目标的癌症药物,可以通过多种不同机制发挥抗骨髓瘤作用。首先,硼替佐米通过抑制核因子κB的活性,使白介素-6(IL-6)、肿瘤坏死因子α、胰岛素样生长因子-I等表达下降,引起多发性骨髓瘤细胞凋亡[18];同时,IL-6的下降,使对地塞米松耐药的骨髓瘤细胞凋亡,逆转骨髓瘤细胞对激素的耐药[19]。其次,硼替佐米能上调NOXA(促凋亡蛋白),使NOXA与抗凋亡蛋白Bcl-2互相作用,从而引起骨髓瘤细胞凋亡[20]。此外,硼替佐米能抑制多发性骨髓瘤患者骨髓内皮细胞生长及新生血管形成,促进其凋亡[21]。最后,硼替佐米能在转录水平上通过半胱天冬酶-8依赖性Sp1的蛋白质下调组蛋白去乙酰化酶基因家族Ⅰ的表达,并诱导组蛋白高度乙酰化,从而诱导骨髓瘤细胞凋亡等[22]。通过以上各种机制,共同达到抗骨髓瘤作用。
国外研究发现,硼替佐米和地塞米松二者对于多发性骨髓瘤细胞的疗效是互相叠加的[23-24],而且发现硼替佐米可以克服多发性骨髓瘤细胞对地塞米松等药物的耐药性[25-26]。目前标准治疗剂量(1.3 mg/m2)对于患者来说花费巨大,按标准剂量计算往往有1/3剂量药物剩余,很多患者难以接受。国内外已有多个临床试验报道了低剂量硼替佐米(1.0 mg/m2)联合地塞米松方案治疗复发/难治MM,并且取得了良好疗效。CREST试验[27]首先对1.0 mg/m2和1.3 mg/m2两种剂量的硼替佐米联合地塞米松方案治疗复发/难治MM进行了研究,53例复发/难治性MM患者被随机分配到硼替佐米两个剂量组:1.0 mg/m2与1.3 mg/m2,结果显示单药硼替佐米治疗的总有效率分别为33%和50%,联合地塞米松后总有效率分别为44%和62%,而硼替佐米1.0 mg/m2组患者的毒副作用较1.3 mg/m2剂量组相对较少,说明地塞米松和硼替佐米两者治疗MM的疗效是叠加的同时,也提示了低剂量硼替佐米治疗多发性骨髓瘤时仍然有效,并且相关毒副作用明显降低。国内鲍立等[28]也开展了类似的研究,分别采用两种剂量硼替佐米(1.3 mg/m2和1.0 mg/m2)联合地塞米松治疗复发/难治MM患者,结果显示其总有效率分别为61.5%和70.0%,缓解率分别为38.5%和20%,经统计学分析,两者疗效和毒副作用差异无统计学意义(P>0.05),提示低剂量硼替佐米联合地塞米松方案与标准剂量硼替佐米联合地塞米松方案有相似的疗效,并且毒副作用明显减少。另外中国一个多中心的临床协作组以168例MM患者作为研究对象,主要分为1.3 mg/m2和0.7~1.0 mg/m2两大组,结果显示硼替佐米联合地塞米松对于MM患者的疾病缓解有效,且低剂量硼替佐米可以在保持疗效的同时降低周围神经病变的发生率[29]。然而,目前对于低剂量硼替佐米联合地塞米松方案治疗初发MM的临床研究较少,相关的临床病例报道也较少。
为了探讨低剂量硼替佐米联合地塞米松治疗初发MM的临床疗效及安全性,本研究回顾性分析了我科40例初发MM患者的临床资料,其中17例采用1.0 mg/m2的硼替佐米联合地塞米松方案治疗,其有效率为88.24%,与国内苏基滢等[30]报道结果相似,高于传统VAD组的有效率(52.18%),并且与文献报道[31-32]按照标准剂量硼替佐米(1.3 mg/m2)方案治疗初发MM的有效率相近,但费用上却节约了近50%。改良BD组患者各项主要监测指标较VAD组改善更加显著,其中M蛋白、β-2微球蛋白、血清肌酐值改变差异具有统计学意义(P<0.05),改良BD组中有5例肾功能不全患者,在使用硼替佐米治疗后,所有患者的肾功能没有进一步恶化,反而均有不同程度的改善,這可能和硼替佐米主要通过细胞色素P450酶氧化代谢失活,药物在尿液中无活性有关,因此对于合并肾功能损害的患者,硼替佐米的应用是安全可靠的。与VAD血液学毒性(白细胞低下和血小板减少)、感染、心脏毒性等毒副作用相比,改良BD组的毒性温和并且可控制,更易让患者接受。本研究中改良BD组尚未出现过严重毒副作用,轻度毒副作用主要表现为乏力、消化系统副作用、血小板减少、白细胞降低,均为轻度。血小板减少多发生于化疗第10~12天,多数患者最低血小板计数在(60~80)×109/L,无需输注单采血小板并且多在停药后1周内恢复正常。改良BD组中未观察到心脏毒性,这为有严重心脏疾病患者的治疗提供了优良选择。值得一提的是,本组研究中未出现带状疱疹病例,并且只有1例患者出现周围神经毒性,且程度仅为2级,表现为四肢麻木不适感,上肢较下肢明显,无活动障碍,对机体影响不大,予以弥可保营养神经及改善循环等对症治疗,疗程结束后症状逐渐缓解。因此,与标准剂量硼替佐米联合地塞米松方案相比,改良硼替佐米联合地塞米松方案不仅不影响总体疗效,还可以使MM患者的周围神经病变、带状疱疹、血细胞下降、乏力及腹胀等毒副作用发生率降低且患者更容易耐受,这为患者有机会进一步进行造血干细胞移植、延长生存期提供了策略和手段。
综上所述,改良硼替佐米(1.0 mg/m2)联合地塞米松治疗初发MM与标准剂量(1.3 mg/m2)联合地塞米松有相似的疗效,高于传统VAD方案化疗的有效率,并且化疗相关的血液学毒性、消化道毒副作用、周围神经毒性等毒副作用小,患者耐受性好,是一种安全、经济、有效的治疗手段。但需要注意的是,本研究总体病例数有限,有可能是样本容量大小或者分布不当造成的统计偏差,因此上述结论需要扩大研究病例数进一步证实确认。另外,17例采用改良BD方案治疗的患者中只有3例达到CR,可能与患者的总体用药剂量偏低有关。患者在改良BD方案治疗初发MM患者取得良好疗效后,若能采取进一步的治疗措施,如造血干细胞移植等,患者的疗效或许会更佳;否则使用该剂量治疗初发MM患者,对疗效维持的长久性尚需进一步随访与观察。
[参考文献]
[1] Kumar SK. Management of multiple myeloma[J]. J Natl Compr Canc Netw,2018,16(5S):624-627.
[2] Rossi M,Di Martino MT,Morelli E,et al. Molecular targets for the treatment for the treatment of multiple myeloma[J]. Curr Cancer Drug Targets,2012,12(7):757-767.
[3] Bommert K,Bargou RC,Stuhmer T. Signalling and survival pathways in multiple myeloma[J]. Eur J Cancer,2006, 42(11):1574-1580.
[4] Kyle RA,Rajkumar SV. Multiple myeloma[J]. Blood,2008, 111(6):2962-2972.
[5] Segeren CM,Sonneveld P,van der Holt B,et al. Vincristine,doxorubicin and dexamethasone(VAD)administered as rapid intravenous infusion for first-line treatment in untreated multiple myeloma[J]. Br J Haematol,1999,105(1):127-130.
[6] Myeloma Trialists' Collaborative Group. Combination chemotherapy versus melphalan plus prednisone as treatment for multiple myeloma:An overview of 6 633 patients from 27 randomized trials[J]. J Clin Oncol,1998,16(12):3832-3842.
[7] Harousseau JL,Attal M,Avet-Loiseau H,et al. Bortezomib plus dexamethasone is superior to vincristine plus doxorubicin plus dexamethasone as induction treatment prior to autologous stem-cell transplantation in newly diagnosed multiple myeloma; results of the IFM 2005-01 phase Ⅲ trail[J]. J Clin Oncol,2010,28(30):4621-4629.
[8] Bross PF,Kane R,Farrell AT,et al. Appromal summary for bortezomib for injection on the treatment of multiple myeloma[J]. Clin Cancer Res,2004,10(12):3954-3964.
[9] Kyle RA,Rajkumar SV. Treatment of multiple myeloma:A comprehensive review[J]. Clin Lymphoma Myeloma,2009, 9(4):278-288.
[10] Jagannath S,Durie BG,Wolf J,et al. Bortezomib therapy alone and in combination with dexamethasone for previously untreated symptomatic multiple myeloma[J]. Br J Haematol,2005,129(6):776-783.
[11] Oakervee HE,Popat R,Currv N,et al. PAD combination therapy(PS-341/bortezomib,doxorubicin and dexamethasone)for previously untreated patients with multiple myeloma[J]. Br J Haematol,2005,129(6):755-762.
[12] Gabizon AA,Patil Y,La Beck NM. New insights and evolving role of pegylated liposomal doxorubicin in cancer therapy[J]. Drug Resist Updat,2016,29:90-106.
[13] 張之南,沈悌.血液病诊断及疗效标准(第3版)[M]. 北京:科学出版社,2007:232-235.
[14] Greipp PR,San Miguel J,Durie BG,et al. International staging system for multiple myeloma[J]. J Clin Oncol,2005,23(15):3412-3420.
[15] Trotti A,Bentzen SM. The need for adverse effects reporting standards in oncology clinical trials[J]. J Clin Oncol,2004,22(1):19-22.
[16] King AJ,Gooding S,Ramasamy K. Managing multiple myeloma in the over 70s:A review[J]. Maturitas,2015,80(2):148-154.
[17] Hashimoto S,Kuroha T,Yano T,et al. Thalidomide to bortezomib and dexamethasone for refractory multiple myeloma[J]. Inter Med,2016,55(20):3025-3028.
[18] Adams J. The proteasome:A suitable antineoplastic target[J].Nat Rev Cancer,2004,4(5):349-360.
[19] Chauhan D,Anderson KC. Mechanisms of cell death and survival in multiple myeloma(MM):Therapeutic implications[J]. Apoptosis,2003,8(4):337-343.
[20] Qin JZ,Ziffra J,Stennett L,et al. Proteasome inhibitors trigger NOXA-mediated apoptosis in melanoma and myeloma cells[J]. Cancer Res,2005,65(14):6282-6293.
[21] Roccaro AM,Hideshima T,Raje N,et al. Bortezomib mediates antiangiogenesis in multiple myeloma via direct and indirect effects on endothelial cells[J]. Camcer Res,2006,66(1):184-191.
[22] Kikuchi J,Wada T,Shimizu R,et al. Histone deacetylases are critical targets of bortezomib-induced cytotoxicity in multiple myeloma[J]. Blood,2010,116(3):406-417.
[23] Kropff MH,Bisping G,Wenning D,et al. Bortezomib in combination with dexamethasone for relapsed multiple myeloma[J]. Leukemia Research,2005,29(5):587-590.
[24] Harousseau JL,Attal M,Leleu X,et al. Bortezomib plus dexamethasone as induction treatment prior to autologous stem cell transplantation in patients with newly diagnosed multiple myeloma:Results of an IFM phase Ⅱ study[J]. Haematologica,2006,91(11):1498-1505.
[25] Bensinger WI,Jagannath S,Vescio R,et al. Phase 2 study of two sequential three-drug containing bortezomib,cyctlophosphamide and dexamethasone,followed by bortezomib,thalidomide and dexamethasone as frontline therapy for multiple myeloma[J]. Br J Haematol,2010, 148(4):562-568.
[26] Hideshima T,Richardson P,Chauhan D,et al. The proteasome inhibitor PS-341 inhibits growth,induces apoptosis,and overcomes drug resistance in human multiple myeloma cells[J]. Cancer Res, 2001,61(7):3071-3076.
[27] Jaqannath S,Barloqie B,Berenson J,et al. A phase 2 study of two doses of bortezomib in relapsed or refractory myeloma[J]. Br J Haematol,2004,127(2):165-172.
[28] 鮑立,卢锡京,张晓晖,等.不同剂量硼替佐米联合地塞米松治疗难治复发多发性骨髓瘤[J]. 中华医学杂志,2008,88(26):1829-1831.
[29] Yuan ZG,Jin J,Huang XJ,et al. Different dose combinations of bortezomib and dexamethasone in the treatment of relapsed or refractory myeloma:An open-label,observational,multi-center study in China[J]. Chin Med J,2011,124(19):2969-2974.
[30] 苏基滢,周立宇,徐黎,等.偏小剂量的硼替佐米联合地塞米松治疗初发多发性骨髓瘤疗效观察[J]. 癌症进展,2012,10(1):80-83.
[31] Li J,Zhou DB,Jiao L,et al. Bortezomib and dexamethasone therapy for newly diagnosed patients with multiple myeloma complicated by renal impairment[J]. Clin Lymphoma Myeloma,2009,9(5):394-398.
[32] 李娟,曾丽金,赵莹,等.硼替佐米联合地塞米松治疗初治多发性骨髓瘤[J]. 中华血液学杂志,2009,30(8):543-547.
(收稿日期:2018-11-21)
