光谱法及分子对接技术研究黄体酮与牛血清白蛋白的结合机制
2019-11-19杨淑玲廖先萍
杨淑玲, 廖先萍, 范 星, 庹 浔
(1. 南昌大学 化学学院, 江西 南昌 330000; 2. 南昌大学 药学院, 江西 南昌 330000)
1 引 言
黄体酮(Progesterone,PROG)是由卵巢黄体分泌的一种内源性类固醇激素,对雌激素激发过的子宫内膜有显著形态学影响,可以保护女性的子宫内膜[1]。在女性怀孕期间,PROG可以降低子宫紧张度且抑制其兴奋性,使孕激素所引起的子宫内膜增殖期转为分泌期,为孕卵着床提供有利条件并维持妊娠,同时促进乳房发育,抑制排卵,支持并保障胎儿的早期生长及发育。PROG也是临床干预先兆流产的常用药物之一[2],但是大剂量黄体酮会给孕妇带来乳腺胀痛、肠道不适、偏头痛等副作用[3]。
血清白蛋白是生物体内重要的载体蛋白,能运输许多药物分子到达受体部位发挥药效,还能与内源性或外源性化合物结合起到储存的作用[4-5]。牛血清白蛋白(BSA)与人血清白蛋白(HSA)的序列十分相似, 两者之间的同源性高达76.5%,且不同氨基酸均为保守性替换[4]。BSA相较于HAS价廉易得,因此研究人员将BSA作为化学生物学中研究人类血清白蛋白性质的常用模型。利用光谱学技术特别是荧光光谱技术揭示BSA与药物小分子之间的相互作用机制的研究工作已有广泛报道[5-6]。随着大量蛋白质三维精细结构的确定以及计算机模拟技术的快速发展,分子对接技术已经成为研究蛋白质与小分子之间相互作用的有效手段[6-8]。例如,王晓霞等运用该方法探究了盐酸四环素与BSA的相互作用[9]。尽管国内外的学者对黄体酮多方面的药理作用已经有所认识,但其中大多是关于黄体酮在先兆流产及脑神经保护等临床应用方面的研究[3,10],尚未关注PROG在体内的传输机制以及与相关蛋白质的相互作用。因此,本实验拟整合光谱学和分子对接技术的优点在分子水平探究PROG与运输蛋白(BSA)之间的相互作用机制,为揭示PROG对人体健康的影响提供数据参考。
2 实 验
2.1 试剂与仪器
试剂:BSA(BIOFROXX,德国,纯度≥98%),以超纯水为溶剂配制成1×10-2mol·L-1的BSA储备液,-20 ℃冷藏备用,临用逐级稀释;PROG(上海源叶生物公司,纯度≥99%),用乙醇配制成1×10-2mol·L-1溶液,-20 ℃冷藏备用,临用稀释;Tris-HCl缓冲溶液:pH=7.4,含0.15 mol·L-1氯化钠以调节离子强度。实验所用试剂均为分析纯,实验用水为超纯水。
测试仪器:日立F-4500荧光光谱仪(带温控设备,石英比色皿);METTLER TOLEDO pH计;布鲁克TERSON-27红外光谱仪(带ATR附件)。
2.2 实验方法
2.2.1 荧光光谱和同步荧光光谱
293 K时,准确移取3 mL的Tris-HCl缓冲液至1 cm的比色皿中,固定缓冲溶液中BSA浓度为3.33×10-7mol·L-1,逐渐增加PROG浓度(每次改变3.33×10-7mol·L-1),扫描300~450 nm波长范围内的发射光谱并记录结果,298,303,310 K的研究与上述步骤一致。
设置荧光的波长差值Δλ分别为15 nm和60 nm,扫描同步荧光光谱并记录结果。
2.2.2 分子对接技术研究PROG和BSA的相互作用
PROG的结构采用ChemBio3D Ultra14.0生成,并用MMFF94分子力场进行最低能量优化,将得到的构型用于分子对接操作;从RSCB数据库中下载BSA的晶体结构(编号1H9Z),用Chemra程序检查该晶体结构的氨基酸残基并使之完整;采用软件AutoDock Vina和Pymol对PROG和BSA的三维结构进行处理并模拟两者1 ∶1结合时的构象[6]。使用LigPlus+分析PROG和BSA之间的疏水作用力及氢键。
2.2.3 红外光谱测定
按照文献[11]的实验方法测定BSA游离体系和PROG-BSA复合物体系的红外光谱。仪器参数设置如下:分辨率4 cm-1,扫描背景和样品次数64次。
3 结果与讨论
3.1 PROG与BSA 相互作用的荧光光谱分析
BSA结构中的芳香族氨基酸残基(Trp/Tyr/Phe)能够发射一定强度的内源荧光[8,12]。当以280 nm为激发波长时,345 nm谱带为这些氨基酸的主要荧光信号,而在该条件下PROG不发荧光。因此利用荧光光谱探究PROG对BSA荧光强度的影响可以很好地揭示两者之间的相互作用机制。如图1所示,随着研究体系中PROG浓度的增加,BSA的荧光强度逐渐降低,说明PROG诱导BSA的内源荧光发生猝灭,即两者之间存在相互作用。
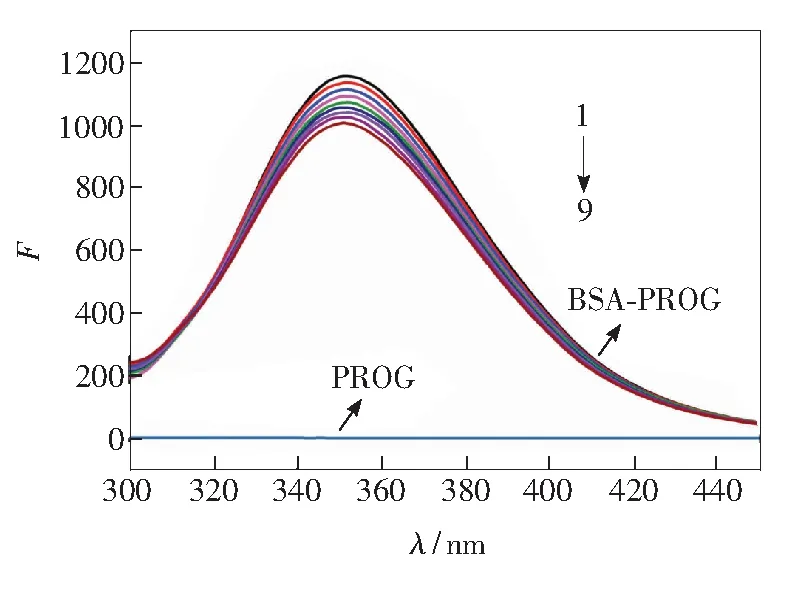
[BSA]1-9= 3.33×10-7mol·L-1, [PROG]1-9=(0, 3.33, 6.66, 10, 13.33, 16.66, 20, 23.33, 26.66)×10-7mol·L-1
图1 PROG-BSA体系的荧光光谱
Fig.1 Fluorescence spectra of PROG-BSA system
3.2 PROG与BSA结合的热力学参数与作用力类型判断
根据Stern-Volmer方程处理荧光光谱实验数据,可以进一步推断猝灭机理:
F0/F=1 +Ksv[Q]=1 +Kqτ0[Q],
(1)
在298 K时,PROG 对BSA的猝灭速率常数Kq为5.0×1012L·mol-1·s-1,比各种猝灭剂对生物大分子的最大碰撞猝灭常数2.0×1010L·mol-1·s-1高出2个数量级,由此可以判断PROG的存在诱导BSA的荧光产生了静态猝灭[4,13]。
根据方程(2)可以计算PROG-BSA体系在不同温度下的结合常数Ka和结合位点数n:
lg[(F0-F)/F]=lgKa+nlg[Q],
(2)
由拟合直线的斜率和截距所得结果如表1所示。随着体系温度的上升,PROG与BSA之间的结合常数Ka逐渐降低,进一步确认PROG对BSA具有静态猝灭作用[12,14]。此外,在人体体温范围(36~37 ℃)内PROG与BSA的结合常数达到104级别,说明其进入人体后与血液中的白蛋白具有较强的相互作用[14],从而被白蛋白运输到靶器官。通过分析药物与蛋白质大分子反应前后两者热力学熵变ΔS和焓变ΔH的相对大小即可判断复合物的作用力类型[14-16]。若ΔH<0、ΔS<0,主要表现为范德华力和氢键;ΔH<0、ΔS﹥0,主要表现为静电作用力;ΔH﹥0、ΔS﹥0,主要表现为疏水作用力。根据表1可知,ΔG<0,ΔH<0、ΔS<0,说明反应可以自发进行,且PROG和BSA之间的作用力为范德华力和氢键。

表1 不同温度下PROG-BSA体系的热力学常数
3.3 PROG与BSA的结合位点的确定
从表1可知,PROG和BSA之间存在1个结合位点。BSA有两个与小分子药物结合的结合位点,分别位于结构域ⅡA(结合位点Ⅰ)和ⅢA(结合位点Ⅱ)内[14,17]。位点Ⅰ中含有两个能够产生荧光的氨基酸(Trp和Tyr),而位点Ⅱ只含有Tyr残基。激发波长为280 nm时,可同时激发Trp和Tyr荧光,而激发波长为295 nm仅能激发Tyr的荧光[18]。因此,对比不同激发波长时PROG对BSA的荧光猝灭程度,可确定复合物体系的结合位点。如图2所示,荧光光谱结果表明,激发波长为280 nm时,PROG对BSA的荧光猝灭程度明显大于295 nm时PROG对BSA的荧光猝灭程度,即Trp残基和Tyr残基均参与了猝灭过程,说明PROG和BSA的结合位点为位点Ⅰ[19]。
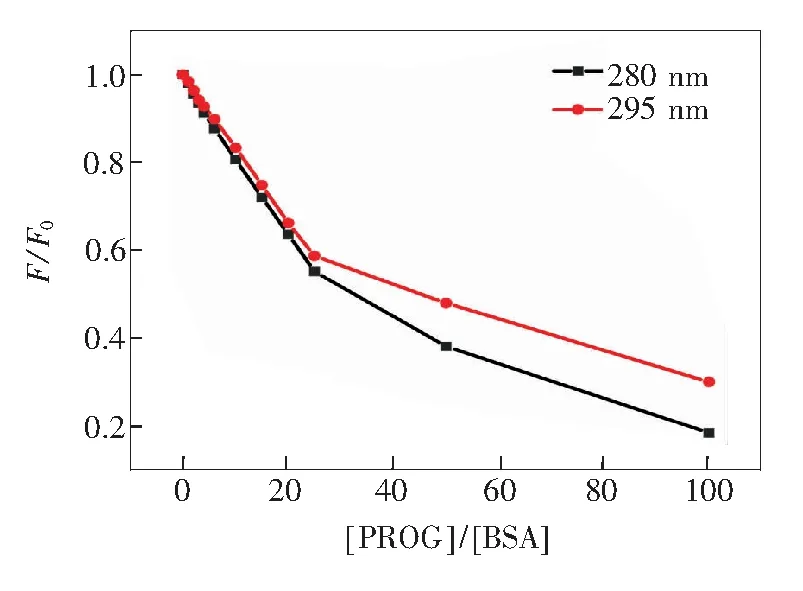
图2 不同浓度PROG下BSA的荧光光谱
Fig.2 Fluorescence spectra of BSA at different concentrations of PROG

[BSA]=3.33×10-7mol·L-1, [PROG]1-5=(0, 3.33, 6.66, 10, 13.33)×10-7mol·L-1
图3 PROG-BSA体系的同步荧光光谱。(a)λ=15 nm; (b)λ=60 nm。
Fig.3 Synchronized fluorescence spectra of PROG-BSA system. (a)λ=15 nm. (b)λ=60 nm.
3.4 PROG对BSA构象的影响

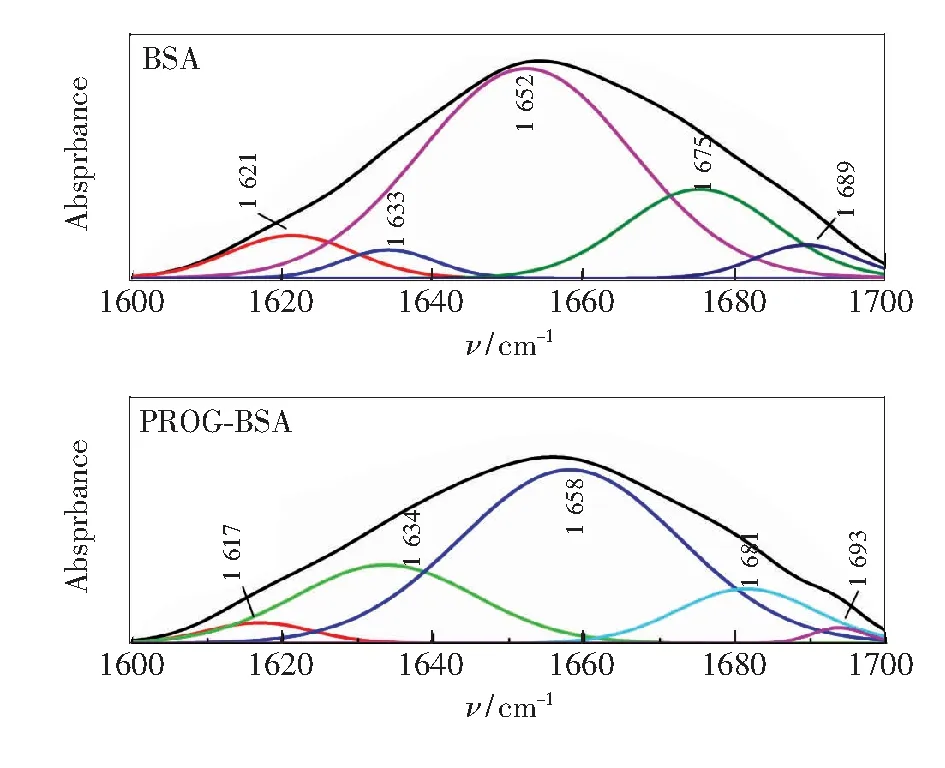
[BSA]=[PROG]=3.33×10-7 mol·L-1
Fig.4 FT-IR spectroscopy of BSA and PROG-BSA system
表2 加入PROG前后BSA二级结构构象的百分含量
Tab.2 Percentage of each conformation in BSA before and after addition of PROG

体系α-螺旋/%β-折叠/%β-转角/%β-片层/%BSAPROG-BSA64.0760.6811.6626.0019.4011.994.871.33
当PROG与BSA的物质的量比为1∶1时,α-螺旋含量由64.07%降低到60.68%,即PRORG的存在会诱导BSA α-螺旋构象减少。红外光谱和同步荧光的结果相互印证,都表明PROG会使BSA的构象发生变化。
3.5 PROG和BSA结合能量转移
根据Förster偶极-偶极非辐射能量转移定理,当小分子药物与蛋白质之间满足最大距离在7 nm范围内,将会发生非辐射能量转移[13,21]。如图5所示,PROG和BSA之间存在非辐射能量转移的可能性。将光谱重叠部分采用矩形分割法求出PROG和BSA浓度比为1 ∶1时,两者积分值J=6.87×10-17cm·L·mol-1、R0=1.07 nm、r0=1.63 nm。PROG和BSA反应的结合距离小于7 nm,满足非辐射能量转移条件,即PROG和BSA之间存在非辐射能量转移,导致BSA荧光猝灭。
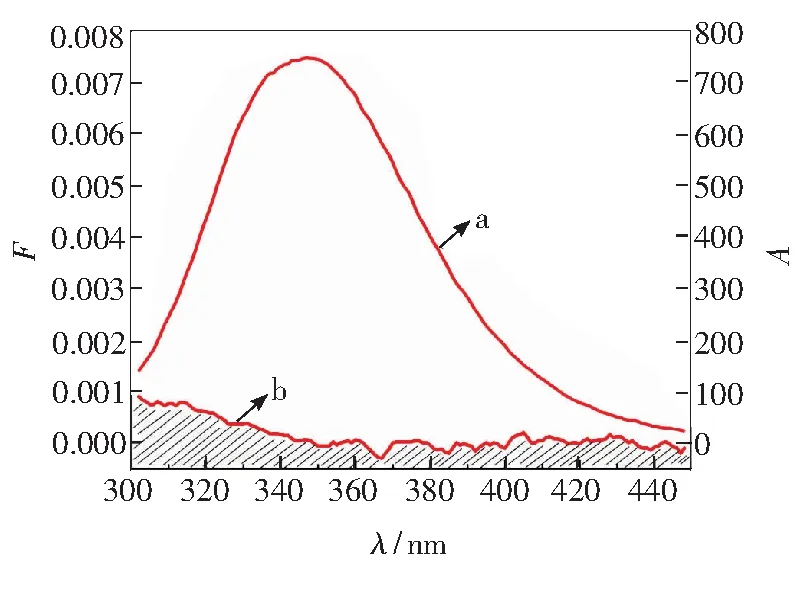
[BSA]=[PROG] =3.33×10-6 mol·L-1
Fig.5 Overlapping of fluorescence spectrum of BSA(a) and ultraviolet absorption of PROG(b)
3.6 分子对接
分子模拟可以在理论上对生物大分子和活性小分子之间作用的模式进行合理预测[13,16-17]。本研究使用AutoDock Vina对PROG和BSA的两个结合位点的结合情况进行模拟分析。模拟结果表明PROG进入BSA结合位点Ⅰ的吉布斯自由能ΔGⅠ=-36.425 kJ,进入位点Ⅱ的吉布斯自由能ΔGⅡ=-34.332 kJ。根据相关热力学理论,可以推测当PROG和BSA结合时,PROG更倾向于进入BSA的结合位点Ⅰ内结合,模拟结果与位点实验结果一致。
图6显示了PROG进入到BSA中的疏水空腔I时两者形成复合物的三维构象。通过LigPlus+软件进一步分析发现PROG与Trp214、Lys199、Lys195、Ala291等氨基酸残基之间存在相互作用。除此之外,PROG还与Lys195残基之间存在键长为0.288 nm的氢键。Trp214是BSA的主要发光基团,由此可知PROG与Trp214的相互作用是引起BSA荧光猝灭的主要原因,该结果与荧光光谱实验结果一致。

图6 PROG与BSA在结合位点Ⅰ的分子对接模拟图。(a)AutoDock Vina软件分析结果;(b)Ligplus+软件分析结果。
Fig.6 Molecular docking model of PROG and BSA. (a)Analysis results by AutoDock Vina. (b) Analysis results by Ligplus+.
4 结 论
通过整合多种光谱学和分子模拟技术方法对PROG与BSA的结合机制进行了详细研究。结果表明,PROG能够自发与BSA形成稳定的二元复合物。荧光光谱和分子对接结果互相印证,都表明PROG与Trp214之间的相互作用是导致BSA荧光猝灭的主要原因。红外光谱结果显示PROG诱导BSA的二级结构发生改变。在正常人体体温条件下,PROG与BSA的结合常数达到104级别,说明两者之间具有较强的相互作用。该研究结果为进一步探究黄体酮在生物体内的作用机制提供了一定的参考数据。
