枯草芽孢杆菌Bs-W5的生防作用研究
2019-11-18李璐璐刘瑞瑞李志英
王 琳, 李璐璐, 刘瑞瑞, 李志英
(1.西安医学院 医学技术系, 陕西 西安 710021; 2.西部生物资源与现代生物技术教育部重点实验室, 陕西 西安 710069)
在当代农业生产中,植物病原微生物是农作物减产的主要原因之一[1],所以对植物病原物的防治也显得尤为重要。在以前,人们经常使用化学农药来达到防治的目的,虽然这取得了不错的效果,但是也给环境和人民的健康带来了潜在的威胁,同时也让病原微生物有了抗性,产生了更多的环境问题。近年来,随着绿色环保的倡议越来越多,对植物病害防治有显著效果的生物防治也就脱颖而出,而其较于其他方式来说更加安全,零残留,零污染,并且还具有生产成本低,不易产生抗性等优点[2]。抗生素和植物诱导剂以及拮抗微生物等都是生物防治剂,其中微生物的种类主要有细菌,真菌,放线菌和病毒等[3]。用来进行生物防治的细菌主要有芽胞杆菌、假单胞杆菌和巴氏杆菌等[4],其中芽孢杆菌由于其产生的芽孢具有耐热、耐旱、抗紫外线的优点,成为生防研究的重要菌种资源。芽孢杆菌种群庞大,繁殖能力强,对营养和环境要求低,在自然界广泛分布,对环境无危害,容易分离培养,抑菌谱广泛,在储存、制作菌剂和运输方面都有着极强的优势。现在用来进行生物防治的芽孢杆菌有巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌(Bacillus subtilis)、短小芽孢杆菌(Bacillus Pumilus)、蜡状芽孢杆菌(Bacillus cereus)、多粘类芽孢杆菌(Paenibacillus polymyxa)等。
枯草芽孢杆菌大量存在于土壤和变质的有机物中,且不止存在于植物的根、茎、叶的表面[5],其根部和茎部组织内也存在着内生性芽孢杆菌。枯草芽孢杆菌具有抑菌谱广泛、营养要求简单、繁殖能力强,还可以形成芽孢等优点,在菌剂开发方面有着极大的优势。目前,国内外已经对枯草芽孢杆菌的生防菌种展开了大量的研究,并且取得了很大的成果,已经有商品化的枯草芽孢杆菌菌剂上市。
1 实验材料与试剂
1.1 菌种

表1 菌株情况
注:*“本实验室”指西部生物资源与现代生物技术教育部重点实验室。
1.2 培养基
PDA培养基:去皮马铃薯200 g,葡萄糖20 g,水1 000 mL,琼脂16 g,自然pH值。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂16 g,水1 000 mL,pH 7.0~7.2。
牛肉膏蛋白胨液体培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1 000 mL,pH 7.0~7.2。
种子培养基:葡萄糖20 g,蛋白胨10 g,酵母膏5 g,水1 000 mL,pH 7.0~7.2。
2 实验方法
2.1 枯草芽孢杆菌Bs-W5菌落对植物病原菌抑菌活性测定
2.1.1 Bs-W5和植物病原菌的活化 在做抑菌实验前首先要对Bs-W5和植物病原菌进行活化。Bs-W5活化:牛肉膏蛋白胨培养基,30℃,30 h;真菌病原体活化:PDA培养基,30℃培养至菌落被一半平板覆盖;细菌病原体活化:牛肉蛋白胨培养基,30℃,24 h。活化完成之后,将Bs-W5、真菌病原体以及细菌病原体接种到牛肉膏蛋白胨液体培养基中培养20 h,然后将其稀释为不同的浓度以备后续使用[6]。
2.1.2 平板菌落对峙法 笔者研究使用平板菌落对峙法来测定枯草芽孢杆菌Bs-W5对植物病原菌的抑制活性[7]。测定方法:在配置好的PDA培养基的培养皿底部找到中心点,然后在其上划十字线,将直径为6 mm的病原菌菌饼接种到中心;将Bs-W5单菌落接种到距离中心30 mm的3个方向,剩余一个方向不接种Bs-W5菌落用作空白对照。在PDA培养基中心接种病原菌而在其他地方不接种Bs-W5来作为对照组。在对照组的病原菌铺满整个培养基平板时,再测量实验组中Bs-W5对不同致病菌的拮抗宽度。每组试验做3个重复。
2.1.3 抑制率的计算方法
抑制菌丝生长率(%)
2.2 Bs-W5发酵液上清液对植物病原菌的抑制活性测定
2.2.1 Bs-W5发酵液上清液的制备和植物病原菌的活化 发酵液上清液的制备:将在牛肉膏蛋白胨培养基上活化后的菌株Bs-W5接种3环到种子培养基中,摇瓶培养22 h(30℃)。然后以5%的接种量接种到牛肉膏蛋白胨液体培养基中(锥形瓶装液量100 mL·250 mL-1),30℃,180 r·min-1摇瓶培养72 h,收集发酵液,12 000 r·min-1高速离心10 min,收集上清液,最后将收集到的上清液用0.22 μm无菌微孔滤膜过滤器进行过滤[9],最后保存以备后续使用。
植物病原菌的活化:同2.1.1的植物病原菌活化。
2.2.2 牛津杯法 笔者研究使用牛津杯法来测定Bs-W5发酵液上清液几种植物病原菌的抑制活性[10]。测定方法:在PDA培养基培养皿底部找到中心点之后划出十字线,在中心点接种直径为6 mm的病原菌菌饼,在距离中心30 mm处分别放置4个不同方向的牛津杯,在其中3个牛津杯中加入200 μL的发酵液上清液,在剩余一个牛津杯中加入200 μL无菌水作为对照。只在PDA培养基底部的中心接种病原体真菌饼的一组作为空白对照。在对照组的菌落铺满整个平板的时候,测量拮抗距离。每个实验三个重复。
2.2.3 抑制率 计算方法同2.1.3。
2.3 不同处理条件对发酵液上清液抑菌率稳定性的影响
使用不同条件处理Bs-W5的发酵液上清液来测定其抑菌率的稳定性,其中包括贮存稳定性试验、热稳定性试验、酸碱稳定性试验、光照稳定性试验和遗传稳定性试验[11]。测定抑菌率试验的植物病原菌选用抑菌率较大(53.98%)且生长较快(4 d长满整个平板)的葡萄座腔菌(Botryosphaeriadothidea),测定的方法选用牛津杯法。抑菌率的计算方法同2.1.3。
2.3.1 贮存稳定性试验 将之前备用的发酵液上清液(100 mL)取出,分成5等份,依次编号1,2,3,4和5,并以密封形式储存。在密封放置15 d的时候,开始测定1号上清液的抑菌率,30 d的时候测定2号上清液的抑菌率,60 d的时候测定3号上清液的抑菌率,以此类推[12]。使用没有任何处理的新鲜的发酵液上清液作为对照组。每组试验3次重复。
2.3.2 热稳定性试验 将之前备用的发酵液上清液(100 mL)取出,分成5等份,依次编号1,2,3,4和5。1~4号分别在40℃、60℃、80℃、100℃的条件下分别处理60 min,将编号为5的样品于120℃下处理20 min,冷却至室温,最终测定1~5号的抑菌率。使用没有任何处理的新鲜的发酵液上清液作为对照组。每组试验3次重复。
2.3.3 酸碱稳定性试验 取13等份20 mL的发酵液上清液,将其分别编号为1~13号。调节相应的pH值(1 mol·L-1的HCl和1 mol·L-1的NaOH溶液),处理12 h之后,再将pH值调节为初始的值(pH值为8),并测定用不同pH值处理之后的上清液的抑制率。使用没有任何处理的新鲜的发酵液上清液作为对照组。每组试验3次重复。
2.3.4 光照稳定性试验 取5等份20 mL的发酵液上清液,分别编号1、2、3、4、5号,多波段光照培养箱的光照强度设置为4 500±500 lx,然后以1~5号的顺序分别在光照培养箱中照射2、4、6、8、10 d后,分别测定每组的抑菌率。使用没有任何处理的新鲜的发酵液上清液作为对照组。每组试验3次重复。
2.3.5 遗传稳定性试验 第一代菌种:活化之后的枯草芽孢杆菌Bs-W5[13];第二代菌种:活化之后再培养20 h后,转接到新的牛肉膏蛋白胨培养基上的菌种,依此类推,培养10代。将2,4,6,8和10代的菌株通过摇瓶发酵培养72 h(12 000 r·min-1,10 min)之后,将收集到的上清液用0.22 μm无菌微孔滤膜过滤器进行过滤[14],最后测出发酵液上清液的抑菌率。第一代菌株的发酵液上清液为对照组,每组3次重复。
3 实验结果与分析
3.1 Bs-W5菌落对不同植物病原菌的抑制作用
在测定菌落对不同植物病原菌的抑制作用时采用的平板菌落对峙法可以直观的反映出拮抗菌的拮抗能力[15]。平板菌落对峙法可以在平板上清晰的观察到抑菌圈及拮抗宽度,是一种操作简单、实用性强的拮抗测定方法。Bs-W5对不同致病菌的抑制率如表2所示。

表2 Bs-W5对不同病原菌的抑制率
由表2得出,Bs-W5对九种植物病原真菌和两种病原细菌都有比较强烈的拮抗作用。而上述几种拮抗作用中,Bs-W5对番茄灰霉病菌的拮抗作用达到了71.02%,对腐皮镰刀菌的拮抗作用达到65.88%,是对九种病原真菌中拮抗能力最强的。而对其他的病原真菌的抑制率也都高于50%。在对两种病原细菌的拮抗作用中,Bs-W5对金黄色葡萄球菌的拮抗作用比大肠杆菌的要强一些。上述研究表明枯草芽孢杆菌Bs-W5不只可以对植物病原真菌有着较强的拮抗作用,也对部分病原细菌存在拮抗作用。
枯草芽孢杆菌Bs-W5对部分植物病原菌的拮抗效果如下图所示。

图1 枯草芽孢杆菌Bs-W5对杨树溃疡病菌的抑制作用

图2 枯草芽孢杆菌Bs-W5对葡萄座腔菌的抑制作用

图3 枯草芽孢杆菌Bs-W5对甜瓜枯萎病原菌的抑制作用
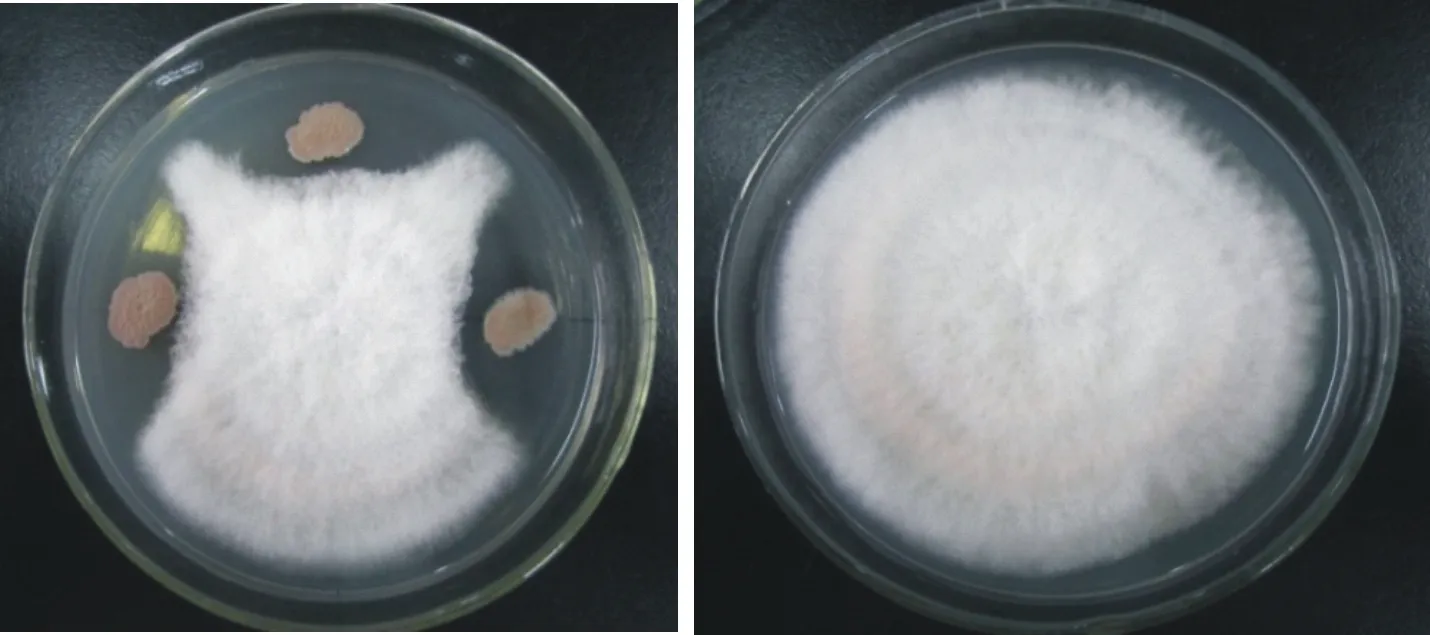
图4 枯草芽孢杆菌Bs-W5对苹果斑点落叶病原菌的抑制作用

图5 枯草芽孢杆菌Bs-W5对番茄灰霉病菌的抑制作用

图6 枯草芽孢杆菌Bs-W5对黑曲霉的抑制作用

图7 枯草芽孢杆菌Bs-W5对米曲霉菌的抑制作用

图8 枯草芽孢杆菌Bs-W5对金黄色葡萄球菌
从以上Bs-W5菌落在PDA平板上对不同病原菌的拮抗图可以看到,无论是在培养基的表面还是在培养基内部,Bs-W5对不同病原菌都有较为强烈的抑制作用。同时也可以观察到枯草芽孢杆菌Bs-W5具有很强的繁殖能力,在PDA平板上形成的菌落很大,说明Bs-W5不仅可以分泌抗菌物质对病原菌形成抑制作用,而且在生存空间和营养方面对病原菌也有着很强的竞争作用。
3.2 枯草芽孢杆菌Bs-W5发酵液上清液对不同植物病原菌的抑制作用
发酵液的上清液中存在着菌体生长过程中分泌的各种物质,其中Bs-W5分泌的各种抑菌物质对其抑菌作用起着重要作用,而发酵液上清液中抑菌物质的拮抗性的测定则使用的是牛津杯法[16]。结果如表3所示。
由表3得出,Bs-W5发酵液上清液对植物病原菌的抑制作用也较为强烈,其中对番茄灰霉病菌(Botrytis cinerea)的抑制作用达到了66.26%,是上述几种抑菌作用中最强的,而表2中运用平板菌落对峙法所测得的结果也是对番茄灰霉病菌(Botrytis cinerea)的抑制作用最强,其次对葡萄座腔菌(Botryosphaeria dothidea)的抑制作用较好,为53.98%。两种抑制方式相比,Bs-W5发酵液上清液的抑制率低于菌落的抑制率。这表明Bs - W5发酵液上清液的抑菌能力弱于菌落,这意味着虽然上清液中有抗菌物质,但是因为平板菌落对峙法中菌落不仅分泌抗菌物质,而且也对病原真菌形成一种生物竞争作用,所以两种抑制机制的共同作用下,使得菌落的抑菌性更强。
牛津杯法对部分植物病原菌的抑制作用如下所示。

表3 Bs-W5发酵液上清液对植物病原菌的抑制率

图9 Bs-W5发酵上清液对葡萄座腔菌 的抑制作用

图10 Bs-W5发酵上清液对苹果腐烂菌的抑制作用

图11 Bs-W5发酵上清液对腐皮镰刀菌的抑制作用
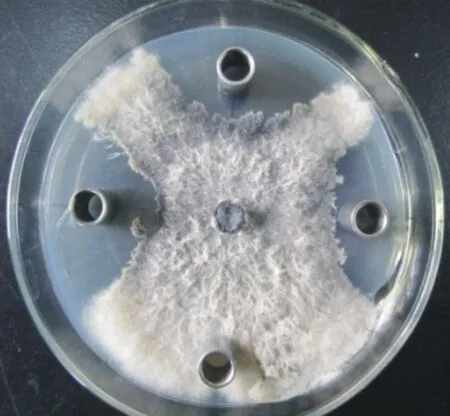
图12 Bs-W5发酵上清液对杨树溃疡病菌的抑制作用

图13 Bs-W5发酵上清液对甜瓜枯萎病的抑制作用

图14 Bs-W5发酵上清液对番茄灰霉病菌的抑制作用
上述图片表明,Bs-W5的发酵液上清液对植物病原菌有着较强的抑制作用。所以,不仅可以利用发酵液中的活细菌和孢子来进行生物防治,还可以将上清液当中的拮抗物质用于生物防治。
3.3 不同条件处理对发酵液上清液抑菌率稳定性的影响
(1)贮存稳定性。由于枯草芽孢杆菌Bs-W5发酵液上清液中的拮抗物质主要成分为蛋白质,所以如果放置时间过长的话就会发生蛋白质变性或者沉淀等问题,以至于其抑菌作用也会受到相应的影响。所以对其发酵液上清液的贮存稳定性的试验是有必要的,试验结果如图15所示。

图15 存放时间对Bs-W5发酵液上清液抑菌率的影响
由图15得出,Bs-W5发酵液上清液存放的前15 d,对其抑菌率没有明显影响,存放30 d之后,其抑菌率就开始下滑。在30~60 d的这段时间抑菌率降低最明显,60 d之后抑菌率不到原来的一半。当存放天数达到180 d的时候,菌株发酵液上清液的抑菌性几乎消失。这就说明当存放天数超过15 d后,发酵液上清液的抑菌性就开始逐渐的降低,直至最后几乎没有抑菌作用。这可能是因为15 d之后抑菌蛋白开始出现变性、沉淀等现象,使得抑菌物质的活性降低,导致上清液的抑菌率稳定性发生变化。
(2)热稳定性试验。不同温度处理之后的发酵液上清液的抑菌率如图16所示。

图16 不同温度对Bs-W5发酵液上清液的抑菌率的影响
由图16得出,在40℃的条件下处理过后,和对照组的抑菌率几乎无差别,当处理温度超过40℃,发酵液上清液的抑菌率开始下降,超过80℃之后抑菌率迅速下降,直到温度达到120℃的时候,上清液当中的抑菌率为0%。由此可见,发酵液上清液中的抑菌物质不耐高温,保存时要注意温度的控制。
(3)酸碱稳定性。酸碱稳定性试验可以了解Bs-W5发酵液上清液中的抑菌物质对酸碱的耐受程度,来防止在提取分离的步骤中使用了不当的pH值而使抑菌物质失活,这对以后抗菌物质提取、分离、纯化以及鉴定都有着重大意义[17]。不同pH值处理过的上清液的抑菌率如图17所示。

图17 不同pH值对Bs-W5发酵液上清液抑菌率的影响
由图17得出,Bs-W5发酵液上清液在pH值为7~9时,抑菌率一直保持较高水平。当pH值为9~11时,上清液的抑菌率随pH值的升高而降低。当pH值超过11时,上清液中的拮抗物质在碱性条件下变性失活而使抑菌率迅速的下降。而当pH值低于7时,上清液的抑菌率随着pH值的减小而减小,同时上清液当中存在少量的沉淀物质。这可能是因为在酸性条件下,上清液中的拮抗物质形成了不可溶性沉淀所致[18]。
(4)光照稳定性。研究抗菌物质的所有过程都是在有光照的条件下进行,所以要对Bs-W5的光照稳定性进行试验,以便后续试验得出更加准确的结果[19]。不同光照时间对上清液的抑菌率影响如图18所示。

图18 光照天数对Bs-W5发酵液上清液抑菌率的影响
由图18得出,在经过长时间光照照射之后,抑菌率比较稳定,依然保持在原有水平。这就说明Bs-W5所分泌的抗菌物质是不受光照影响的[20],可以在大田试验中直接施用,而不必担心光照所带来的影响。
(5)遗传稳定性。Bs-W5作为一株生防菌种,则其必须具有抑菌性能遗传稳定性,以防止在使用过程中出现变异等情况,使得其抑菌性能受到影响。其遗传稳定性如图19所示。
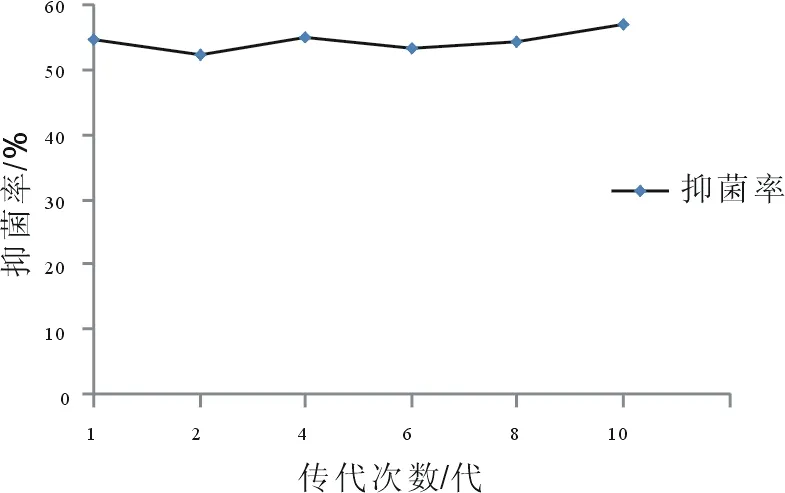
图19 传代次数对Bs-W5发酵液上清液抑菌率的影响
从图19的结果可以看到,在Bs-W5传代10代培养的过程中,其发酵液上清液的抑菌率保持较高的稳定性,这就说明菌种枯草芽孢杆菌Bs-W5有着很好的遗传稳定性,值得以后继续深入的研究,以充分发掘其生防能力[21]。
