磷钒钼黄分光光度法测定果蔬中的磷
2019-11-17何旭东尹红黄诚
何旭东 尹红 黄诚
摘要 利用磷离子与钒钼酸铵反应生成稳定黄色络合物的性质,以水为溶剂,采用分光光度法测定果蔬中的磷及其含量。用磷矾钼黄分光光度法研究了显色体系的吸收波长、显色剂用量、显色时间、显色温度、pH值以及干扰离子对果蔬中磷离子测定时的影响。结果表明,在波长440 nm、显色时间10 min、显色温度25 ℃、pH值7.5等条件下,吸光值最大,灵敏度及准确度较高,回收率为93.8%~100.8%。
关键词 磷矾钼黄分光光度法;磷;果蔬
中图分类号 O657.3 文献标识码 A
文章编号 1007-5739(2019)18-0082-03 开放科学(资源服务)标识码(OSID)
Abstract Based on the properties of stable yellow complexes formed by the reaction of phosphorus ions with ammonium vanadium molybdate,taking water as solvent,the determination of phosphorus and its content in fruits and vegetables by spectrophotometry was established.The absorption wavelength of the color-developing system,the amount of color reagent,the coloration time,the color temperature,the pH value and the influence of interfering ions on the determination of phosphorus ions in fruits and vegetables were studied by using phosphor vanadium molybdenum yellow spectrophotometry.The results showed that under the conditions of wavelength 440 nm,color development time 10 min,color development temperature 25 ℃,pH value 7.5,the absorbance value was the largest,the sensitivity and accuracy were high,and the recovery rate was 93.8%-100.8%.
Key words phosphor vanadium molybdenum yellow spectrophotometry;phosphorus;fruit and vegetable
磷是维持人体骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应[1]。磷直接参与碳水化合物的代谢和运输,对氮代谢和脂肪转化也有重要作用[2]。人体缺磷可以出现低磷血症,引起红细胞、白细胞、血小板异常[3],造成小儿佝偻病、成人软骨症、妇女生育能力下降;吸收过多的磷会引起甲状腺机能亢奋,会导致高磷血症,使血液中血钙降低,导致骨质疏松[4]。人体对钙、磷吸收的适宜比例为1∶1或2∶1,因而测定食品中的磷含量可满足人们的营养需要[5-6]。
目前,磷的测定方法主要有重量法、离子色谱法、等离子发射光谱法、摩尔法、分光光度法等[7-8]。分光光度法应用比较广泛[9-11],其中对磷矾钼黄分光光度法和磷钒钼杂多蓝分光光度法的研究较多且比较成熟[12]。磷矾钼黄分光光度法,即磷酸盐与钒钼酸铵反应生成稳定黄色络合物钒钼黄[13],钒钼黄颜色的深浅与磷酸盐浓度成正比,可进行分光光度测定[14]。无机磷分析,即采用酸化煮蒸法使其聚磷酸盐水解转化为正磷酸盐,对总磷酸盐分析采用强氧化剂在酸性条件下破坏有机磷酸使其转化为正磷酸盐,并使聚磷酸盐也水解为正磷酸盐,然后与偏钒酸盐混合溶液反应进行比色测定引磷含量的研究[15-17]。目前多使用植物體内磷的测定方法,即土壤及果蔬中磷的测定标准。总体来说,磷矾钼黄比色法成熟、易行、结果可靠,是国内通用的测定方法[18]。鉴于此,参考饲料、粮食及其加工工艺和副产品中磷含量的测定标准,以及测定方法、工作区间、消解方法、不同药剂用量的试验结果[19],本试验改进了钒钼酸铵指示剂用量、波长、pH值、显色时间与温度等条件,筛选出最佳因素。
1 材料与方法
1.1 试验材料
1.1.1 供试样品。新鲜的苹果、玉米、菠菜、胡萝卜,均从吉首农贸市场购置。
1.1.2 试验仪器。723型可见分光光度计(上海舜宇恒平科学仪器有限公司)、RP50001KF电子天平(常州锐品精密仪器有限公司)、XMTD-6000马弗炉(长沙市远东电炉厂)、恒温水浴锅(上海汗诺仪器有限公司)、101-1AB型电热鼓风干燥箱(郑州宏朗仪器设备有限公司)。
1.1.3 试验药品。磷标准溶液:1 000 μg/mL铜标准溶液,使用时用蒸馏水稀释至50 μg/mL,备用。钒钼酸铵试剂:包括A液和B液。称取25.000 0 g钼酸铵,溶于400 mL水中,即为A液。称取1.250 0 g偏钒酸铵溶于300 mL沸水中,冷却后加250 mL硝酸,即为B液。将A液缓慢加至B液中,不断搅匀,并用水稀释至1 L,混匀,贮于棕色瓶中。6 mol/L氢氧化钠溶液:称取24.000 0 g氢氧化钠,溶于100 mL水中,混匀。2 g/L二硝基酚指示剂:称取0.200 0 g 2,6-二硝基酚溶于100 mL水中,混匀。6 mol/L盐酸溶液:吸取50.0 mL盐酸溶液,用水稀释至100 mL,混匀。以上试剂均为分析纯,各种溶液均保存于聚乙烯瓶中,所用水均为二次离子交换水。
1.2 试验方法
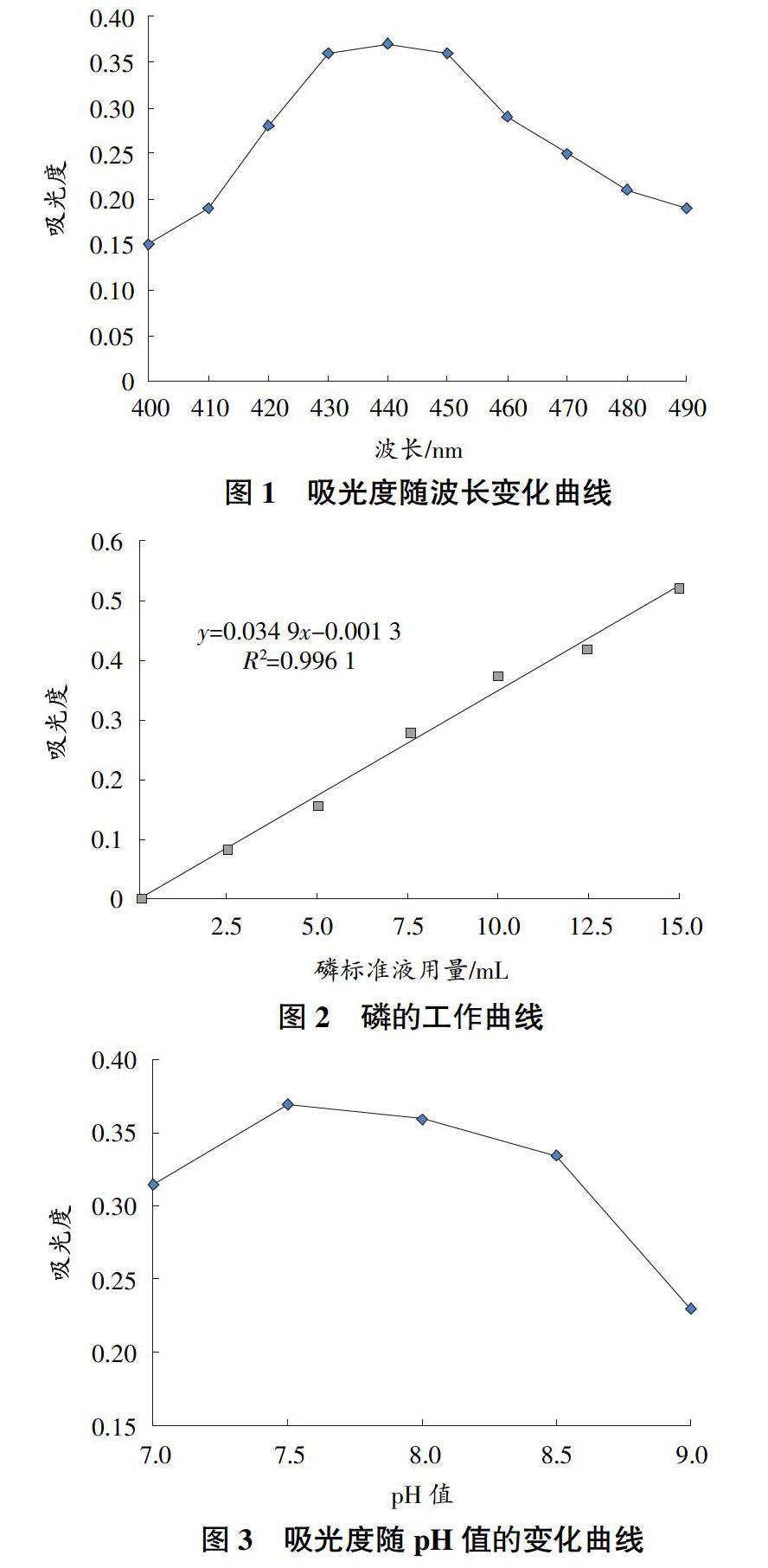
1.2.1 最佳波长的选择。准确吸取磷标准储备液10.0 mL于50 mL容量瓶中,加少量水后,加2滴二硝基酚指示剂,用氢氧化钠溶液调节pH值,直至溶液呈微黄色,再加入10.0 mL钒钼铵酸显色剂,用水定容至刻度线,在25 ℃下显色10 min,用试剂空白作参比溶液,分别在400、410、420、430、440、450、460、470、480、490 nm处测定吸光度,以波长为横坐标,以吸光度为纵坐标作图。由图1可知,吸光度随着波长增加逐渐增大,在440 nm处时达到最高。因此,最佳波长为440 nm。
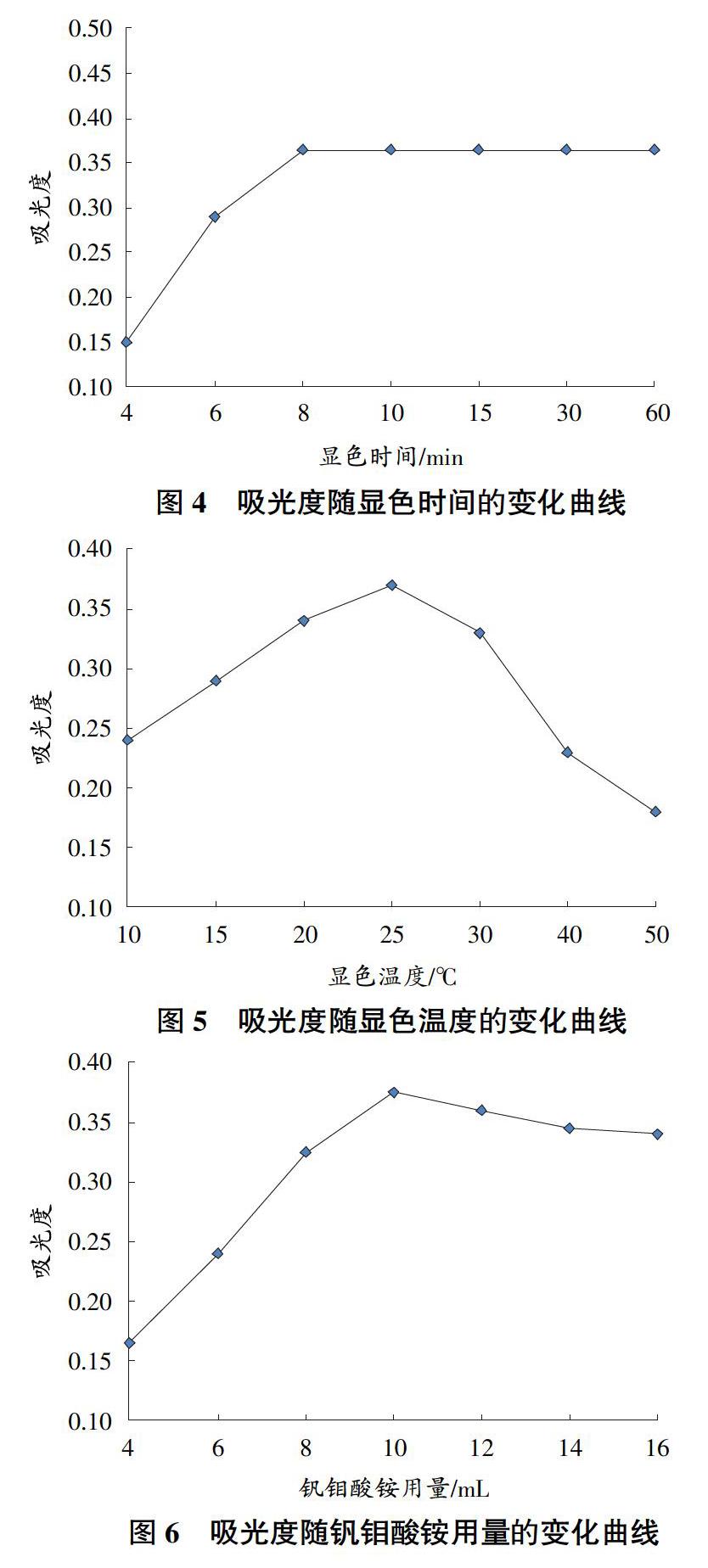
1.2.2 磷标准工作曲线。准确吸取磷标准储备液0、2.5、5.0、7.5、10.0、12.5、15.0 mL于50 mL容量瓶中,加少量水,加2滴二硝基酚指示剂,用氢氧化钠溶液调节pH值,直至溶液呈微黄色,再加入10.0 mL钒钼铵酸,用水定容至刻度线,在25 ℃下显色10 min,用试剂空白作参比溶液,分光光度计波长调至440 nm,测定吸光度。以磷标准储备液作为横坐标,以吸光度为纵坐标制作标准曲线,结果见图2。
1.2.3 试验条件优化。
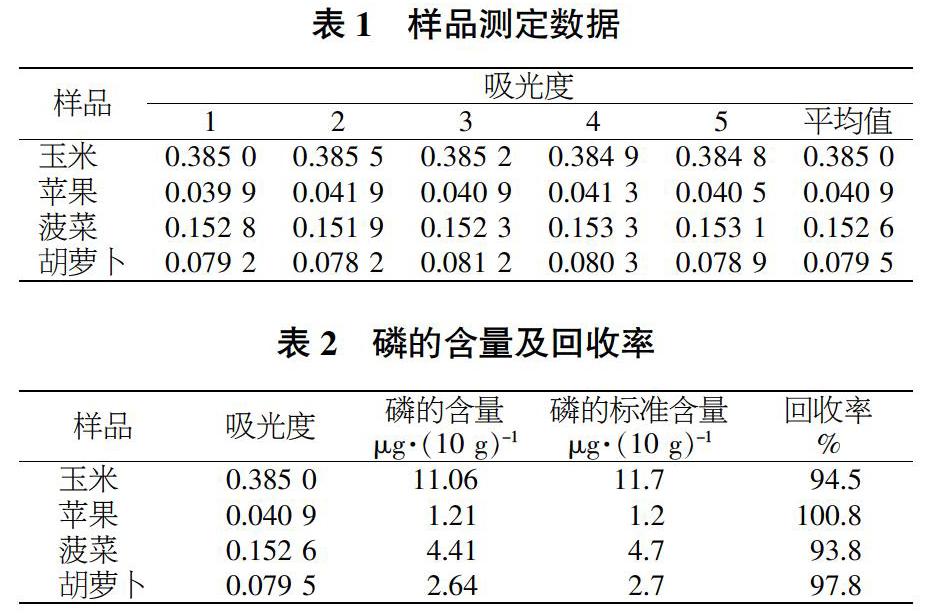
(1)pH值的选择。准确吸取磷标准储备液10.0 mL于50 mL容量瓶中,加少量水后,加2滴二硝基酚指示剂,用氢氧化钠溶液调节pH值分别为7.0、7.5、8.0、8.5、9.0。再加入10.0 mL钒钼铵酸显色剂,用水定容至刻度线,在25 ℃下显色10 min,用试剂空白作参比溶液,在440 nm处测定吸光度。以pH为横坐标,以吸光度为纵坐标作图。
(2)显色时间及络合物稳定性。准确吸取磷标准储备液10.0 mL于50 mL容量瓶中,加少量水后,加2滴二硝基酚指示劑,用氢氧化钠溶液调节pH值,直至溶液呈微黄色,再加入10.0 mL钒钼铵酸显色剂,用水定容至刻度线,在25 ℃下显色4、6、8、10、15、30、60 min,用试剂空白作参比溶液,分光光度计波长调至440 nm,测定吸光度。以显色时间作为横坐标,以吸光度为纵坐标作图。
(3)最佳显色温度选择。准确吸取磷标准储备液10.0 mL于50 mL容量瓶中,加少量水后,加2滴二硝基酚指示剂,用氢氧化钠溶液调节pH值,直至溶液呈微黄色,再加入10.0 mL钒钼铵酸显色剂,用水定容至刻度线,在10、15、20、25、30、40、50 ℃下显色10 min,用试剂空白作参比溶液,分光光度计波长调至440 nm,测定吸光度。以显色温度作为横坐标,以吸光度为纵坐标作图。
(4)钒钼酸铵用量选择。准确吸取磷标准储备液10.0 mL于50 mL容量瓶中,加少量水后,加2滴二硝基酚指示剂,用氢氧化钠溶液调节pH值,直至溶液呈微黄色,再分别加入4.0、6.0、8.0、10.0、12.0、14.0、16.0 mL钒钼铵酸,用水定容至刻度线,在25 ℃下显色10 min,用试剂空白作参比溶液,分光光度计波长调至440 nm,测定吸光度。以钒钼铵酸的用量为横坐标,以吸光度为纵坐标作图。
1.2.4 样品分析。
(1)样品处理。取新鲜果蔬苹果、菠菜、玉米和胡萝卜,将其切成小块,精确称取10.0000 g于玻璃皿中,再放置烘箱中,在60 ℃环境下烘干,接着转移到坩埚中,并加入10 mL 4 moL/L NaOH溶液,用电炉小火缓慢加热炭化,待炭化完全,再转入马弗炉中,设置600 ℃,灰化至浅灰色或白色,冷却后,加入10 mL 6moL/L HCl溶解,并多次洗涤坩埚,然后转移至100 mL容量瓶中,摇匀并定容。
(2)干扰离子的影响与消除。果蔬中常见的Fe3+、Si4+ 对试验可产生干扰,果蔬中常见的Ag+、Cd2+、Al3+ 均不干扰,Ni2+、Cu2+ 本身具有相应的颜色,可做相应的空白试验做参比消除影响。Fe3+ 的干扰可以通过调节pH值、选择波长440 nm、选择钒钼铵酸的用量来进行消除,既可消除干扰,又可保证测定的灵敏度。Si4+的干扰可以通过加入氢氟酸进行消除。
(3)样品中磷含量测定。准确吸取待测样液10.0 mL于50 mL容量瓶中,加少量水后,加2滴二硝基酚指示剂,用氢氧化钠溶液调节pH值,至溶液呈微黄色,再加入10.0 mL钒钼铵酸显色剂,用水定容至刻度线,在25 ℃下显色10 min,用试剂空白作参比溶液,分光光度计波长调至440 nm,测吸光度。
2 结果与分析
2.1 试验条件优化
2.1.1 pH值的选择。由图3可知,当pH值在7.0~7.5之间时,吸光度逐渐大,当pH值为7.5时吸光度达到最大值。而当pH值进一步增大吸光度值反而下降,故试验选取pH值 7.5作为最适测定酸度。
2.1.2 显色时间及络合物的稳定性。由图4可知,4~8 min,吸光度随显色时间的延长而增大,在8 min时达到峰值,之后随着时间的延长,吸光度不变,说明磷酸盐与钒钼酸铵反应充分。为保证磷酸盐与钒钼酸铵充分反应,将试验显色时间定为10 min。同时,将显色后的溶液放置24 h,再次测定其吸光度,吸光度基本不变,说明该络合物较为稳定。
2.1.3 最佳显色温度的选择。由图5可知,吸光度随着温度的上升而增大,25 ℃时吸光度达到顶峰,而后吸光度随之降低。因此,可以确定最佳的显色温度为25 ℃。
2.1.4 钒钼酸铵用量的选择。由图6可知,在钒钼酸铵显色剂用量为4.0~10.0 mL时,吸光度随钒钼酸铵的用量增大而增大,当钒钼铵酸显色剂的用量为10.0 mL时,吸光度最大。当显色剂用量过少时,显色不完全,吸光度较低;显色剂用量过多,会少量稀释溶液的浓度,吸光度会有微弱降低。因此,该试验钒钼酸铵最佳用量为10.0 mL。
2.2 样品分析
通过对表1的测定与记录,计算果蔬中磷的含量和回收率,结果见表2。可知,玉米中磷的含量为11.06 μg/10 g,苹果中磷的含量为1.21 μg/10 g,菠菜中磷的含量为4.41 μg/10 g,胡萝卜中磷的含量为2.64 μg/10 g,回收率为94.5%~100.8%。
3 结论与讨论
准确吸取待测样液10.0 mL于50 mL容量瓶中,加少量水后,加2滴二硝基酚指示剂,用氢氧化钠溶液调节pH值,至溶液呈微黄色,加入10.0 mL钒钼铵酸显色剂,用水定容至刻度线,在25 ℃下显色10 min,用试剂空白作参比溶液,将分光光度计波长调至440 nm,测定吸光度,用标准曲线法计算样品含量。测定结果较理想,果蔬中磷回收率为94.5%~100.8%,具有良好的检出性,适合果蔬中微量磷的测定。
4 参考文献
[1] 卫敏,刘钟栋.食品中磷的检测方法[J].中国科学:化学,2010,40(7):914-921.
[2] 王艳侠,张磊,丁尧海,等.慢性肾病-磷的重要性和磷的结合剂的选择[J].中国误诊学杂志,2009,7(9):19-22.
[3] 陈志娟,蔡梦华,高素虹.食品中磷测定方法研究[J].预防医学坛,2009(12):23-24.
[4] 孙正阳,张甜甜.果蔬产品中有机磷农药残留检测方法[J].食品界,2017(6):87.
[5] 陈澍,向仕学,宋建莉.食物中磷测定方法的改进[J].现代预学,2004(5):110-112.
[6] 金中华.不同消解时间对总磷测定影响的研究[J].黑龙江环报,2002(1):134-135.
[7] 向晓黎,王静,王国红.钒钼黄比色法测定食品中磷的研究[J].绿色科技,2015(4):65-68.
[8] 陈爱玲.磷钼酸法双试剂在模块生化分析仪上测定无机磷[J].医学理论与实践,2009,22(12):1488-1489.
[9] 赵平娟,张丙春,王磊,等.钒钼黄比色法测定食品中的磷含量[J].山东农业科学,2009(2):97-98.
[10] 罗春燕,冀宏杰,张认连,等.有机废弃物的磷素形态研究进展[J].土壤通报,2009(40):709-715.
[11] 向晓黎,罗力力,党富民,等.钼蓝分光光度法测定果蔬中磷的研究及改进[J].安徽农业科学,2015,43(8):244-245.
[12] 卢超.两种测定湿地植物总磷方法的比较研究[J].江西农业学报,2009,21(8):142-144.
[13] 靳仙宝,李军,林延鹏.应用磷钼酸法双试剂在贝克曼CX9生化分析仪上测定无机磷[J].上海检验医学杂志,2003,18(4):243-245.
[14] 申書昌,刘彩云,马振川.离子色谱法测定大豆粉中有机磷含量[J].化工时刊,2007(12):33-34.
[15] WROBEL K,WROBEL K,CARUSO J A.Selenium speciation in lowm-olecular weight fraction of Se-enriched yeasts by HPLC-ICP-MS:dete-ction of selenoadenosylmethionine[J].The Royal Society of Chemistry,2002(17):1048-1054.
[16] CHU J Z,YAO X Q,YUE ZW,et al.The effects of selenium on physio-logical traits,grain selenium content and yield of winter wheat at differ-ent development stages[J].Biol Trace Elem Res,2013,151(3):434-440.
[17] CHAND V,PRASAD S.Trace deter mination and chemical speciation ofselenium in enviro nmental water samples using catalytic kinetic spec-trophotometric method[J].J Hazard Mater,2009,165(1/3):780-788.
[18] 王玉新,杨树坤.食品中磷的钼锑抗法测定[J].中国公共卫生,2005,21(5):611.
[19] 王燕,彭利,许雄飞,等.气相色谱法测定青菜中有机磷农药残留量[J].化学工程师,2009,23(8):36-37.
