云南凤庆大叶种晒青茶茶多酚提取工艺优化及抗氧化研究
2019-11-15段凤敏张绍旺邵维炯高华磊匡兴贵饶杰保志娟
段凤敏 张绍旺 邵维炯 高华磊 匡兴贵 饶杰 保志娟

摘要:以云南凤庆大叶种晒青毛茶为原料,在单因素实验的基础上,通过Box-Behnken实验设计及响应面分析法,研究乙醇浓度、液料比、提取温度、提取时间对晒青毛茶茶多酚提取率的影响,同时通过超氧阴离子、羟基自由基和DPPH自由基的清除能力评价晒青毛茶茶多酚的抗氧化性能。结果表明,0.2g茶粉在固定超声波功率为160W下,预测最佳提取工艺为:乙醇浓度60.01%,液料比49.28:1mL/g,超声时间25min,超声温度30℃,总多酚得率为19.905%(验证值为19.83%)。云南大叶种晒青毛茶茶多酚具有很强的抗氧化能力,对超氧阴离子、羟基自由基、DPPH自由基清除的ICso值分别为7.96μg/mL、7.22μg/mL、0.433μg/mL。
关键词:大叶种;晒青毛茶;茶多酚;响应面分析;抗氧化活性
中图分类号:TS201.2 文献标志码:A 文章编号:1674-5124(2019)05-0066-08
收稿日期:2018-12-14;收到修改稿日期:2019-01-25
基金项目:国家质检总局科技计划项目(2017QK191);云南农业大学大学生科技创新创业训练计划项目(2018-180)
作者简介:段凤敏(1978-),女,云南凤庆县人,高级工程师,硕士,从事化学计量及标准物质研究。
通信作者:保志娟(1978-),女,云南曲靖市人,副教授,博士,主要从事标准物质研制与化学计量方面的研究。
0 引言
由于得天独厚的自然气候条件,云南拥有丰富的茶树种质资源。大叶种茶树是山茶科山茶,属山茶种(Camellia sinensis),是在云南特殊生态环境条件下生长繁衍的具有自身独特个性的栽培品种,分为乔木、小乔木等类型[1]。云南大叶种茶主要包括勐库大叶种、凤庆大叶种和勐海大叶种等。“凤庆大叶种”,以云南省临沧市凤庆县为中心,主要分布在滇西与滇南茶区。云南大叶种茶叶含有丰富的茶多酚、咖啡碱等功能成分[2]。茶多酚(tea polyphenols,TP)是茶叶中多酚类物质的总称,是儿茶素类(黄烷醇类)、黄酮及黄酮醇类、花青素类、酚酸及缩酚酸类、聚合酚类等化合物的复合体[3]。茶多酚中黄烷醇(儿茶素)类化合物是形成茶叶色香味的主要成份之一,也是茶叶中有保健功能的主要成份之一[1]。近年研究表明,茶多酚等活性物质还具有解毒和抗輻射作用,能有效地阻止放射性物质侵入骨髓,被健康及医学界誉为“辐射克星”和“天然抗氧化剂”,在食品、保健品、化妆品等领域有广泛的应用前景[4]。如何提取测定茶多酚已成为食品和茶叶科学研究的热点[5-6]。
超声波辅助提取茶多酚具有时间短、效率高的优点,结合响应面分析可以获得最佳的提取工艺,已成为茶多酚提取的有效方法之一[7-10]。目前,云南凤庆大叶种茶中对茶多酚的提取研究较少。因为茶多酚在极性溶剂中具有优良的溶解性,目前浸提茶多酚多采用水、乙醇等极性溶剂[11],研究表明乙醇提取比水提取茶多酚时间更短[4]。因此,本研究以云南临沧产的凤庆大叶种晒青毛茶为原料,采用超声波辅助提取法,以乙醇浓度、液料比、超声时间、超声温度为考察因素,研究了不同提取工艺参数对茶多酚提取率的影响,通过响应面优化提取工艺条件,并对最佳工艺下得到的茶多酚提取物进行体外抗氧化活性评价,以期为云南凤庆大叶种晒青毛茶的开发和抗氧化剂资源筛选提供理论依据。
1 材料与方法
1.1 试验材料
市购云南临沧产凤庆大叶种晒青毛茶(秋茶),于40℃烘箱内干燥2~3h,用粉碎机粉碎,过40目筛,密封避光保存。1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH)购于上海源叶生物科技有限公司。没食子酸,福林酚试剂、碳酸钠、乙醇等试剂均为国产分析纯。
1.2 主要试验仪器
分光光度计:WFJ200,尤尼柯(上海)仪器有限公司;电子天平:AR224CN(精确到0.1mg),奥豪斯仪器(常州)有限公司;超声波清洗机:台式数控KQ5200DE(超声频率40kHz,最大超声功率200W),浙江昆山超声清洗仪器有限公司;台式离心机:TDL-5013,上海安亭科学仪器厂。
1.3 试验方法
1.3.1 茶多酚标准曲线
用移液管分别移取0.5,1.0,1.5,2.0,2.5mL质量浓度为1mg/mL没食子酸标准母液于50mL容量瓶中,用水定容至刻度,摇匀配成系列浓度标准溶液。用移液管分别移取系列没食子酸工作液各1.0ML于刻度试管内,在每个试管内分别加入5.0mL的10%福林酚试剂,摇匀。反应5mim,加入4.0mL7.5%NaCO,溶液,加水定容至刻度、摇匀。室温下放置60min,测定765nm波长下的吸光度。根据没食子酸工作液的吸光度与浓度,制作标准曲线。
1.3.2 茶多酚提取率的测定
准确称取粉碎后的茶叶粉末样品0.2g于试管中,加入一定量的乙醇溶液,在超声波清洗器中,固定超声功率为160W,在一定的超声温度条件下,处理一定的超声时间,离心,吸取上清液于100ML的容量瓶中,用水定容为样品母液。准确移取样品母液1.0mL正于10mL容量瓶中,加水定容至刻度,摇匀得到样品待测液。取1.0mL待测液按照上述
1.3.1 测定方法加入10%福林酚试剂和7.5%NaCO3溶液,测定765皿波长下的吸光度。由标准曲线,计算出茶多酚的提取率,计算公式为:
茶多酚提取率=ρ×X×V/m×100%式中:ρ——溶液中茶多酚质量浓度,mg/mL;
X——稀释倍数;
V——滤液体积,mL;
m——样品质量,g。
1.3.3 茶多酚单因素试验
准确称取0.2g茶叶,分别考察了乙醇浓度、液料比、超声温度和超声时间对茶多酚提取率的影响。
1.3.4 响应面法优化茶多酚提取工艺
在单因素试验的基础上,以乙醇浓度、液料比、超声时间、超声温度为Box-Behnken试验设计自变量,以茶多酚提取率为实验设计的响应值,优化云南凤庆大叶种晒青毛茶中茶多酚提取工艺条件。响应面设计实验因素及水平见表1。
1.3.5 茶多酚提取液抗氧化活性实验[12-14]
1)超氧阴离子清除活性测定
在总体积为5mL的溶液中加入4mL Tris-HCl(pH 8.2)缓冲液及不同体积的待测样品,定容为5mL,于25℃恒温水浴放置20min。加入0.2mL预热过的邻苯三酚(10mmol/L,溶于10mmol/L盐酸中)引发反应,准确反应5min后,加入60μL0.1mol/L的抗坏血酸水溶液终止反应,以相应的抗坏血酸水溶液为空白,于1h内测定420mm波长下的吸光度A。其抑制率计算公式为:
抑制率%=[1-(A3-A4)]/A1-A2×100%式中:A1——不含样品的吸光度值;
A2——不含样品和邻苯三酚的吸光度值;
A3——含有样品的吸光度值;
Ax±s——含样品,但不含邻苯三酚的吸光度值。
2)羟基自由基清除活性测定
分别向5支试管中加入1mL 8.8mmol/L FeSO4、1mL 9.1mmol/L水杨酸-乙醇溶液、1ML不同浓度茶多酚提取样品液和5mL蒸馏水,再加入1ML0.06%H2O2启动反应,立即放入37℃水浴锅中保温30min后,以蒸馏水为参比,测定510mn波长下的吸光度值,记为Al。用1ML的蒸馏水代替1ML的H2O2,按上述同样的方法测定吸光度值,记录为A2。用1ML蒸馏水代替1ML样品,按上述同样的方法测定吸光度值,记录为A3。
羟基由基抑制率/%[A3-(A1-A2)]/A3×100%
3)DPPH自由基清除活性測定
配制浓度为2.0×10-4mol/L的DPPH无水乙醇溶液。取2.0mL DPPH溶液,加入不同体积的茶多酚提取样品溶液,用水定容为5mL,放置30min后,测定吸光度。
抑制率%=(A0-Ai)/A0×100%式中:A0——2.0mL DPPH溶液定容为5mL时的吸
光度;
Ai——2.0mL DPPH溶液加入样品溶液后,定容为5n止时的吸光度。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度的影响
准确取0.2g茶叶,配置乙醇体积分数为20%、30%、40%、50%、60%、70%、80%,在液料比50:1mL/g,超声温度40℃,超声20min的条件下进行样品提取,考察乙醇浓度对茶多酚提取率的影响,每个条件平行3次,不同乙醇浓度对茶多酚提取率的影响如图1所示,随着乙醇体积分数的增加,茶多酚提取率呈先上升后下降的趋势,在70%处达到最大值。因此实验选定60%、70%、80%乙醇体积分数为Box-Behnken实验的三个水平。
2.1.2 液料比的影响
准确取0.2g茶叶,乙醇体积分数为70%,超声温度40℃、超声20min的条件下进行样品提取,考察不同液料比(20:1、30:1、40:1、50:1、60:1、70:1mL/g)对茶多酚提取率的影响。不同的液料比对茶多酚提取率的影响如图2所示,当液料比为20:1(mL/g)到40:1(mL/g)时,提取率随着液料比的加大,有持续上升的趋势,在液料比40:1(mL/g)时,含量达到最高,这是因为液料比增大在一定程度上提高了传质推动力。但是在液料比大于50:1(mL/g)后,茶多酚提取率变化较小,表明此后物质不再溶出。由于液料比过大会造成浪费,故试验以40:1(mL/g)为最佳液料比,选定30:1、40:1,50:1(mL/g)液料比为Box-Behnken实验的3个水平。
2.1.3 超声温度的影响
准确取0.2g茶叶,乙醇体积分数为70%,液料比50:1(mL/g)、超声20min,考察不同的超声温度(30,40,50,60,70℃)对茶多酚提取率的影响。不同的超声温度对茶多酚提取率的影响如图3所示,当温度为30~50℃时,随着温度上升,提取率不断增加,当温度为40℃时,提取率最高,为16.55%,当温度超过40℃后,提取率随着温度的增加反而有所下降,但是当温度为60℃时,茶多酚含量再次升高,达到16.43%,在提取温度为30~70℃时,出现了两个最佳提取温度,分别为40℃和60℃,温度过高,会造成溶剂挥发损失,因此试验以40℃为最佳提取温度,选定30℃、40℃、50℃的提取温度为Box-Behnken实验的3个水平。
2.1.4 超声时间的影响
准确取0.2g茶叶,乙醇体积分数为70%,液料比50:1(mL/g),超声温度40℃,考察不同的超声时间(5,10,15,20,25,30,35min)对茶多酚提取率的影响。不同的超声时间对茶多酚提取率的影响如图4所示,随着超声提取时间的增加,茶多酚提取率呈现缓慢增加达到最高点再下降的趋势,当时间到达30min时,提取率最高,为16.68%,当时间超过30min,提取率略有下降,因此试验以30min为最佳超声提取时间,选定超声提取时间为25,30,35min试验因素水平。
2.2 提取工艺优化
2.2.1 Box-Behnken实验设计和响应面优化结果
根据单因素试验,采用Box-Behnken实验设计原理进行四因素三水平实验设计,并利用Design-Expert.V8.0.6软件进行数据拟合,优化茶多酚的提取工艺,在单因素试验的基础上,以乙醇浓度、液料比、超声时间、超声温度4个自变量的实验水平分别以-1,0,1进行编码,以茶多酚提取率为响应值,设计了四因素三水平的二次回归旋转正交试验,共有29组试验,其中24个试验为分析因子,5次试验为零点,不同实验设计及结果如表2所示。
2.2.2 模型的建立与显著性检验
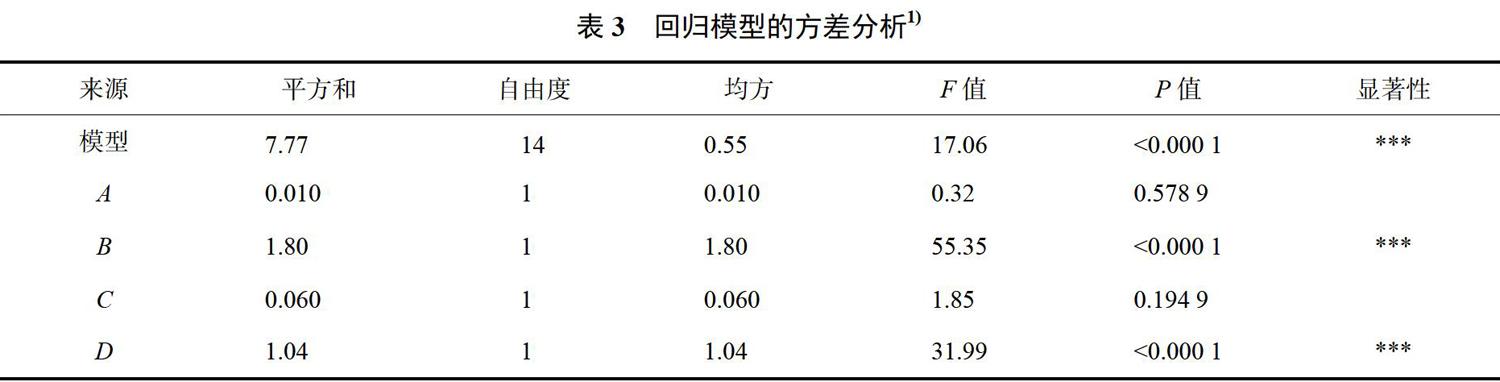
利用软件对表中的数据进行多元回归拟合,获得茶多酚提取率(Y)对自变量乙醇浓度(A)、液料比(B)、超声时间(C)、超声温度(D)的二次多元回归模型方程:Y=18.12+0.030A+0.39B-0.071C-0.29D-0.27AB+0.29AC+0.044AD+0.35BC+0.23BD+0.19CD-0.087A2+0.12B2+0.16C2+0.68D2
回归方程的方差分析数据见表3,回归模型差异极显著(P<0.0001),失拟检验值不显著(P=0.3803>0.05),说明模型可以拟合实验结果,拟合度良好。决定系数(r2)0.9446和调整后决定系数(rADJ2)0.8893,表明预测值和实测值之间具有高度的相关性;CV值为0.98%,说明模型方程能够很好地反映真实的实验值,具有可重复性。
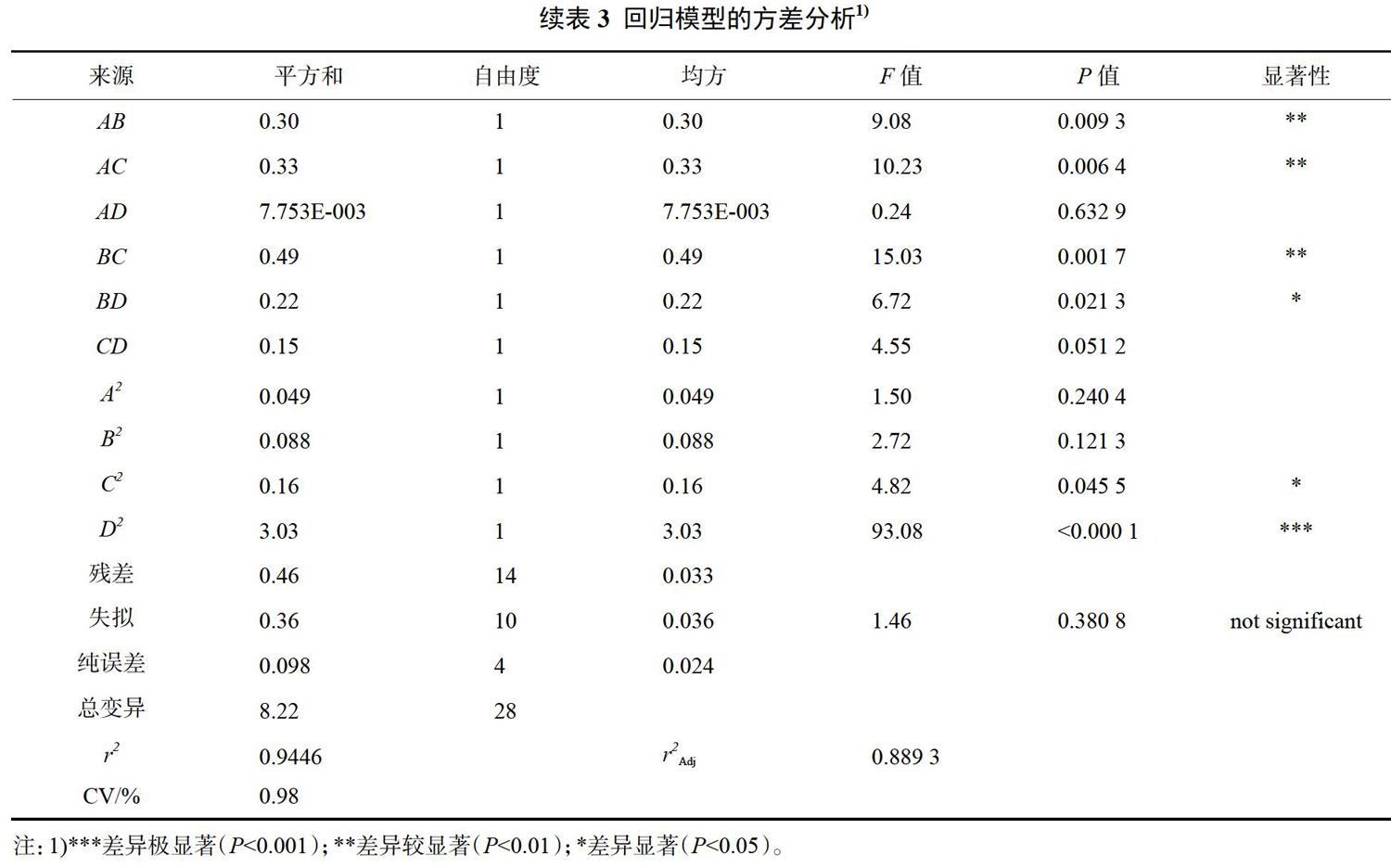
回归方程系数的显著性检验结果显示:模型中一次项(B和D)和二次项(D2)(P<0.0001)差异极显著;交互项(AB、AC、BC)(P<0.01)差异较显著;交互项(BD)和二次项(C2)(P<0.05)差异显著。
2.2.3 响应面图分析
响应面图是回归方程的形象描述,图5直观反映了乙醇浓度、液料比、超声时间、超声温度的响应曲面的形状对茶多酚提取率的影响。图5(a、b、c)及(b、d、e)分别为乙醇浓度、超声时间与其他3个因素交互作用对茶多酚提取率的影响。乙醇浓度、超声时间对茶多酚的提取率来说并不显著。图5(a、d、f)為料液比与其他3个因素对茶多酚提取率的影响。从图中可以看出,相比其他因素,料液比对茶多酚的提取率的影响更为显著,随着料液比的增加,茶多酚提取率增加。图5(c、e、f)为超声温度与其他3个因素对茶多酚提取率的影响。因为温度增加,使溶剂的粘度降低,加快了介质传递,从而导致茶多酚提取率随温度的升高明显增大。各因素对茶多酚提取率的影响的大小顺序为:液料比(B)>超声温度(D)>超声时间(C)>乙醇浓度(A)。另外,从图5中的a、b、d的图形可以看出,乙醇浓度与料液比,乙醇浓度与超声时间,料液比与超声时间的交互作用较显著,这与回归分析相一致。
2.2.4 优化与验证试验
由Design-Expert.V8.0.6软件回归模型分析,得出的茶多酚的最佳提取条件是:乙醇浓度60.01%、液料比49.28:1(mL/g),超声时间25min,超声温度30℃,在此条件下模型预测的最大提取率为19.905%。考虑到试验条件的可操作性,将提取工艺的参数调整为:乙醇浓度60%,液料比50:1(mL/g),超声时间25min,超声温度30℃,在此条件下做八次验证试验,茶多酚提取率为19.83%、与预测值的相对误差0.38%<5%,说明该模型能较好地预测实际提取量,具有较好的可行性和实用价值。
2.3 茶多酚体外抗氧化活性的测定
利用上述最优提取工艺对云南凤庆大叶种晒青毛茶中的茶多酚进行提取,试验分别测定了茶多酚提取物对超氧阴离子(O2-)、羟基自由基(·OH)和DPPH自由基(DPPH·)的抑制率IC50值。
2.3.1 茶多酚提取液清除超氧阴离子(O2-)的测定
凤庆大叶种晒青毛茶中茶多酚提取液对超氧阴离子(O2-)的清除作用由图6所示。从图中可以看出,在0~11μg/mL浓度范围内,晒青毛茶中茶多酚对超氧阴离子(O2-)的清除率随着浓度增加而逐渐升高,但当到达sμg/mL时,超氧阴离子(OZ)的清除率随茶多酚浓度的增加而趋于平缓。茶多酚清除超氧阴离子(O2-)的半数抑制浓度(IC50)约为7.96μg/mL。
2.3.2 茶多酚提取液清除羟基自由基(·OH)的测定
凤庆大叶种晒青毛茶中茶多酚提取液对羟基自由基(·OH)的清除作用由图7所示。从图中可以看出,在0~5μg/mL浓度范围内,随着晒青毛茶中茶多酚浓度的增加,茶多酚对羟基自由基(·OH)的清除率随浓度增加而逐渐升高。茶多酚清除羟基自由基(·OH)的ICsa计算为7.22μg/mL。
2.3.3 茶多酚提取液清除DPPH自由基(DPPH·的测定
DPPH的乙醇溶液为深紫色,最大吸收波长为517mm,当抗氧化剂存在时,DPPH的溶液将会褪色。凤庆大叶种晒青毛茶中茶多酚对DPPH自由基(DPPH·)的清除作用由图8所示。从图中可以看出,较低的茶多酚浓度对DPPH自由基(DPPH·)就有较高的清除率,但当浓度到达1.2μg/mL时,DPPH自由基(DPPH·)的清除率曲线变化趋于平缓。茶多酚清除DPPH自由基(DPPH·)的IC50计算为0.433μg/mL。
3 结束语
1)利用超声波辅助提取了云南临沧产凤庆大叶种晒青毛茶中的茶多酚,研究了乙醇浓度、液料比、超声时间、超声温度对提取率的影响。利用响应面分析法优化了晒青毛茶中茶多酚提取的最佳工艺条件(固定超聲波功率160W)为:乙醇浓度60.01%,液料比49.28:1,超声时间25min,超声温度30℃。在此条件下茶多酚的提取率为19.83%,与预测值之间的相对误差仅为0.38%,表明试验设计工艺条件可靠。
2)经过3种体外抗氧化指标试验,表明云南临沧产凤庆大叶种晒青毛茶中的茶多酚具有较强的抗氧化性,其清除超氧阴离子(O2-),羟基自由基(·OH)和DPPH自由基(DPPH·)IC50值分别为7.96μg/mL,7.22μg/mL,0.433μg/mL。
参考文献
[1]谢志英,黄立文,王秀华,等.云南大叶种茶不同品种儿茶素组分含量分析[J].中国农学通报,2014,30(19):146-150.
[2]杨方慧,杨毅坚,张艳梅,等.大叶种茶功能成分研究及提取开发现状[J].安徽农业科学,2018,46(11):10-13.
[3]杨皓彬,杨娜,柏雪,等.白茶中茶多酚提取工艺及抗氧化活性的研究[J].中国食品学报,2014,14(12):24-31.
[4]高海荣,赵爱娟,陈秀丽,等.从茶叶中提取茶多酚工艺的对比研究[J].中国食品添加剂,2017(3):133-137.
[5]NIHAL T,FERDA S,Y.Effects of extraction solvents onconcentration and antioxidant activity of black and black matetea polyphenols determined by ferrous tartrate andFolin-Ciocalteu methods[J].Food Chemistry,2006,99(4):835-841.
[6]黄明军,杨新河,覃彩芹,等.响应曲面法优化青砖茶茶多酚的提取工艺[J].湖北工程学院学报,2015,35(06):5-10.
[7]李洋,熊道陵,张建平,等.响应面法优化微波-超声耦合双水相提取茶多酚工艺[J].江西理工大学学报,2018,39(01):52-59.
[8]陈钢,李栋林,史建鑫,等.响应面试验优化超声耦合双水相体系提取茶多酚工艺[J].食品科学,2016,37(06):95-100.
[9]唐淯桓,梁青,邹佳佳,等.响应面法优化红茶茶多酚清除DPPE能力的研究[J].茶叶通讯,2013,40(01):3-6.
[10]龚文琼,刘睿.响应面法优化微波辅助提取普洱茶中茶色素工艺研究[J].食品科学,2010,31(08):137-142.
[11]王鑫瑶,赵鑫森.茶多酚的提取技术及优缺点比较研究进展[J].广州化工,2018,46(8):26-27.
[12]保志娟,方云山,丁中涛,等.分光光度法研究芦丁一铜配合物及其自由基清除活性[J].光谱实验室,2005,22(2):253-256.
[13]MAGDALENA J S,MAGDALENA K,AGNIESZKA Z G.Determination of antioxidant activity,rutin,quereetin,phenolic acids and trace elements in tea infusions:Influence ofcitric acid addition on extraction of metals[J].Journal of FoodComposition and Analysis,2015,40:70-77.
[14]ANNA P,KRYSTYNA P.Effect of pH and metal ions onDPPH radical scavenging activity of tea[J].InternationalJournal of Food Sciences and Nutrition,2015,66(1):58-62.
(编辑:徐柳)
