eCIM联合mCIM试验对肺炎克雷伯菌碳青霉烯酶分型的应用*
2019-11-14朱超望周莉靖王莹超
尹 娟,朱超望,眭 阳,周莉靖,江 春,王莹超
(南京医科大学附属苏州医院/苏州市立医院北区检验中心,江苏苏州 215008)
随着碳青霉烯类抗菌药物在临床上的大量使用,耐碳青霉烯类药物的革兰阴性杆菌,如肺炎克雷伯菌(KPN)、粘质沙雷菌、鲍曼不动杆菌和铜绿假单胞菌等耐药菌的检出率逐年上升。其中产碳青霉烯酶的KPN在临床样本中的分离率位于前列[1]。肠杆菌科细菌对碳青霉烯类药物耐药机制分两大类:产碳青霉烯酶和非产碳青霉烯酶,并以前者为主。按照Ambler分子分类方法可将碳青霉烯酶分为A、B、D三类。A类和D类为丝氨酸酶,B类为金属酶。A类中的KPC,B类中的NDM、VIM、IMP和D类中的OXA-48是肠杆菌科细菌中最常见的碳青霉烯酶。碳青霉烯酶基因可通过质粒、转座子或整合子等在同种菌或不同菌种间传播,导致多种革兰阴性杆菌对碳青霉烯类抗菌药物耐药,给临床治疗和医院感染控制带来极大挑战[2-4]。因此,提高临床微生物实验室人员对耐碳青霉烯类细菌碳青霉烯酶的检出率及分型的能力,有助于控制碳青霉烯酶基因在菌种间的传播。
乙二胺四乙酸改良碳青霉烯灭活(eCIM)是2018年美国临床和实验室标准协会(CLSI)推荐的一种最新的可对肠杆菌科细菌碳青霉烯酶表型分型的方法[5]。eCIM与改良碳青霉烯灭活试验(mCIM)联合使用可区分产金属酶和丝氨酸酶碳青霉烯酶的肠杆菌科细菌。与金标法PCR相比,这种方法不需购买特殊试剂和仪器设备,操作简便,易于在临床微生物实验室推广,可为临床抗感染用药提供重要参考。本研究以临床微生物室分离的耐碳青霉烯类药物的KPN为研究对象,拟探讨在临床应用实践过程中,eCIM联合mCIM试验对KPN耐碳青霉烯酶的检出率及分型准确率。
1 资料与方法
1.1一般资料 收集2016年9月至2018年1月苏州市立医院住院患者临床样本分离KPN非重复株684株,经BD Phoenix仪进行鉴定和药敏试验,选择其中耐碳青霉烯类(亚胺培南和美罗培南)KPN 94株作为研究对象。质控标准菌株:KPN ATCCBAA 1705(KPC阳性,丝氨酸碳青霉烯酶产生株),KPN ATCCBAA 1706(碳青霉烯酶阴性株),KPN ATCCBAA 2146(NDM阳性,金属酶产生株)。
1.2仪器与试剂 全自动微生物鉴定药敏分析系统购自美国BD公司,型号Phoenix 100;MALDI-TOF MS质谱仪购自德国Bruker公司;金属浴购自中国苏州珀西瓦尔实验设备有限公司,型号TZL-150-2C;低温超速离心机购自美国贝克曼库尔特公司,型号microfuge 22R centrifuge;PCR扩增仪购自美国Thermo公司,型号ARKTIK;核酸电泳仪购自美国Bio-Rad公司;凝胶成像分析系统购自中国上海天能科技有限公司,型号5200 multi;超低温冰箱购自中国海尔公司。
哥伦比亚血平板、麦康凯平板、MH平板购自中国郑州安图生物公司;胰蛋白胨大豆肉汤购自法国科玛嘉公司;亚胺培南和美罗培南药敏纸片购自英国OXIOD公司,规格10 μg;Taq PCR Master Mix、琼脂糖M、TAE缓冲液、4S Red Plus核酸染色剂、6×聚蔗糖凝胶上样缓冲液Ⅲ均购自中国上海生工生物工程股份有限公司;所有引物由中国苏州金唯智生物科技有限公司合成。
1.3方法
1.3.1细菌鉴定及药物敏感试验 标本分区划线接种于血平板和麦康凯平板后,根据菌落形态特征分离KPN单菌落,使用BD Phoenix100全自动微生物鉴定药敏分析系统进行菌种鉴定和药物敏感试验,结果参照CLSI 2018年版标准判读。收集对亚胺培南和美罗培南耐药的KPN,菌株鉴定经MALDI-TOF MS质谱仪确认,亚胺培南和美罗培南药敏数据经K-B法确认。用含40%甘油的LB液体培养基保存KPN于-70 ℃超低温冰箱。
1.3.2eCIM联合mCIM对碳青霉烯酶进行分型试验 mCIM试验:取1.0 μL接种环满环刮取血琼脂平板上过夜培养纯菌落,接种于2.0 mL胰蛋白胨大豆肉汤中,涡旋震荡混匀10~15 s,每管放入1张含10 μg美罗培南的无菌纸片,确认纸片浸没于菌悬液中,35 ℃培养箱孵育4 h。孵育结束时,用生理盐水制备0.5麦氏浊度的大肠埃希菌ATCC 25922悬液;用10.0 μL接种环将美罗培南纸片从胰蛋白胨大豆肉汤中取出,将纸片贴于试管内壁,轻轻按压以挤去纸片上多余水分,然后将纸片取出贴于已涂布有大肠埃希菌ATCC 25922的MH平板上。100 mm的MH平板贴4张纸片,倒置平板,35 ℃培养箱孵育18~24 h,量取抑菌圈直径。
eCIM试验:取第2支含2.0 mL胰蛋白胨大豆肉汤的小型离心管,管壁上标记细菌名称。加入20.0 μL 0.5 μmol/L乙二胺四乙酸溶液于2.0 mL胰蛋白胨大豆肉汤中,乙二胺四乙酸最终浓度为5.0 mM,剩下步骤同mCIM试验。mCIM和eCIM试验同步进行,mCIM和eCIM试验管中的美罗培南纸片贴于同1块已涂布有大肠埃希菌ATCC 25922的MH平板上。
结果判读的方法如下。mCIM试验:抑菌圈直径为6~15 mm或为16~18 mm但其内有散在菌落生长,为产碳青霉烯酶阳性菌株。抑菌圈直径≥19 mm,为碳青霉烯酶阴性菌株。抑菌圈直径在16~18 mm,不确定是否存在碳青霉烯酶。eCIM试验:与mCIM结果相比,美罗培南抑菌圈直径之差≥5 mm,为金属酶阳性菌株。与mCIM结果相比,美罗培南抑菌圈直径之差<4 mm,为金属酶阴性菌株。当mCIM结果为阴性时,不解释eCIM结果,因为碳青霉烯酶检测为阴性。mCIM阳性,eCIM阳性,报告为金属酶阳性。mCIM阳性,eCIM阴性,报告为丝氨酸酶碳青霉烯酶检测阳性。
1.3.3菌株DNA提取 金属浴裂解法提取细菌总DNA。取临床分离保存于超低温冰箱的菌株,室温复苏后平板划线培养于血平板,35 ℃,5% CO2培养箱培养16 h。挑取单个菌落加入预先分装有1 mL无菌蒸馏水的1.5 mL 小型离心管中,置于100 ℃金属浴,高温裂解15 min,12 000 r/min离心10 min,取上清液100.0 μL分装冻存于-20 ℃冰箱备用。
1.3.4碳青霉烯酶基因PCR检测 PCR法检测5种碳青霉烯酶基因:KPC-2、OXA-48、IMP、NDM-1、VIM。反应体系为25.0 μL,包括2×Taq PCR Master Mix 12.5 μL、上下游引物(10.0 μmol/L)各1.0 μL、DNA模板1.0 μL、ddH2O 9.5 μL。反应条件为94 ℃预变性4 min,94 ℃变性30 s,退火(KPC-2 59 ℃;OXA48 57 ℃;IMP 57 ℃;NDM1 60 ℃;VIM 57 ℃)30 s,72 ℃延伸(KPC-2 1 min;OXA48 45 s;IMP 2 s;NDM1 48 s;VIM 32 s)。产物经1 g/L琼脂糖凝胶电泳后,用凝胶成像系统分析。PCR引物参照文献[6-7]设计,见表1。

表1 碳青霉烯酶基因PCR引物序列
1.4统计学处理 运用SPSS软件对eCIM联合mCIM及PCR法对碳青霉烯酶分型及检出率进行χ2分析,P>0.05表示二者结果一致,差异无统计学意义。
2 结 果
2.1eCIM联合mCIM试验检测KPN碳青霉烯酶分型结果 94株试验株中,mCIM试验阴性7株(碳青霉烯酶阴性),mCIM试验阳性87株,eCIM阴性(丝氨酸酶表型)75株,eCIM阳性(金属酶表型)12株,见图1、表2。
2.2PCR检测KPN碳青霉烯酶基因结果 75株eCIM阴性菌株中PCR检测到丝氨酸酶基因KPC-2阳性75株。12株eCIM试验阳性(金属酶表型)菌株中PCR检测到IMP基因阳性12株,未检测到NDM-1和VIM基因,其中1例同时检测到了KPC-2基因,即同时携带丝氨酸酶和金属酶两种基因。见图2、表3。
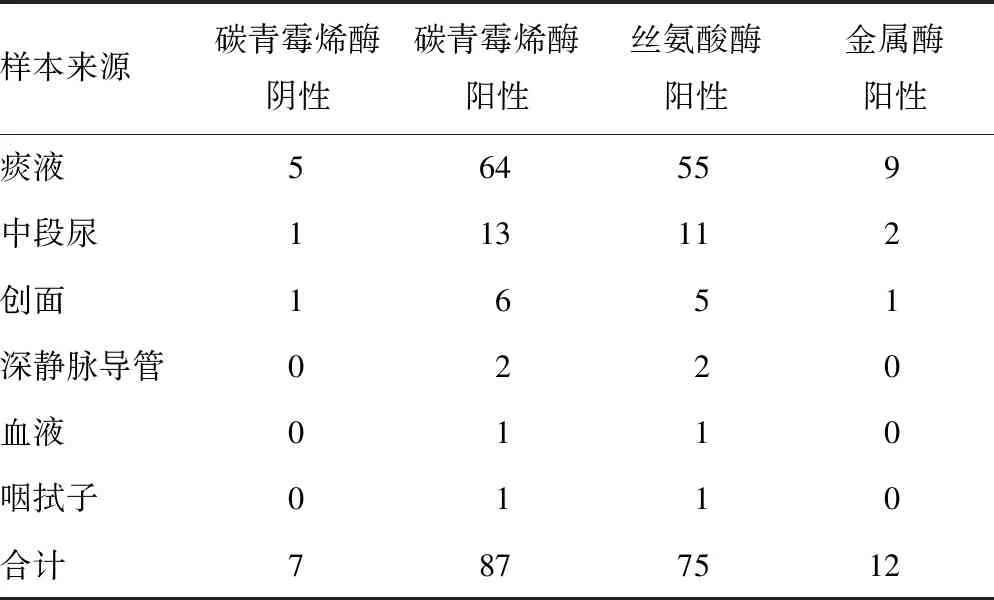
表2 eCIM联合mCIM试验检测KPN碳青霉烯酶分型结果(n)

图1 eCIM联合mCIM试验碳青霉烯酶分型结果示例

表3 KPN碳青霉烯酶基因PCR检测结果
注:*表示有1例IMP阳性菌株同时检测到KPV-2阳性
2.3两种方法对KPN碳青霉烯酶检测的一致性分析 eCIM联合mCIM试验和PCR法对KPN碳青霉烯酶检出率及分型,二者结果一致,差异无统计学意义(P>0.05)。见表4。

图2 部分菌株KPC-2阳性和IMP阳性凝胶电泳图

表4 两种方法对KPN碳青霉烯酶检出率的比较
3 讨 论
近年来碳青霉烯类耐药菌在临床样本中的分离率日益上升。有研究统计了2014-2015年,中国27个省市的KPN、大肠埃希菌碳青霉烯酶耐药率分别为8%和2%,其中KPN占耐碳青霉烯类肠杆菌科的70%,位居首位,92%的KPN产碳青霉烯酶,主要基因型为KPC(63%)和NDM(34%),有2%的菌株同时表达KPC和NDM[1]。碳青霉烯酶基因主要通过质粒传播,给临床抗感染治疗及医院感染控制带来极大挑战。
临床微生物实验室检测碳青霉烯酶表型常见方法有改良Hodge试验、Carba NP试验和mCIM试验等,但都无法对金属酶和丝氨酸酶表型进行区分[8-12]。本文通过CLSI 2018版推荐eCIM联合mCIM试验检测临床KPN碳青霉烯酶并分型,结果与PCR法相比差异无统计学意义。eCIM联合mCIM试验可对丝氨酸酶和金属酶两种碳青霉烯酶类型进行快速分型,并不需特殊试剂和特定仪器设备,准确率高[13]。虽此法在检测同时携带金属酶和丝氨酸酶基因的菌株时,只能发现金属酶表型,但在两种基因同时携带流行的概率并不高的情况下,对碳青霉烯酶类耐药肠杆菌(CRE)菌株筛查碳青霉烯酶并分型,按照CLSI 2018版的标准给临床报告eCIM阳性(金属酶)或阴性(丝氨酸酶),可为临床用药提供重要参考依据。
临床抗CRE感染治疗常联合使用多种抗菌药物。碳青霉烯类药物(亚胺培南、美罗培南等)的大量使用导致CRE菌株流行。头孢他啶-阿维巴坦是2015年在美国被批准用于治疗产KPC或OXA-48等丝氨酸酶菌株感染的复方药物[14-15]。若临床医生根据实验室结果,在对eCIM试验阴性的CRE菌株的抗感染治疗中及时选择如头孢他啶-阿维巴坦等对产丝氨酸酶菌株特异作用的药物,精准用药,可减少产碳青霉烯酶菌株的院内流行,控制感染,提高患者生存率。
4 结 论
eCIM联合mCIM试验检测KPN中碳青霉烯酶分型,与PCR结果一致性高,不需购买特殊试剂,操作简便,易于推广,可为临床抗感染用药及医院感染控制提供参考依据。
