云南疣粒野生稻原生质体高效分离培养体系的建立
2019-11-14王玲仙肖素勤钟巧芳赵才美余腾琼张敦宇殷富有程在全
陈 越,王玲仙,付 坚,陈 玲,肖素勤,柯 学,钟巧芳,赵才美,余腾琼,王 波,张敦宇,殷富有,程在全*
(1. 云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业部西南作物基因资源与种质创制重点实验室, 云南 昆明 650205;2. 云南大学, 云南 昆明 650223)
【研究意义】疣粒野生稻(OryzameyerianaBaill.) 是中国三种野生稻之一,主要分布于中国的云南省及海南省,由于长期处于野外条件下适应各种不良环境及逆境变化形成了天然的基因库,具有许多优异的抗性基因资源。据文献报道疣粒野生稻对白叶枯病、稻瘟病、稻飞虱等多种病虫害具有较高的抗性,这些特性在水稻抗性育种中具有重要意义。有研究报道疣粒野生稻比药用野生稻(OryzaofficinalisWall. ex Watt.)和普通野生稻(OryzarufipogonGriff.)具有更优异的抗性遗传特性[1]。然而疣粒野生稻属于GG基因组与栽培稻的AA基因组,存在生殖障碍,采用常规杂交方法无法利用疣粒野生稻的优异基因[2]。植物原生质体作为基因转移的理想受体,是进行基础理论研究的良好材料,利用它可以快速对目的基因进行功能分析,实现体细胞杂交、基因导入以及创造新种质或改良农作物品种[3]。因此,利用原生质体培养途径可有效发掘疣粒野生稻的优良遗传特性,为实现稻种种质资源创制提供材料基础。【前人研究进展】1892年,Klercker等[4]通过机械分离的方法首次从一种藻类植物中分离出少量原生质体。1960年Cocking等[5]以番茄根尖为实验材料,用酶解法分离出大量有活力的原生质体,极大地推动了植物原生质体的研究。1971年,Nagata等[6]通过培养烟草叶肉原生质体获得再生植株,首次建立了从原生质体到完整植株的实验体系。随着植物原生质体与细胞、分子和遗传学科的交叉渗透,使植物原生质体成为研究的热点。近年来,关于单子叶植物—水稻的原生质体相关的报道越来越多[7],然而,相对于双子叶植物,单子叶植物的结构较为复杂,使得其原生质体的制备相对来说比较困难。1985年,Fujimura等首次培养出水稻原生质体再生植株,随后原生质体培养再生植株在一些重要的单子叶作物如高粱、玉米、小麦等作物上相继报道,但缺乏对原生质体制备及植株再生培养的系统研究[8]。开展植物原生质体研究的首要条件就是要有大量有活力的原生质体。【本文研究切入点】本研究以单子叶植物云南疣粒野生稻为实验材料,对其原生质体制备和培养过程中影响产量和活力的重要因素,如酶解液组合及浓度、酶解时间、渗透压稳定剂浓度等进行有效的筛选[9-11]。【拟解决的关键问题】通过对云南疣粒野生稻原生质体的制备和培养,建立快速获得云南疣粒野生稻胚性悬浮细胞系的实验方法,筛选出酶解获得原生质体的酶的种类、浓度、酶解时间、渗透压稳定剂的浓度等,形成一套快速酶解云南疣粒野生稻原生质体的完整体系,进而建立云南疣粒野生稻原生质体培养得到再生植株的体系。为今后以疣粒野生稻原生质体为材料的其他分子生物学操作提供材料基础,也为其他相关研究提供参考。
1 材料与方法
1.1 实验材料
实验材料为采集于云南省玉溪市元江县的疣粒野生稻成熟种子。
1.2 云南疣粒野生稻悬浮细胞的培养
云南疣粒野生稻的成熟种子去颖壳后置于超净工作台中,用75 %乙醇表面消毒1 min,无菌水清洗4~5次,10 %的次氯酸钠消毒18 min,无菌水清洗8~10次,再用10 %次氯酸钠消毒10 min,无菌水清洗8~10次。最后将灭菌处理后的云南疣粒野生稻种子置于无菌吸水纸上吹干后接于N6诱导培养基(N6培养基+2,4-D 3.0 mg/L+蔗糖30 g/L+MES 0.5 g/L+植物凝胶2.8 g/L,pH 5.8)上。在28 ℃条件下暗培养,经40~60 d,待长出愈伤组织,选取淡黄色块状颗粒,切下胚乳和长出的小芽,只保留愈伤组织,将其转接到N6继代培养基(N6培养基+2,4-D 2.0 mg/L+蔗糖30 g/L+MES 0.5 g/L+植物凝胶2.8 g/L,pH 5.8)上,继代培养3次以上,得到性状稳定的云南疣粒野生稻愈伤组织。
选取0.48 g质地坚硬、结构致密、淡黄色颗粒分散的胚性愈伤将其接入装有30 mL N6液体培养基(N6培养基+2,4-D 2.0 mg/L+蔗糖 30 g/L+MES 0.5 g/L,pH 5.8)的三角瓶中进行悬浮培养[12]。将悬浮培养物置于摇床上,28 ℃,110 r/min,暗培养,每5 d继代1次,每次继代时倾去约2/3体积的上清液,补充N6液体培养基至30 mL继续培养。在悬浮培养继代2次后,每次继代时根据培养阶段及悬浮细胞颗粒的大小依次选择10、20、40目孔径的不锈钢筛网对悬浮培养的细胞进行过滤,滤去大细胞团和一些死细胞,只留下大小均一的悬浮细胞,悬浮培养45~60 d后,建立起云南疣粒野生稻胚性悬浮细胞系。
1.3 云南疣粒野生稻原生质体的分离纯化
用60目的不锈钢筛网(提前用0.6 M甘露醇润洗)过滤云南疣粒野生稻胚性悬浮细胞,过滤后以800 r/min离心1 min收集悬浮细胞,收集的悬浮细胞按1︰10比例放入不同浓度组成混合酶液中,经60目不锈钢筛网(提前用酶混合液润洗)过滤,过滤后在27 ℃,70 r/min上振荡酶解。酶解完成后用300目不锈钢筛网(提前用0.6 M甘露醇润洗)过滤酶解液,过滤后静置3 min,离心收集原生质体,然后用0.6 M甘露醇洗液洗1次,再用原生质体培养培养基(N6培养基+B5维生素+水解络蛋白 0.5 g/L+甘氨酸 2 mg/L+谷氨酰胺 146 mg/L+葡萄糖 90 g/L+MES 975 mg/L+2,4-D 1 mg/L,pH 5.8)清洗1次,清洗的过程动作要轻柔。以上用于原生质体制备和分离的试剂、培养基均经0.22 μm微孔滤膜过滤灭菌处理,现配现用。
1.3.1 酶解时间对云南疣粒野生稻原生质体产量和活性的影响 酶解云南疣粒野生稻的悬浮细胞(酶溶剂为0.6 M的甘露醇),酶液成分:2 % 纤维素酶(Cellulase Onozuka RS),0.2 % 果胶酶(Pectolyase Y-23),MES 5 mM,甘露醇 0.6 M,CaCl25 mM,pH 5.8(纤维素酶和果胶酶参照文献[12]),酶解时间设置为0.5、1、2、3、4、5 h。酶解完成后测定分离出疣粒野生稻原生质体的产量和活力,确定其最佳的酶解时间。

表1 酶解液组合
1.3.2 不同酶液组合对云南疣粒野生稻原生质体产量和活力的影响 酶解液共设6个组合(表1),每个酶解液组合分别加入1 g云南疣粒野生稻悬浮细胞,在优化出的最佳酶解时间范围进行酶解,每个处理3次重复,测定分离出的云南疣粒野生稻原生质体的产量和活力,筛选最适酶液组合。
1.3.3 缓冲液浓度对云南疣粒野生稻原生质体产量和活力的影响 优化出最适酶解时间、酶解组合及浓度后将疣粒野生稻的悬浮细胞分别转入甘露醇浓度为0.4、0.5、0.6、0.7、0.8 M的最适酶液组合中进行酶解,测定各个缓冲液浓度下原生质体产量和活力,确定最适的甘露醇浓度。
1.4 云南疣粒野生稻原生质体产量及活性的测定
利用血细胞计数板测定疣粒野生稻原生质体产量,在显微镜下观察计数,重复4~5次,计算出1 mL中的原生质体数。将原生质体的密度用原生质体培养基调至0.5~1.0×105/mL,备用。
原生质体的数量=1个大方格的悬浮液(0.1 mm3)中的细胞数×104。
对纯化后的原生质体进行活力测定。每 5 mL云南疣粒野生稻原生质体加入0.1 μg/mL FDA,静置10 min后在荧光显微镜下观察,有活力的原生质体会发出绿色荧光。在明场暗场下各选取3个视野统计原生质体的数量及活力。
1.5 云南疣粒野生稻原生质体植株的再生
调整分离纯化的云南疣粒野生稻原生质体的密度并重新悬浮在液体培养基中,分别用液体浅层培养和固液培养的方式对云南疣粒野生稻的原生质体进行培养,以筛选出培养云南疣粒野生稻原生质体的最适培养基。液体浅层培养所用的培养基:N6培养基+B5维生素+水解络蛋白 0.5 g/L+甘氨酸 2 mg/L+谷氨酰胺 146 mg/L+葡萄糖 90 g/L+MES 975 mg/L+2,4-D 1 mg/L,pH 5.8)。固液培养则先在培养皿底部浅铺一层改良了的N6固体培养基(N6培养基+B5维生素+L-脯氨酸1 g/L+水解络蛋白1 g/L+蔗糖30 g/L+MES 0.5 g/L+植物凝胶 2.8 g/L,pH 5.8),再将悬浮于液体培养基中的原生质体均匀铺于固体培养基上即可,于温度28 ℃的培养箱中黑暗条件下进行培养。培养7 d后每周添加含3 %葡萄糖的液体培养基,定期观察云南疣粒野生稻原生质体在不同培养基上的生长情况。待再生可见的细胞团长至直径1.5~2 mm大小时,每周添加液体培养基直到再生细胞团长至4 mm大小,将其接入2,4-D浓度为1.5 mg/L改良了的N6固体培养基中进行继代培养,待其长至5 mm时将其转至N6分化培养基中,因分化材料为原生质体再生细胞团故对N6分化培养基做了相应改良,改良后的配方:N6培养基+6-BA 4 mg/L+ZT 1 mg/L+KT 2 mg/L+NAA 0.3 mg/L+水解络蛋白 3 g/L+L-脯氨酸 1 g/L+Ficoll 2 g/L+蔗糖 20 g/L+植物凝胶 2.8 g/L,pH 6.0,在培养箱中28 ℃,光照12 h,光强4000 lx,再生苗长至1~2 cm时,将光强降至3000 lx。当再生苗长至3 cm时将其接入生根培养基中进行培养,培养基配方:N6培养基+NAA 0.4 mg/L+Ficoll 3 g/L+蔗糖 10 g/L+植物凝胶 2.8 g/L,pH 6.0,在培养箱中光照12 h,光强为 2500 lx,28 ℃培养。待再生苗的主根长至2 cm,须根长至1.5 cm时,从生根培养基中取出生根苗,用自来水冲洗,将其根部的培养基洗净后用水将生根苗根部淹没,放置于光照12 h,光强为 2500 lx,28 ℃进行炼苗培养,7 d后将锻炼苗移栽于土中。
2 结果与分析
2.1 云南疣粒野生稻胚性悬浮细胞系的快速建立
将云南疣粒野生稻愈伤组织加入到含有N6液体培养基的三角瓶中,经过45~60 d获得如沙尘状分散度极高无褐化的细胞团即云南疣粒野生稻胚性悬浮细胞系(图1A),显微镜下观察发现,此时悬浮细胞大小均一,细胞形态为椭圆形,细胞质浓厚(图1B),细胞形态与向太和等[10]所描述的适合做原生质体培养的胚性悬浮细胞系相似。
2.2 酶解时间对云南疣粒野生稻原生质体分离效果的影响
酶解获得原生质体的效果与酶解时间密切相关,酶解时间过短、酶浓度过低,均会造成酶解不充分,从而影响原生质体的产率和质量;如果酶解时间过长,酶解液会对原生质体产生一定的毒害作用导致原生质体的产率和质量也会下降。云南疣粒野生稻悬浮细胞在酶液中酶解0.5~5 h后原生质体的产量和活力见图2~3。酶解0.5、1、5 h疣粒野生稻原生质体产量均较其他几个时间段要低,酶解3 h时云南疣粒野生稻原生质体的产量最高,酶解2 h时原生质体的产量和活力均较高,综合考虑产量和活力因素,2 h为云南疣粒野生稻原生质体的最适酶解时间。
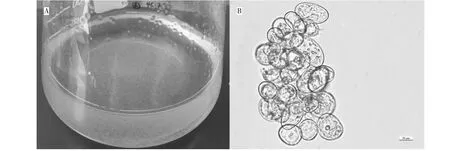
A: 云南疣粒野生稻胚性悬浮细胞系;B:云南疣粒野生稻悬浮细胞镜检图A: The embryogenic suspension cell lines of Oryza meyeriana Bail.; B: The microscopy of embryogenic suspencion cells图1 云南疣粒野生稻胚性悬浮细胞Fig.1 Embryonic suspension cells of Oryza meyeriana Bail.
2.3 不同的酶液组合对云南疣粒野生稻原生质体产量和活力的影响
适宜的酶种类及浓度组合是获得高质量原生质体的保障,云南疣粒野生稻原生质体在不同的酶液组合中酶解2 h后的分离效果差异较大。从表2中可看出,酶的种类和浓度会影响原生质体的产率和活力,综合比较各个酶液组合对原生质体酶解的效果发现1.5 % 纤维素酶+0.3 % 果胶酶组合可使原生质体的产量达到1.45×106个/g·FW,活力达到90.17 %。因此,选择此浓度组合用来酶解云南疣粒野生稻的悬浮细胞。

图2 不同酶解时间处理下云南疣粒野生稻原生质体的产量Fig.2 The protoplast yield of Oryza meyeriana Baill. at different enzymolysis duration
2.4 酶解云南疣粒野生稻悬浮细胞渗透压稳定剂浓度的筛选
对不同浓度甘露醇缓冲液处理的原生质体的显微观察发现,以甘露醇缓冲液浓度为0.4和0.5 M处理时,云南疣粒野生稻的原生质体破裂程度较大,且细胞较为膨胀,可能这两个浓度的甘露醇缓冲液低于疣粒野生稻原生质的体渗透压,导致细胞大量吸水膨胀破裂;而以0.7和0.8 M甘露醇缓冲液处理的云南疣粒野生稻原生质体的细胞碎片较多,且细胞多为萎蔫皱缩状态,说明这两种甘露醇缓冲液浓度较高,造成大部分细胞脱水。只有以0.6 M甘露醇浓度处理的云南疣粒野生稻原生质体状态较好,且视野中细胞碎片较少(图4A)。
将不同甘露醇浓度酶解纯化的原生质体用0.01 % FDA染色在5倍镜下显微观察原生质体的活力,经FDA染色后活细胞在荧光显微镜下发绿色荧光,而死细胞则不着色(图4B),在3个视野下统计活细胞的数量。从图5~6中可以看出,云南疣粒野生稻在0.6和0.7 M处理下均得到了较高的产量,而以0.6 M甘露醇处理时它的原生质体活力较高(此结果与显微镜下观察的一致),说明0.6 M甘露醇是获得云南疣粒野生稻原生质体较适宜的缓冲液浓度。
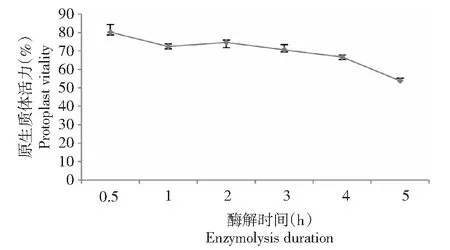
图3 不同酶解时间处理下云南疣粒野生稻原生质体的活力Fig.3 The protoplast viability at different enzymolysis duration

表2 不同酶解液浓度组合酶解获得的云南疣粒野生稻原生质体产量及活力
2.5 云南疣粒野生稻原生质体培养及植株再生
对云南疣粒野生稻原生质体分别采用液体浅层培养和固液培养5~10 d后均可用肉眼观察到细胞团。通过实验发现液体浅层培养前15 d细胞生长较好,有明显的再生细胞,但这些细胞在一段时间后就不再分裂,最终也没有长成愈伤组织。固液培养方法培养疣粒野生稻原生质体,一般12~24 h原生质体恢复细胞壁,并且重新形成小细胞团(图7A),2~4 d发生细胞第1次分裂(图7B)约2个月长至直径1.5~2 mm的细胞团(图7C),继续培养愈伤组织到3 mm时将其接入继代培养基中,经一段时间的继代、分化、生根培养得到云南疣粒野生稻原生质体再生植株,具体过程见图8。

图4 0.6 M甘露醇渗透压获得云南疣粒野生稻原生质体经FDA染色图Fig.4 FDA staining of protoplasts at 0.6 M mannitol osmotic pressure

图5 不同甘露醇浓度处理下云南疣粒野生稻原生质体的产量Fig.5 Protoplast yield of Oryza meyeriana Baill. at different mannitol concentrations

图6 云南疣粒野生稻原生质体在不同甘露醇浓度处理下的活力Fig.6 The protoplast vitality of Oryza meyeriana Baill. at different mannitol concentrations
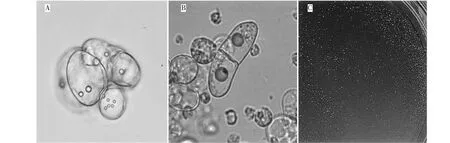
A:疣粒野生稻原生质体再生细胞团;B:原生质体复壁后细胞第1次分裂;C:疣粒野生稻原生质体再生微愈伤组织A: Regenerated cells of the protoplasts; B: The first division of cells after the reconstruction of the protoplasts; C: Regenerated micro callus of the protoplasts图7 云南疣粒野生稻原生质体的培养Fig.7 Protoplasts of Oryza meyeriana Baill. cultivation

A:原生质体发育的愈伤组织的分化培养;B、C:原生质体再生的小苗:原生质体再生苗;D:原生质体再生植株A: Callus culture from the protoplasts; B,C: Regenerated plantlets; D: Regenerated plants图8 云南疣粒野生稻原生质体再生苗成长全过程Fig.8 The regeneration process of plants from the protoplasts of Oryza meyeriana Baill.
3 讨 论
3.1 影响云南疣粒野生稻原生质体产量和活力的因素
植物原生质体是没有细胞壁包裹的,具有活力和全能性的细胞,原生质体在细胞杂交,基因导入以及创造新种质方面均有很大潜力。单子叶植物水稻原生质体的获得较双子叶植物困难,一般需借助胚性悬浮细胞培养体系分离而来。悬浮细胞系是一些没有个体差异、生长状态基本相同且遗传背景相同的细胞群体,悬浮细胞的生长条件容易控制,具有较好的细胞全能性,是作为细胞研究的良好材料。
建立植物胚性悬浮细胞系可以根据不同植物的特点选择MS液体培养基、N6液体培养基和AA培养基。在实验中发现AA培养基营养太过于丰富易造成悬浮细胞的褐化且相对于N6培养基,AA培养基培养的水稻悬浮细胞增值速度较慢与朱根发等[11]的研究一致。因此,本文在培养云南疣粒野生稻悬浮细胞时采用添加了2,4-D 2.0 mg/L+蔗糖 30 g/L+MES 0.5 g/L的N6液体培养基,对比发现用此培养基培养的云南疣粒野生稻胚性悬浮细胞不易褐化,而且在培养的各个阶段保持培养基的一致性更有利于悬浮细胞的生长。悬浮细胞继代2次后在培养的不同阶段根据悬浮细胞的大小依次用10、20、40目孔径的不锈钢筛网对悬浮培养的细胞进行过滤,只留下大小均一的悬浮细胞。用此法只需45~60 d即可建立起良好的胚性悬浮系,比蔺忠龙等[12]和朱永生等[13]建立水稻悬浮细胞系的周期3~4个月缩短了1个多月的时间。因悬浮细胞的培养对实验操作要求较高,需每5~7 d在超净工作台中进行继代,且继代过程中材料极易污染,建立胚性悬浮细胞系周期的缩短大大降低了反复多次操作造成材料污染的风险和实验的工作量。
果胶酶、纤维素酶及半纤维素酶等是植物原生质体分离过程中常用的酶,酶的组合、酶的浓度及酶解时间对分离原生质体的效果有很大的影响[14]。蒋友燊等[14]以9种酶液分离百脉根的原生质体,发现酶浓度和酶解时间与原生质体的产量成正比,与其活力成反比。段炼等[15]用生长12 d的水稻幼苗的叶和茎在纤维素酶和果胶酶的共同作用下酶解4 h,得到的水稻原生质体产量为1.68×107个/g·FW,活力在66.7 %以上。Rebecca Bart等[16]用1.5 % 纤维素酶+0.75 % 果胶酶+0.1 % BSA酶解生长14 d的水稻叶片4 h,得到的原生质体数目为1~5×105个/g·FW,活力接近100 %。本文在收集悬浮细胞和酶解前分别用60目的不锈钢筛网过滤云南疣粒野生稻胚性悬浮细胞,此法既可滤去大颗粒悬浮细胞及细胞团,又可以令小颗粒细胞团分散开,使其在酶解时可以充分与酶液接触,缩短酶解时间,防止酶解时间过长对细胞的毒害。过滤后的悬浮细胞分别在6种酶液组合中进行酶解,2 h后酶解组合1.5 %纤维素酶+0.3 %果胶酶所获得的云南疣粒野生稻原生质体的产量可达1.45×106个/g·FW,活力为90.17 %,相比较其他酶液组合要高。有报道指出,原生质体离体的时间越长,其生理功能、活性就越低[15],此方法可在较短的时间内酶解出产量和活力俱佳的原生质体,既保证了后续实验体系的有效性,又节约了实验时间。
原生质体的产量和活力除了与酶的种类、酶的浓度、酶解时间及酶解的操作方法有关,还与维持原生质体膜稳定和完整的酶溶剂及纯化溶液中的渗透压有关,常用的渗透压稳定剂为葡萄糖、蔗糖、甘露醇、山梨醇[17-18]。本文参照向凤宁[19]分离和纯化小麦原生质体的方法,并对渗透压稳定剂甘露醇的浓度进行筛选,发现疣粒野生稻原生质体在甘露醇浓度为0.6 M时产量和活力较高,在显微镜下可见呈圆形或椭圆形边缘清晰的球状原生质体,视野内碎片较少,用FDA检测时有活力的原生质体发出绿色的荧光,这与Oliveira等[20]得出的0.55~0.6 M甘露醇浓度适宜于原生质体分离的结果基本相似。
3.2 云南疣粒野生稻原生质体再生植株的培养方式
不同的原生质体采用的培养方法也有差异,常用的方法为液体浅层培养和固液双层培养等。液体浅层培养,便于添加新鲜培养基,但其具有流动性,难以跟踪观察某一细胞的生长分裂情况,且原生质体分布不均匀;固液培养有利于固体培养基中的营养成分缓慢地向液体培养基释放,同时原生质体代谢所产生的有害酚类物质也可被固体培养基吸收,有利于细胞的持续分裂。本文在对比两种培养方式对疣粒野生稻原生质体培养效果时发现,固液培养的原生质体可以得到细胞团并由细胞团进一步发育为原生质体的再生植株,与陈爱萍等[21]在对‘新牧4号’紫花苜蓿原生质体培养时认为固液培养更适合苜蓿原生质体的分裂与培养的结果一致。
4 结 论
通过制备原生质体实验体系的优化,建立了快速获得云南疣粒野生稻胚性悬浮细胞系的实验方法,并筛选了获得原生质体的酶的种类、浓度、酶解时间、渗透压稳定剂的浓度等,形成一整套快速酶解云南疣粒野生稻原生质体的体系,建立了较适合云南疣粒野生稻原生质体的培养方式,并得到了再生植株。以上研究结果对以疣粒野生稻原生质体为材料的基因功能、细胞生理功能、细胞工程、改良品种及种质创新研究具有重要的意义。
