大剂量甲氨蝶呤亚叶酸钙解救疗法治疗恶性肿瘤专家共识
2019-11-14
甲氨蝶呤(methotrexate,MTX)为一种干扰叶酸代谢的抗肿瘤药,其结构与叶酸类似,通过竞争性抑制细胞中二氢叶酸还原酶(dihydrofolate reductase,DHFR)的活性,阻止二氢叶酸还原为四氢叶酸,使胸腺嘧啶核苷和嘌呤核苷酸合成中的一碳单位转移受阻,抑制肿瘤细胞DNA和RNA的合成,从而抑制肿瘤细胞的增殖和复制。大剂量MTX(high dose methotrexate,HD-MTX)血药浓度明显增加,既可以透过血脑屏障,又可以达到血运不佳的实体肿瘤,通过被动扩散进入细胞质内。目前,HD-MTX广泛应用于急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)、骨肿瘤、淋巴瘤等。对于提高原发中枢神经系统淋巴瘤(primary central nervous system lymphomas,PCNSL)无病生存率,降低患儿ALL髓外白血病的发生,降低伯基特淋巴瘤和淋巴母细胞淋巴瘤中枢侵犯,提高总体生存率均起到关键作用。大剂量甲氨蝶呤亚叶酸钙解救(high dose methotrexate-calcium folinate-rescue,HD-MTX-CFR)疗法中应用的MTX剂量属于致死量,在增加细胞毒作用提高抗肿瘤疗效的同时,也会出现极为严重的骨髓抑制及多脏器功能衰竭等损伤,合理的甲酰四氢叶酸钙(calcium folinate,CF)解救和水化碱化显得尤为关键。为提高HD-MTX化疗的临床疗效和安全性,规范CF解救的剂量和时间,中国临床肿瘤学会(CSCO)、CSCO抗白血病联盟、CSCO抗淋巴瘤联盟在参考国内外循证医学资料和相关指南的基础上,结合临床实践编写了此共识,供血液科、肿瘤科及儿科医生参考。
1 HD-MTX-CFR治疗恶性肿瘤的作用机制
1.1 HD-MTX的定义及作用机制
MTX多数剂量达到>20 mg/kg或500 mg/m2,比常规剂量大10倍以上;也有剂量>40mg/kg或1000mg/m2,比常规剂量大20倍以上为HD-MTX。HD-MTX静脉滴注维持在4~24 h,滴注结束时MTX血清峰浓度至少达到100µmol/L。值得注意的是,即使应用20 mg/kg或500 mg/m2对于患者也是致死性剂量,必须使用合适剂量的CF进行解救。
HD-MTX的基本原理为利用长时间连续滴注高浓度的MTX,使血液中MTX峰浓度达到100~1000µmol/L以上,血液中高浓度的MTX进入肿瘤组织后,顺浓度梯度被动扩散穿透肿瘤细胞膜进入细胞内,使细胞内MTX浓度提高数倍或数十倍,从而克服肿瘤细胞对MTX的耐药性,达到治疗的目的。
1.2 CF解救的必要性和机理
HD-MTX的抗肿瘤疗效明显高于常规剂量(≤500 mg/m2),但同时毒性更大,以神经毒性表现最为突出[1-5]。MTX的毒性大小与高浓度药物在血中持续时间长短呈正相关,即时间愈长,毒性愈大。此外,MTX治疗疗效指数低,个体化差异大[6]。因此,必须有严格的水化、碱化、CF解救、MTX血清浓度监测及不良反应处理等一系列措施,其中CF解救是保证患者生命安全的最主要措施。使用CF能解救致死剂量MTX作用下的正常组织细胞,减少MTX对正常细胞的杀伤作用,降低发生严重骨髓抑制、肝、肾和神经毒性,最重要的是正确掌握应用CF解救的时间和剂量,由此才能安全地应用HD-MTX治疗。
CF为四氢叶酸的类似物,其进入体内后会转变为有活性的亚甲基四氢叶酸和N10-甲烯四氢叶酸。因此,外源性给予CF,可以越过MTX所阻断的二氢叶酸还原为四氢叶酸的生化环节,使正常的DNA及蛋白质生化反应继续进行,从而起到解救细胞的作用。肿瘤细胞与正常细胞中DHFR对MTX的亲和度相近,被CF解救的效果取决于两者间的增殖比率、DHFR的水平及合成速度、细胞对CF的转运效率等。由于正常细胞利用外源性CF的能力远超肿瘤细胞,救援所需的CF浓度水平足以满足正常细胞的需求。此外,救援后正常细胞DNA合成的恢复能力也比肿瘤细胞快,故不会出现肿瘤救援。
2 HD-MTX-CFR的药物剂量、输注方法及其水化、碱化
2.1 MTX的药物剂量和剂量强度的关系
20世纪70年代治疗骨肉瘤使用的HD-MTX剂量是从50~500 mg/kg开始,经过国内外众多学者40余年的探索和大量循证医学资料分析,充分考量疗效与安全性后,现在基本明确合适的骨肉瘤治疗剂量应在8~12 g/m2范围[7],输注时间4~6 h为宜,期望峰值血药浓度Cmax超过700~1 000µmol/L,药时曲线下面积(area under concentration-time curve,AUC)可以达到4 000~7 000µmol/(L×h)。Cmax和AUC显示良好的线性相关。Cmax与组织治疗反应率和肿瘤治疗的缓解率有关,AUC则多与药物不良反应密切相关。合理的Cmax(700~1 000µmol/L)和AUC[4 000~7 000µmol/(L×h)]提示更高的组织有效率,并且临床严重不良反应发生率低;而高于12 000µmol/(L×h)的AUC显著提高了严重毒性反应的发生,且这类毒性反应与Cmax无关。
2.2 MTX剂量及联合用药推荐
目前,骨肉瘤治疗中MTX应用12~18 h后用CF解救可取得较好的疗效且不良反应可耐受,已经被国内外同行普遍接受。不同的是在Rosen T系列方案和COSS系列方案中,HD-MTX均有数次间隔1周的连续用药,在IOR-OS系列方案和TIOS系列方案中,HD-MTX不连续使用。相同的是方案内HD-MTX在顺铂前使用[8-11]或阿霉素联合顺铂方案3周后使用[12]。由于上述方案均在骨肉瘤治疗中有较好的疗效,但未进行“头对头”比较,建议根据患者的实际情况选用。
淋巴系统肿瘤对MTX较骨肉瘤敏感,HD-MTX为ALL和非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)治疗方案中不可缺少的组成部分,剂量范围是1~8 g/m2。MTX总量的1/10在30 min内静脉滴注,以期达到MTX血清峰浓度,其余9/10在23.5 h内滴注,保持MTX血清稳态浓度。低危NHL推荐MTX 1 g/m2,静脉滴注,MTX总量在6 h内滴完即可。
2.3 HD-MTX-CFR输注方法与水化、碱化
HD-MTX-CFR方案对尿量和尿液pH值均有严格要求。对于成人而言,MTX输注期间要求液体平衡,即要求尿量每日至少达2 000~3 000 mL/m2,尿量每日<2 000 mL/m2会明显减少MTX排泄[13]。常规要求尿液为碱性,pH值7~8,也有推荐pH值7.5~8.0[13-14]。鉴于此,通过水化达到合适的尿量和尿液pH值建议为水化液体总量推荐每日2 500~3 500 mL/m2,至少于MTX静滴前12 h开始水化,并持续至MTX静滴结束后24~48 h。碱化尿液建议使用碳酸氢钠注射液,常规剂量是每升水化液体中含5%碳酸氢钠注射液65~80 mL[14]。尿液pH测量可采用pH试纸,也可采用尿常规监测,后者比前者准确但前者简便易行。若尿液pH下降至6.5,推荐每日额外加入5%碳酸氢钠注射液20 mL/m2;若下降至6,则推荐每日额外加入5%碳酸氢钠注射液40 mL/m2[15]。需持续监测尿液pH值,直至其上升至7~8。在碱中毒患者或已经发生肾脏功能损害的患者中,建议使用乙酰唑胺直接增加肾脏排碱,常用剂量为250~500 mg口服,4 次/d[16]。
3 MTX的血清药物浓度监测及常规CF解救
3.1 常用MTX血药浓度测定法的原理
各种分析测试方法的优缺点汇总,见表1。

表1 MTX血药浓度测定方法优劣比较
3.2 各监测点药物浓度值的临床意义及常规CF解救方案
3.2.1 各监测点药物浓度值的临床意义 血药峰浓度即MTX静脉滴注即将结束时的浓度,被认为与治疗效果有关。在成人ALL的治疗中,研究认为血药峰浓度>48µmol/L才能发挥最佳的抗肿瘤效果[17]。在骨肉瘤治疗中有研究表明[18],MTX峰浓度超过700µmol/L的患者拥有更好的组织学反应和更高的5年生存率。但药物峰值浓度若达到1 500µmol/L以上,因为会导致严重的血液毒性和肝、肾毒性,不仅明显提高了用药风险,也使得后续治疗的依从性下降,单位时间内药物使用不足,从而对预后产生不良影响。
MTX血药浓度的监测时间点可以根据需要有所不同,建议至少必须每日监测1次,直至MTX血药浓度达到安全范围。目前,接受HD-MTX的患者监测MTX血药浓度有2种模式:1)MTX滴注开始后、24、48、72 h各监测1次,对于24 h持续静滴方案的患者,首次MTX血药浓度可以开始于36 h;2)MTX滴注结束后监测第1次,以后12、24、48、72 h各监测1次,这种模式多用于骨肉瘤化疗。MTX静脉滴注结束24、48、72 h后的血药浓度主要与安全性和不良反应相关,可以指导相应的支持治疗和CF解救方案。
3.2.2 常规CF解救方案 尽管首次CF解救的时间因不同瘤种和使用剂量的不同而有所差异,但必须在开始MTX滴注后24~42 h内或滴注结束后6~18 h进行首次解救。大部分的HD-MTX-CFR化疗方案推荐的CF剂量为12~15 mg/m2,6 h/次,共10~12次,CF用药途径建议选择静脉滴注或肌肉注射,无明显消化道反应患者也可以选择口服[19],但其疗效没有肌肉注射可靠。对于MTX清除能力正常的患者,每次CF解救剂量达到10~15 mg/m2时已经完全能够满足解救需求。但对于肾功能不全患者,则需要适当提高CF的每次解救剂量来保证患者的安全。
3.3 根据各监测点血药浓度的个体化解救方案
3.3.1 MTX排泄延缓的处理 清除能力下降可导致MTX排出减少,血药浓度下降缓慢,完全清除时间可延迟至2~3周。MTX导致肾毒性和清除延迟的危险因素:尿液pH<7.0、每日水化液体量<3 L/m2、高体质指数(body mass index,BMI)、合并使用可能导致肾毒性的药物或可能延长MTX代谢的药物、同时存在肝肾功能不全,以及存在胸、腹腔积液等。若临床发现MTX排泄延缓,可以通过充分水化、碱化尿液,增加CF解救的剂量和频率进行处理。
3.3.2 CF解救的剂量和时间 根据CF的半衰期(约4~6 h),缩短CF给药间隔至每3~4 h,相比每6 h给药,虽然血浆CF浓度升高,但未见明显临床获益[20]。因此,提高CF解救效率的方法通常为每次增加解救的给药剂量。另外,CF解救可能存在有“过度解救”的担忧,虽然CF解救主要针对正常细胞而非肿瘤细胞,但较高剂量的CF有可能影响抗肿瘤疗效,一项445例ALL患儿的治疗数据显示[21],将解救的CF剂量翻倍可导致肿瘤复发风险提高22%(95%CI:1%~49%,P=0.037)。对于出现MTX延迟排泄或超高MTX血药浓度的情况下,建议根据个体化血药浓度指导CF解救用量和频次,可以根据MTX时间血药浓度-CF解救量列线图来确定CF用量和频次(图1)[22]。建议使用静脉滴注或者肌肉注射的给药方式,避免口服。解救的终点同样为血浆MTX浓度到达临床安全浓度值以下,即<0.1 µmol/L[14]。
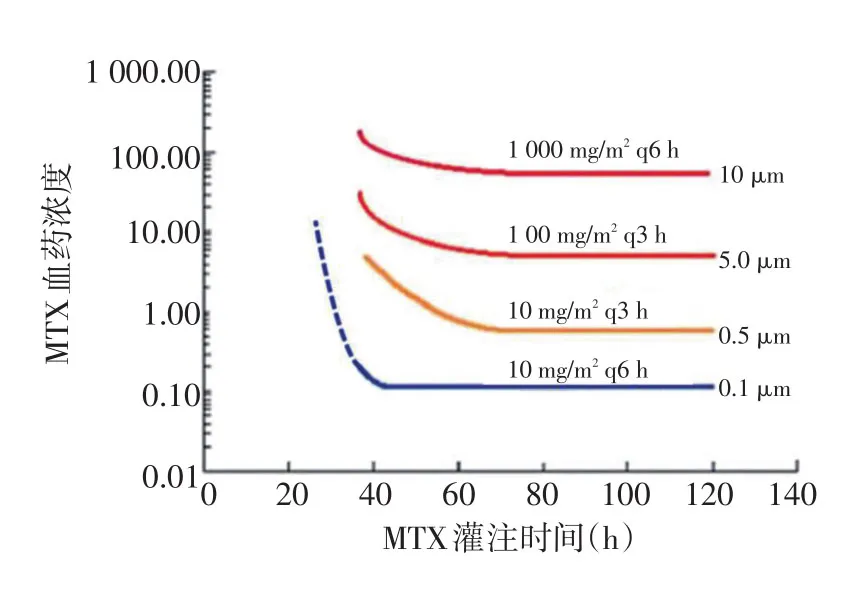
图1 以血药浓度为指导的HD-MTX用药后CF解救[22]
4 HD-MTX-CFR剂量调整原则
如合理应用HD-MTX-CFR系统,除个别患者的药物不良反应为特发性以外,对于绝大多数患者而言,MTX的不良反应为可防治的。分析发现,HD-MTX-CFR的严重不良反应主要与下列因素有关[23]。
4.1 年龄因素
高龄患者出现MTX代谢延迟的几率(11%)明显高于年轻患者(3%),由此导致的不良反应发生率和严重程度均显著升高,年龄50~60岁患者并非常规使用HD-MTX,不建议年龄≥60岁患者使用HD-MTX。
4.2 疾病相关的因素
建议临床谨慎使用的患者[24]:合并肾病综合征,肝硬化,阻塞性黄疸、急、慢性肾病;有效循环血量减少的患者,如近端肾小管毒素增加、重吸收、远端肾小管尿流速缓慢致肾小球滤过率(glomerular filtration rate,GFR)下降;代谢紊乱未能纠正的患者,如低钾、低镁血症、低钙血症、高钙血症;碱性或酸性尿pH值;细胞色素P450系统及转运蛋白基因的突变。
4.3 与治疗系统相关的因素
MTX剂量超过患者的承受或具体给药计划不正确;CF解救、水化、碱化等措施不及时或时间、剂量把握不准。
目前,尚无统一的剂量调整指南。部分血液病中心推荐按照GFR 100 mL/min的差值对MTX进行减量。
5 常见HD-MTX-CFR的不良反应防治及其护理措施
HD-MTX不良反应的时间、程度、恢复过程均有自身的特点,与其他化疗药物不同的是若处理不及时容易发生Ⅳ度不良反应,且恢复时间也较常用化疗药物慢,甚至出现死亡。
5.1 肝毒性的防治
HD-MTX的急性肝损伤通常在给药后1~3天出现,表现为谷丙转氨酶不同程度升高,发生率高达60%,停药后1~2周自行恢复。这种肝功能异常多数是单纯、一过性的转氨酶升高,停药后对症治疗短期内很快恢复。HD-MTX也可导致胆红素升高,发生率约25%[25]。对于必须使用HD-MTX治疗的患者,下一个周期需待转氨酶和胆红素均恢复正常后才能用药,同时应调整MTX的剂量,MTX可在肝脏中滞留数月,因此产生蓄积毒性,多次应用HD-MTX后可能出现不同程度的肝硬化。
化疗前必须评估患者肝肾功能,需注意患者是否有基础肝脏疾病,此类患者需要调整MTX剂量,必要时合并抗病毒治疗。
5.2 消化道毒性的防治
5.2.1 消化道黏膜炎 黏膜炎的发生通常在骨髓抑制之前,大多发生在HD-MTX给药后3~7天,在第14天左右恢复,世界卫生组织(WHO)分级Ⅲ度以下的黏膜炎发生率不超过10%。消化道黏膜炎往往是体内MTX血药浓度的直接反应,若MTX血药浓度超标,CF解救不及时,常会出现Ⅲ度及以上的全消化道黏膜溃疡,预示会出现严重的骨髓抑制。
5.2.2 恶心、呕吐的防治 恶心、呕吐最早发生在HD-MTX给药后2~4 h,可持续12 h或数天。随着二代5-HT受体拮抗剂和NK-1受体拮抗剂的应用,HD-MTX在输注后24 h出现迟发性恶心、呕吐的几率较低。值得注意的是,若患者出现明显的延迟性恶心、呕吐,应及时检测MTX的血液浓度,以防超标。
5.3 肾脏毒性的防治
80%以上MTX原型及其代谢产物由肾脏排泄。MTX可在肾脏中存留数周,产生蓄积毒性。在应用MTX同时或序贯滴注顺铂等肾毒性药物时可能加重肾脏损伤风险。
HD-MTX导致的肾功能不全在治疗开始时无临床症状,多数在常规检查肾功能时被发现肌酐缓慢升高,发生率约10%,通常发生在MTX给药后2~7天,大多数的急性肌酐升高通常是自限性,可在2~3周内恢复。即使在应用HD-MTX前充分水化、碱化,发生肾衰竭的概率仍有1.8%,在肾衰患者中死亡率约4.4%,原因为MTX清除延迟可导致更严重的血液毒性和消化道毒性。一旦发现肌酐缓慢升高,需要及时加强水化,同时增加CF解救的次数和剂量,密切监测血肌酐水平的变化。
一旦出现肾功能衰竭需要立即加大CF解救剂量并缩短CF解救时间。体外实验[26]显示,MTX浓度≥10µmol/L时可以用≥1 000µmol/L血浆浓度的CF解救,而MTX浓度≥100µmol/L时则需要更高浓度的CF解救。
5.3.1 血液透析 迅速降低MTX血药浓度的常用方法:腹膜透析、血液透析、血液滤过,常规血透和腹膜透析疗效欠佳,停止透析后MTX血药浓度仍会缓慢上升。目前,降低MTX血药浓度最有效的方法为高通血液透析,可以在4 h内降低76%MTX血药浓度。因此,要求对于高MTX血药浓度者尽可能早采取高通血透,随时监测MTX浓度,必要时反复多次直至达到安全范围。
5.3.2 药物治疗 胸腺嘧啶脱氧核苷补充能够帮助正常细胞恢复DNA合成。与CF不同的是胸腺嘧啶脱氧核苷无需与MTX竞争摄取。胸腺嘧啶脱氧核苷8 mg/m2/d剂量持续静脉滴注,可能对于除肾功能不全以外的HD-MTX导致的不良反应有一定的辅助治疗作用。
谷卡匹酶(glucarpidase,Voraxaze)是美国食品药品监督管理局(FDA)批准解救HD-MTX中毒的药物,为重组羧肽酶G2,能够迅速降低MTX血药浓度。其主要机制为代谢叶酸及其化学类似物,产生无活性代谢产物。在50µ/kg的单次负荷剂量5 h静推后,谷卡匹酶能够在最初的30 h内将MTX血药浓度降低98%。对于肾衰、MTX延迟代谢患者,应该早期给予谷卡匹酶。
5.4 血液学毒性的防治
在常规水化、碱化和CF解救下的HD-MTX血液学毒性并非常见。Ⅲ~Ⅳ度的血液学毒性常与严重的黏膜炎、肝、肾毒性并行,可能意味着解救延迟或血药浓度异常升高。临床表现为白细胞减低、贫血和血小板减低。白细胞减少的临床特征较其他化疗药物持续时间长,可能出现2个最低点。与其他化疗药物的血液毒性一样,绝大多数患者无需预防性应用粒细胞集落刺激因子(granulocyte colony stimulating factor,GCSF)、重组人血小板生成素(thrombopoietin,TPO)等细胞因子,仅在出现各系减低或有减低趋势时使用。
5.5 肺毒性的防治
与HD-MTX的其他不良反应不同,肺毒性发生率较低,通常进展迅速,目前尚无有效的预防措施,治疗亦无明确的特定药物,主要以积极对症治疗为主。
5.6 神经毒性的防治
HD-MTX相关的神经毒性发生率较低,临床症状类似急性或亚急性脑炎,表现为嗜睡、谵妄和癫痫发作,多出现在给药后24 h内,可自行完全缓解,不影响后续HD-MTX治疗。其远期毒性及对于生存质量的影响,主要研究集中在儿童和鞘注治疗的患者。
5.7 皮肤、口腔黏膜毒性的防治
5.7.1 皮肤毒性的防治 接受HD-MTX治疗的患者,约50%会有不同程度的皮肤反应,主要表现为荨麻疹、瘙痒、红斑、光过敏、脱发,甚至发生瘀斑和水疱等。约14%患者滴注时或滴注结束后出现一过性荨麻疹,多发生于输注时或输注结束后。如发生于输注时仅需停药,待荨麻疹消失后可以继续用药。
5.7.2 口腔黏膜毒性的防治 HD-MTX发生口腔黏膜炎和溃疡的频率高,需要保持口腔清洁。如发生Ⅲ度或Ⅳ度口腔溃疡,在常规护理基础上,给予口腔降温,可自制小冰块含化;局部用碘甘油和口腔溃疡贴膜涂敷患处,溃疡疼痛不能进食者,用2%利多卡因1支加入碱性漱口水中分次漱口,予以CF 100 mg加入生理盐水500 mL中每日含漱4~6次,每次3~5 min;使用重组人白介素-11,3 mg加入碱性漱口水中分次漱口,以促进口腔黏膜的修复。
6 HD-MTX-CFR的临床应用
6.1 儿童血液肿瘤
HD-MTX为小儿淋巴造血系统肿瘤化疗后预防中枢神经系统白血病、防止髓外复发的首选药物,其抗肿瘤作用强度除与肿瘤对MTX的敏感程度相关,还与用药后所达到的高血药浓度以及有效浓度持续时间有关。HD-MTX治疗的最佳剂量和输注时间取决于不同的治疗方案。
6.1.1 ALL 目前,ALL的完全缓解率提升至90%以上,5年持续缓解率达70%~80%以上,最重要原因之一在于化疗方案的改进。MTX的剂量适用范围为0.02~8.00 g/m2。由于T细胞急性淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)细胞聚集甲氨蝶呤多聚谷氨酸盐的能力低于B细胞急性淋巴细胞白血病(B-cell acute lymphoblastic leukemia,B-ALL)细胞。因此,对于T-ALL需要使用更大剂量的MTX每次5 g/m2,而对于B-ALL每次2.5 g/m2即可。在ALL的治疗中,诱导缓解治疗后,在早期强化基础上应用HD-MTX-CFR,可有效通过血脑屏障及血-睾屏障杀灭中枢隐蔽白血病细胞。对于绝大多数ALL患者,目前HD-MTX-CFR作为中枢预防主要治疗方法,联合足量的鞘注可取代全中枢预防性放射治疗。
6.1.2 恶性淋巴瘤 HD-MTX-CFR作为中枢预防主要治疗方法,联合鞘内化疗可取代全中枢神经系统预防性放射治疗,同时也可用于中枢和睾丸转移患者。儿童NHL采用HD-MTX的常用方案为儿童淋巴母细胞性淋巴瘤患者巩固治疗中采用的HD-MTX 5 g/m2。Burkitt淋巴瘤、弥漫大B细胞淋巴瘤、成熟B细胞性ALL、间变大细胞性淋巴瘤和外周T细胞性淋巴瘤患者采用3~8 g/m2。低危患者HD-MTX 1 g/m2,4~6 h静脉滴注,中高危患者HD-MTX 3~8 g/m2,4~24 h静脉滴注。
6.1.3 髓母细胞瘤 儿童高危髓母细胞瘤可采用HD-MTX作为术后预防复发治疗方法之一[27]。
6.2 成人血液肿瘤
HD-MTX(1~8 g/m2)为ALL和NHL治疗方案中不可缺少的组成部分。
6.2.1 ALL HD-MTX-CFR是成人ALL缓解后巩固治疗方案之一,与阿糖胞苷、左旋门冬酰胺酶等方案交替进行,共2~4个疗程,主要参考患儿ALL方案的设计。HD-MTX方案:B-ALL MTX推荐剂量1.0~3.0 g/m2,TALL可以用至5 g/m2。治疗方法推荐1/3剂量静脉滴注1 h,之后2/3剂量静脉滴注23 h。应用HD-MTX-CFR时应进行血清MTX浓度监测。CF解救开始时间在MTX输注开始后36 h,CF剂量25~50 mg/m2,q6 h,至血清MTX浓度0.1µmol/L,或低于0.25µmol/L时结合临床情况可停止解救或延长解救。
6.2.2 原发中枢神经系统淋巴瘤 HD-MTX由于可穿透血脑屏障,至今仍是PCNSL最为有效的单药,也是目前PCNSL联合化疗的基础药物[28]。药物剂量和输注速度为影响HD-MTX在脑实质和CSF中分布的2项重要因素[29]。文献报道HD-MTX治疗PCNSL的剂量范围为1~8 g/m2,≥1 g/m2和≥3 g/m2的HD-MTX分别可达到清除脑实质和脑脊液中肿瘤细胞的效果[30]。目前,在联合化疗中推荐的HD-MTX剂量为3.5 g/m2,该剂量患者的耐受性和有效性较好[31]。输注速度则推荐3~4 h快速输注。CF解救在HD-MTX开始输注24h后进行,首次剂量25~50mg,之后25 mg,q6 h,至MTX血清浓度低于0.1µmol/L。目前,对于PCNSL的初始治疗推荐以HD-MTX和利妥昔单抗为基础的联合化疗[32]。可联合的化疗药物包括其他可透过血脑屏障的静脉化疗药物及口服烷化剂,如阿糖胞苷、噻替哌、替莫唑胺和甲基苄肼等。
6.2.3 NK/T细胞淋巴瘤 SMILE方案为治疗NK/T细胞淋巴瘤首选方案之一,包括地塞米松、MTX、异环磷酰胺、左旋门冬酰胺酶和依托泊苷。MTX剂量2 g/m2,在1 000 mL生理盐水中连续静脉输注6 h,第1天使用。CF在MTX结束后12 h开始解救,30 mg,q3 h×5次,之后30 mg,q6 h至MTX浓度低于0.1µmol/L。其他化疗药物在第2~4天使用。
6.2.4 高侵袭性淋巴瘤 高侵袭淋巴瘤包括T淋巴母细胞淋巴瘤、Burkitt淋巴瘤、套细胞淋巴瘤等。Hyper-CVAD+M/A方案为治疗高侵袭淋巴瘤首选方案之一,其方案为HD-MTX-CFR联合大剂量阿糖胞苷。MTX剂量1 000 mg/m2,第1天使用。首先MTX 200 mg/m2静脉输注2 h,之后800 mg/m2静脉输注22 h,MTX输注结束24 h后进行CF解救,剂量为15 mg/m2,q6h,直至血MTX浓度低于0.1µmol/L。阿糖胞苷3g/m2,q12 h,共4次,d2~3。
6.3 骨肉瘤
HD-MTX-CFR为目前骨肉瘤治疗用药之一。近30年来,骨肉瘤的5年无病生存率由20%~30%提升至60%~70%,与术前及术后应用联合HD-MTX-CFR为主的方案密切相关。目前,HD-MTX主要化疗方案为IOR/0S-2、COSS80和IOR/0S-N5方案等。
专家共识委员会
共识专家组成员(按姓氏拼音排序)
郭 澄 上海交通大学附属第六人民医院
黄 纲 中山大学附属第一医院
林 峰 上海市第八人民医院
吕 跃 中山大学肿瘤防治中心
马 军 哈尔滨血液病肿瘤研究所
孙晓非 中山大学肿瘤防治中心
王 椿 上海市第一人民医院
王 琼 上海交通大学附属第六人民医院
王 臻 空军军医大学西京医院
吴敏媛 首都医科大学附属北京儿童医院
吴苏稼 中国人民解放军东部战区总医院
姚 阳 上海交通大学附属第六人民医院
张伟滨 上海交通大学附属瑞金医院
郑水儿 上海交通大学附属第六人民医院
朱 军 北京大学肿瘤医院
