胃肠道恶性肿瘤化疗患者早期肠内营养干预的临床研究
2019-11-14姚望张鑫杰姚庆华
姚望 张鑫杰 姚庆华
胃肠道恶性肿瘤较为常见,在中国其发病率和死亡率均呈上升趋势。目前,肿瘤的治疗方法主要为手术、放化疗、靶向治疗等。在治疗的同时,会产生相应的不良反应,甚至导致抗肿瘤治疗的终止。肠道黏膜屏障具有吸收营养物质和调节免疫的作用,同时能够限制潜在的有害抗原和微生物的入侵[1]。5-氟尿嘧啶(5-fluorouracil,5-FU)可通过抑制胸腺嘧啶核苷酸合成酶而达到抑制DNA的合成作用,通过阻止尿嘧啶和乳清酸深入RNA,从而抑制RNA合成,导致胃肠道上皮细胞代谢障碍及肠黏膜损伤[2]。在临床上,肠道黏膜屏障功能受损的患者主要表现为消化道不良反应,如腹泻、腹痛、恶心呕吐和黏液脓血便等。肠道菌群在参与营养物质的消化吸收、促进胃肠道的发育和成熟方面具有重要作用[3],肠道受到化疗的不良影响后,容易产生肠道微生态失衡及菌群紊乱,进而诱发临床不良反应。相关研究证实营养支持治疗能够维护肠道黏膜功能,尤其是肠内营养具有改善机体组织器官、细胞功能及代谢,并且改善肠道免疫的功能[4]。由于营养状况不良及免疫功能低下,肿瘤患者发生感染的风险增加,肿瘤复发转移的风险增大。有研究发现,肠内营养能够改善患者术后免疫功能,并可调节炎症反应,减少胃肠道恶性肿瘤患者术后并发症[5]。机体的营养状况、免疫功能、肠道屏障功能及肠道菌群之间具有紧密的联系,相互影响并相互作用。为此,本研究通过观察术后辅助化疗的胃肠道恶性肿瘤患者,探讨肠内营养对患者不良反应、营养状况、免疫功能、肠道屏障功能和肠道菌群的影响。
1 材料与方法
1.1 病例资料
选取2018年3月至2018年11月在浙江省肿瘤医院行化疗的46例胃肠道恶性肿瘤患者,其中男性25例,女性21例;年龄47~65岁,平均年龄(53.7~7.9)岁;体质量指数20.0~23.9 kg/m2,平均体质量指数(21.8~1.6)kg/m2;Ⅱ期19例(ⅡB 9例和ⅡC 10例),Ⅲ期27例(ⅢA 3例、ⅢB 12例和ⅢC 12例)。按照所有患者入院时就诊号码尾号的奇偶数随机分为对照组及试验组,每组患者23例,对照组中胃恶性肿瘤患者12例,大肠恶性肿瘤患者11例,试验组中分别为10例和13例。所有患者均签署知情同意书,本研究经浙江省肿瘤医院伦理委员会审批同意。
1.2 方法
1.2.1 筛选标准 纳入标准:1)经细胞学或病理学及影像学诊断确诊的Ⅱ~Ⅲ期经手术治疗的胃肠道恶性肿瘤患者;2)既往未行化疗,需应用含5-FU类(口服)辅助化疗,能顺利完成辅助化疗方案疗程的Ⅱ、Ⅲ期胃肠道恶性肿瘤患者;3)年龄18~70岁,世界卫生组织(WHO)功能状态评分(performance status,PS)0~1分;4)经住院患者营养风险筛查评估表(nutrition risk screening,NRS2002)筛查存在营养风险的患者,且主观整体营养状况评量表(patient-generated subjective global assessment,PG-SGA)≤ 8分;5)神志清楚,能够进行语言交流的患者;6)符合肠内营养的适应证;7)化疗前1周未使用肠内营养增强剂者;8)肝肾功能无明显异常。排除标准:1)精神疾病、神志不清或无法语言交流的患者;2)有严重的肝、肾、心脑等脏器器质性或功能性病变;3)妊娠及哺乳期妇女;4)近3个月有明确其他肠道疾病患者;5)对试验方案明显地不依从。脱落标准:1)患者辅助化疗疗程未结束而转院治疗或死亡;2)患者因严重的骨髓抑制、肠梗阻等原因而终止化疗。
1.2.2 治疗方法 两组患者均采用含5-FU的方案化疗:结直肠癌患者予以XELOX方案(d1:奥沙利铂130 mg/m2,静脉点滴;d1~14:卡培他滨850~1000mg/m2,口服,2次/d,每3周重复1次),胃癌患者予以SOX方案(d1:奥沙利铂130 mg/m2,静脉点滴;d1~14:替吉奥胶囊60 mg/m2,口服,2次/d,每3周重复1次),所有患者化疗周期均为21d。试验组患者在化疗第1个周期开始时予以营养支持治疗。给予肠内营养制剂200 mL/次,2次/d,行口服营养补充,保证化疗疗程结束前肠内营养服用时间不少于3个月。对照组患者予以模拟肠内营养制剂为安慰剂,由淀粉、羧甲基纤维素钠和香精等组成,其外形、口味、质地、包装均与瑞能乳液相似。给药剂量和方式与试验组一致,但无药理作用,由浙江省肿瘤医院药剂科制备并提供。此外,两组患者均予以常规预防性止呕止吐治疗,并给予充分的饮食指导。
1.2.3 观察指标 1)临床不良反应:化疗期间,每日观察并记录所有患者出现的腹泻、恶心呕吐、便秘、食欲不振、腹胀和腹痛等临床不良反应;2)营养状况评价:每个周期化疗当天检测两组患者外周血的白蛋白(albumin,ALB)、前清蛋白(prealbumin,PA)和转铁蛋白(transferrin,TF);3)免疫状态:每个周期化疗当天检测两组患者外周血的CD3+细胞、CD4+细胞及CD4+/CD8+比值;4)肠道屏障功能:每个周期化疗当日检测两组患者D-乳酸、二胺氧化酶和内毒素指标;5)肠道菌群:每个周期化疗当日收集所有患者的新鲜大便1.0 g,稀释后接种于乳酸杆菌、双歧杆菌、大肠杆菌和肠球菌的选择性培养基平板上进行细菌培养,分析肠道各菌群数量。
1.2.4 随访 所有患者观察与随访时间为首次化疗实施开始至6个化疗疗程结束,随访期间无脱落病例。在住院期间对患者病例资料进行动态观察;每次化疗结束出院后进行电话随访,获取患者营养液使用情况、症状变化等信息。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。计量资料,如营养状况和免疫状态等数据采用单因素方差分析检验。计数资料,如性别比和临床症状等数据,采用χ2检验;组间两两比较采用t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般资料
两组患者性别、年龄、体重指数、肿瘤种类、分期和手术类型等一般资料比较,差异无统计学意义(P>0.05,表1)。
2.2 两组患者化疗期间的临床不良反应
46例患者进行的6次化疗疗程中,两组均发生不同程度的腹泻、恶心呕吐、便秘、食欲不振、腹胀和腹痛。全部化疗疗程结束后,与对照组相比,试验组的恶心呕吐及总的不良反应例数较少,差异具有统计学意义(P<0.05,表2)。
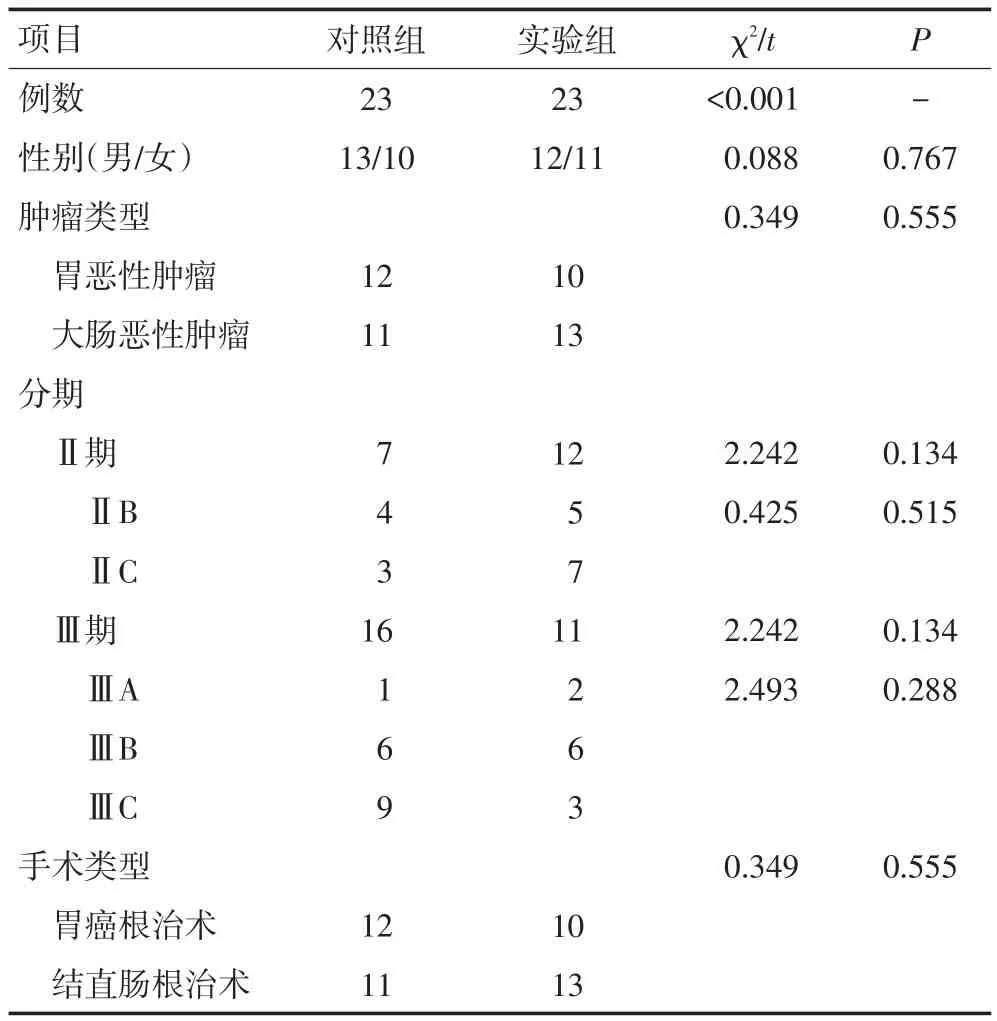
表1 46例胃肠道恶性肿瘤患者一般资料比较 例
2.3 两组患者化疗期间营养状态指标变化
两组患者第1次化疗前营养指标差异无统计学意义(P>0.05)。随化疗次数增加,试验组中PA和TF呈上升趋势,对照组呈下降趋势。在第5、6次化疗时,试验组中PA和TF较对照组明显增加(P<0.05),且试验组中PA和TF与第1次化疗相比明显增加,试验组整体情况优于对照组(P<0.05,表3)。
2.4 两组患者化疗期间的T细胞变化
两组患者第1个疗程CD3+、CD4+和CD4+/CD8+差异均无统计学意义(P>0.05)。对照组患者在第2~6个疗程中CD3+、CD4+和CD4+/CD8+与第1个疗程相比差异均无统计学意义(P>0.05),随化疗次数增加,上述3项指标呈下降趋势。试验组患者在第5、6个疗程中,CD3+、CD4+和CD4+/CD8+与第1个疗程相比增加明显(P<0.05)。随化疗次数增加,试验组中3项指标呈上升趋势,与对照组相比,试验组第5、6个疗程的CD3+、CD4+和CD4+/CD8+增加明显,试验组整体情况优于对照组(P<0.05,表4)。
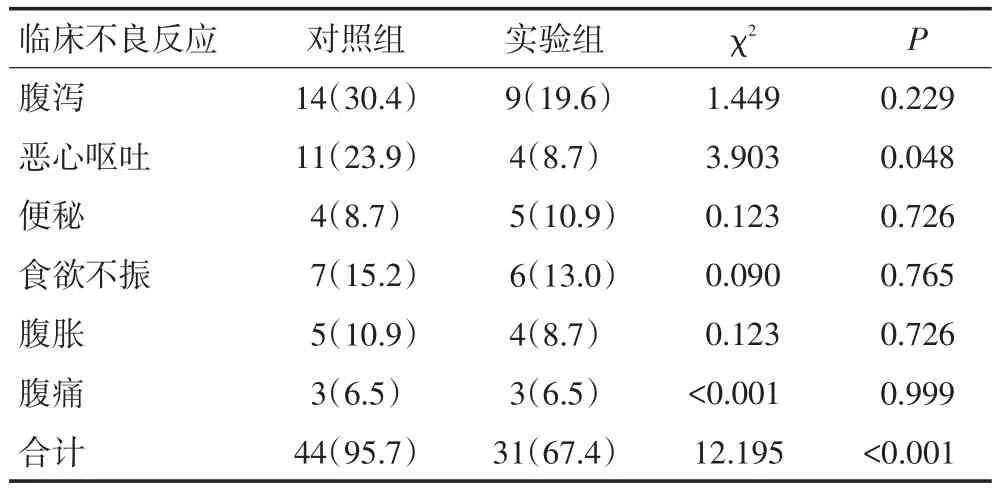
表2 两组患者化疗期间的临床不良反应 例(%)
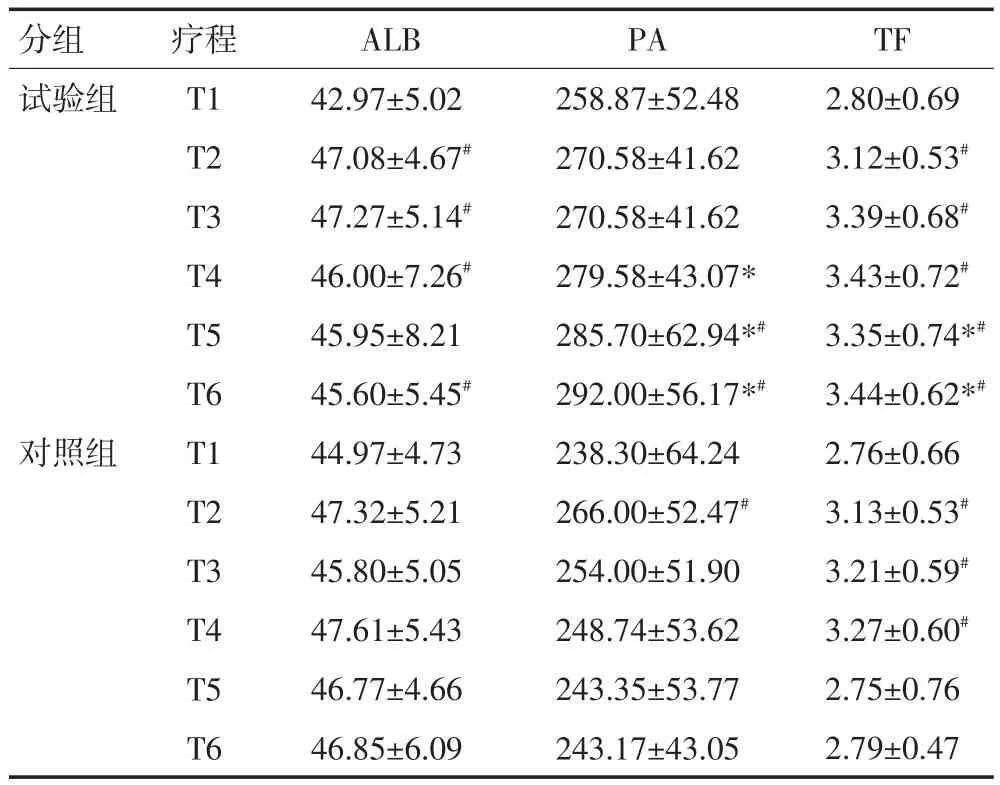
表3 两组患者化疗期间的营养状态指标 (g/L)
2.5 两组患者化疗期间的免疫球蛋白变化
两组患者第1个疗程IgG、IgA和C4比较差异无统计学意义(P>0.05)。两组患者第2~6个疗程中IgG和IgA与第1疗程相比差异均无统计学意义(P>0.05)。试验组中IgG在第6个疗程中较对照组增加明显(P<0.05),试验组中IgA和C4在第5、6个疗程中较对照组增加明显,试验组整体情况优于对照组(P<0.05,表5)。
2.6 两组患者化疗期间的肠道屏障功能变化
随化疗疗程增加,试验组和对照组中D-乳酸和二胺氧化酶与第1个疗程相比均呈上升趋势。在第4~6个疗程中,对照组的D-乳酸和二胺氧化酶的指标较试验组相比明显增高,试验组整体情况优于对照组(P<0.05,表6)。
2.7 两组患者化疗期间的肠道菌群变化
随化疗疗程增加,对照组的乳酸杆菌和双歧杆菌与第1个疗程相比均呈下降趋势,大肠杆菌和肠球菌与第1个疗程相比均呈上升趋势。试验组的乳酸杆菌和双歧杆菌与第1个疗程相比均呈上升趋势,大肠杆菌和肠球菌与第1个疗程相比均呈下降趋势。在第3~6个疗程中,对照组的乳酸杆菌和双歧杆菌较试验组相比明显减少(P<0.05),肠杆菌和肠球菌较试验组相比明显增多,试验组整体情况优于对照组(P<0.05,表7)。
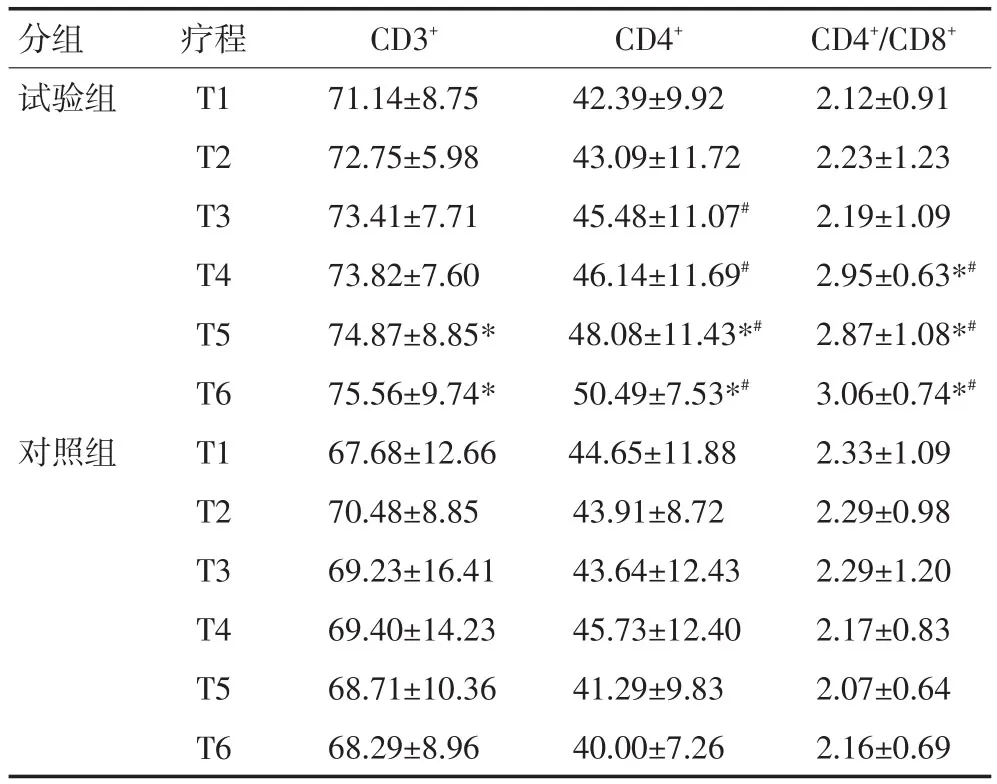
表4 两组患者化疗期间的T细胞变化 (%)

表5 两组患者化疗期间的免疫球蛋白变化 (g/L)
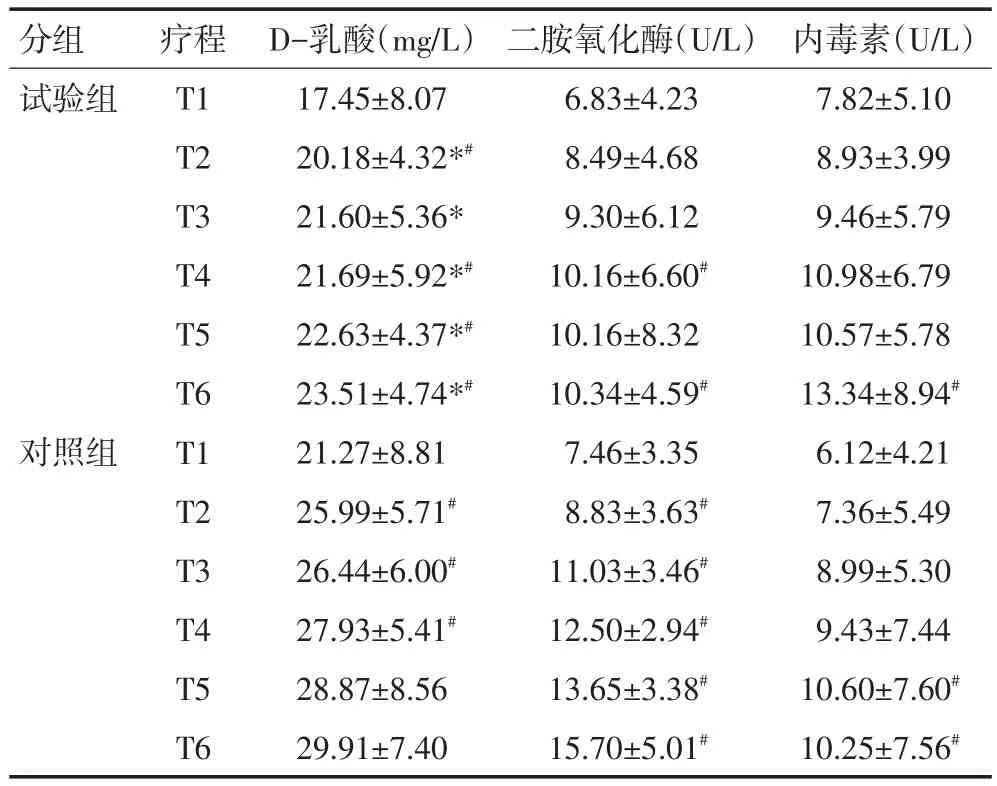
表6 两组患者化疗期间的肠道屏障变化
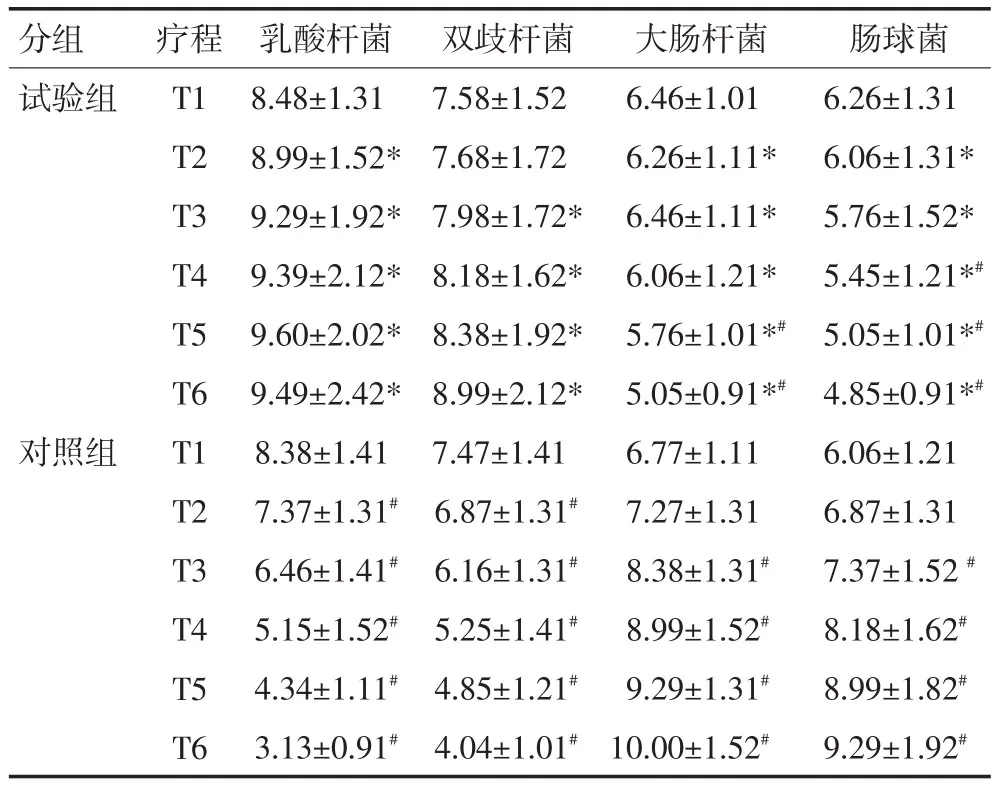
表7 两组患者化疗期间的肠道菌群变化 (log 10n /g)
3 讨论
5-FU化疗方案可对机体造成不同程度的损害,主要表现为骨髓抑制、消化道反应及心脏毒性等[6-8]。5-FU对于患者肠道屏障功能的损伤需关注,在相关研究中发现,5-FU可导致大鼠体重明显下降,使大鼠体内内毒素、血浆D-乳酸及二胺氟化酶水平显著升高,导致肠黏膜明显萎缩,绒毛排列混乱,部分绒毛断裂甚至脱落[2]。化疗可导致肠道免疫功能低下,营养物质吸收不足,肠内菌群紊乱,当损伤达到一定程度时,肠道内毒素、细菌即可穿越肠黏膜进入体循环及远隔器官,引发肠源性感染[9-10]。中国肿瘤患者营养风险和营养不良的发生率较高,患病率高达40%~80%,尤其是胃肠道恶性肿瘤[11]。本研究主要观察了接受含5-FU类术后辅助化疗方案患者的不良反应、营养状况、免疫功能、肠道屏障功能和肠道菌群的变化,并探索肠内营养制剂早期干预对于机体的作用。
患者的肿瘤营养全程管理至关重要,合理的营养支持治疗可有效纠正患者营养不良的状态,预防相关并发症,提高抗肿瘤治疗的疗效,改善患者预后。NRS2002及PG-SGA是营养风险筛查及营养不良评估的重要工具[12]。本研究选取的46例患者均需行营养支持治疗,经过营养干预的患者整体上其不良反应、营养状况、免疫功能、肠道屏障功能和肠道菌群均优于未进行营养干预的患者。
从临床不良反应方面分析,未使用肠内营养制剂的对照组发生恶心呕吐及总的不良反应例数较使用肠内营养制剂的试验组更多。从结果来看,试验组的PA和TF指标随化疗疗程增加均呈上升趋势,表明肠内营养对内脏合成蛋白具有重要作用,相关的研究证实营养制剂中ω3、精氨酸和谷氨酰胺等此类特殊的营养素可以起到抑制机体炎症反应,有提高自身免疫力的作用[13-14]。化疗后患者常处于应激状态,肠道免疫力低下,功能紊乱,细菌产物如内毒素、鞭毛蛋白和细菌DNA能够进一步激活固有免疫系统,加强促炎蛋白的表达,从而导致合成免疫球蛋白和T细胞的能量物质不足[15]。本研究结果表明,随着化疗次数增加,对照组CD3+、CD4+和 CD4+/CD8+以及IgA呈下降趋势,而试验组中呈上升趋势,表明肠内营养在改善化疗患者免疫功能中发挥重要作用。二胺氧化酶及D-乳酸分别是反映肠黏膜损伤程度及肠壁通透性指标,当肠道黏膜损伤及通透性增高时,二胺氧化酶及D-乳酸发生异常。所有患者随化疗次数增加,二胺氧化酶和D-乳酸均呈上升趋势,但对照组中二胺氧化酶和D-乳酸上升更为明显,提示对照组患者的损伤程度更为严重。肠道菌群的失衡也进一步佐证了这一观点,在对照组中,随着化疗疗程的增加,以乳酸杆菌和双岐杆菌为代表的肠道有益菌群显著减少,以大肠杆菌和肠球菌为代表的有害菌显著增加,与对照组不同,试验组的乳酸杆菌和双歧杆菌明显增多,肠杆菌和肠球菌明显减少,从而可以看出肠内营养制剂对减轻肠道炎症反应,修护肠道黏膜屏障,改善菌群失调均具有重要的作用。
综上所述,对胃肠道恶性肿瘤患者进行早期肠内营养制剂干预有助于减轻化疗期间的不良反应,改善营养状况和肠屏障功能,调节菌群紊乱以及提高整体免疫功能。但本研究样本量较小且对于患者长期的生存质量及预后评估不足,有待进一步扩大样本量进行更为深入的研究。
