基于超支化聚乙烯亚胺的磁共振成像造影剂研究进展
2019-11-13朱静怡施健辉杨军星盛慧张林珊管婧希黄和
朱静怡,施健辉,杨军星,盛慧,张林珊,管婧希,黄和
(南京工业大学药学院,江苏 南京 211800)
癌症作为人类难以治疗的疾病之一,其诊断与治疗已成为医学难题[1-2]。癌症的局部浸润性和远处转移性,使得疾病晚期的治疗难度加大,而癌症患者晚期的生存率和治疗费用又与癌症的确诊阶段密切相关。因此在这一系列的癌症诊疗过程中,癌症的早期诊断对于治疗非常关键[3-5]。
分子影像学作为一门新兴学科,是运用影像学手段展示组织、细胞及亚细胞水平分子的生理乃至生物学行为的科学研究方法[6-8]。常见的能用于分子影像学检查的手段包含:超声成像(ultrasonic imaging,US)、X射线断层成像(X-ray computed tomography imaging,CT)、磁共振成像术(magnetic resonance imaging,MRI)、正电子发射计算机断层显像(position emission tomography,PET)和单光子发射计算机断层显像(single photon emission computed tomography,SPECT)等[9-11]。其中MRI是运用射频波及磁场激发氢原子核共振,吸收及释放能量,通过获得电磁信号来产生体内器官及组织图片的一种成像手段[12-13]。由于其具有较高的成像分辨率、能够在分子结构上提供病变、解剖学等生理学信息且无放射性辐射等优点,被临床广泛使用[14]。目前临床上常用的MR成像造影剂主要有顺磁性、超顺磁性及铁磁性物质3大类,其中商业使用的主要为基于钆离子的顺磁性MRI造影剂,如马根维显、欧乃影等,由于其较小的相对分子质量致使其在体内具有较短的血液循环时间、无组织特异性,且其存在一定的肾毒性[15-16]。随着纳米技术的发展,可将众多MRI元素与纳米材料相结合,可改善传统临床MRI造影剂的诸多缺点。在诸多的纳米材料中,超支化聚合物由于良好的理化性质可作为构建MRI造影剂的优选载体。其中,超支化聚乙烯亚胺(hyperbranched polyethyleneimine,PEI)由于价格低廉、具有独特的结构及性质,被广泛用作各种无机杂化纳米颗粒的稳定剂及载体[10,17-19]。
PEI是一种支链状的高分子聚合物,其制备较为简单。可采用单体法合成得到,即通过氮丙环自身在酸性条件下与另一分子氮丙环开环聚合,按照这种开环聚合方法多次重复与氮丙环反应即得到PEI[20],如图1所示。PEI由于含有较多分支结构,这种结构使其形成类似球状分子,支化分配的状态使其内部形成了疏水性的空腔,可用于包裹、络合金属纳米颗粒及稳定无机金属氧化物等[21-23]。与此同时,其分支结构中含有多个二级胺结构,其氮原子可有效络合金属离子从而实现配位稳定的作用。其支链端位丰富的氨基,保证了构建的纳米材料的可修饰性,赋予其诸多的生物医学功能。因此,PEI基于其优良结构,在分子医学影像等方面应用广泛[17-19]。
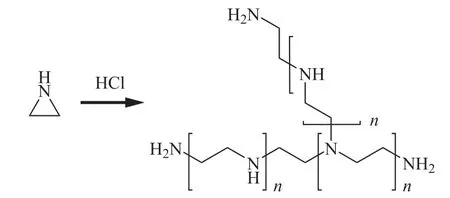
图1 PEI合成示意图Figure 1 Schematic diagram of the synthesis of PEI
MRI常用的纳米造影剂按功能分类可分为2种,包括阳性(T1)成像造影剂和阴性(T2)成像造影剂。T1MRI造影剂主要有钆离子[17-18]、四氧化三锰(Mn3O4)纳米颗粒[19];T2MRI造影剂主要有超顺磁性氧化铁纳米颗粒[24]。这些常见的MRI造影剂存在水溶性较差、肾毒性高、无肿瘤特异性等缺点[25],因此需要一个优良的纳米平台作为载体,提高其生物相容性、水溶性、增加在肿瘤处纳米造影剂的富集量,以实现材料介导的精准MRI。PEI恰能弥补该缺陷,如今已有多种PEI的MRI造影剂被开发利用,且其具有较高的弛豫率,可实现优异的MRI。基于PEI的MRI造影剂类型分为T1MRI造影剂、T2MRI造影剂和两者兼具的T1/T2双模态MRI造影剂。因此,本综述针对近年来PEI的各类MRI造影剂的构建及其应用进行归纳总结,为开发新型MRI造影剂提供参考。
1 基于超支化聚乙烯亚胺的T1 MRI造影剂
基于PEI良好的理化性质及结构特点,其可用于络合金属离子及稳定金属氧化物,因此构建的基于PEI的T1MRI造影剂的代表主要是钆[18]和锰的氧化物[19],钆、锰元素的顺磁性,可使水分子的交换速率改变,导致T1弛豫时间缩短,最终表现为T1加权成像信号增强[19,26]。
1.1 基于超支化聚乙烯亚胺的钆造影剂
由于钆造影剂属于T1MRI造影剂,在检查中能够得到高分辨率影像,三价钆离子(Gd3+)具有8个配位点,能够形成多种配合物,且螯合效率较高。因此以钆离子为成像元素构建的基于PEI的钆造影剂在研究及临床上具有较好的应用。
Zhou等[17]利用聚乙二醇(PEG)修饰的PEI连接钆离子螯合剂 2,2′,2′′-(10-(2-(2,5-二氧代吡咯烷-1-氧基)-2-氧乙基)-1,4,7,10-四氮杂环十二烷-1,4,7-三)三乙酸(DOTA-NHS),并以此为模板包裹纳米金颗粒,载入钆离子,最终将PEI表面剩余氨基完全酰基化,构建用于MR/CT成像的双模态造影剂,即钆载入的功能化PEI包裹金纳米颗粒(Gd@Au PENP)。研究表明构建的该纳米造影剂具有较低的毒性,生物相容性、水溶性、胶体稳定性良好,具有较高的弛豫率(r1= 0.89 mM-1·s-1),且作为高效造影剂展现出良好的动物血池和器官MRI效果。如图2所示,在给小鼠注射Gd@Au PENP后,箭头所指的主动脉和下腔静脉明显变亮,且能在体内维持至少3 h以上的MRI增强效果,体现其良好的血池T1MRI效果。Zhou等[18]后期在此基础上构建了靶向表达叶酸(FA)受体肿瘤的MR造影剂FA-Gd-Au PENPs,将FA通过PEG为桥梁连接在PEI表面。研究表明构建的FA-Gd-Au PENP造影剂具有更高的弛豫率(r1=1.1 mM-1·s-1),且能与FA受体高表达的肿瘤特异性结合以实现靶向肿瘤MRI的功能,相对于Gd-Au PENP,FA-Gd-Au PENP在肿瘤部位的MRI信号更高,对肿瘤细胞表现出良好的靶向性,通过在肿瘤部位较高的材料富集以实现材料介导的高效MRI特性。
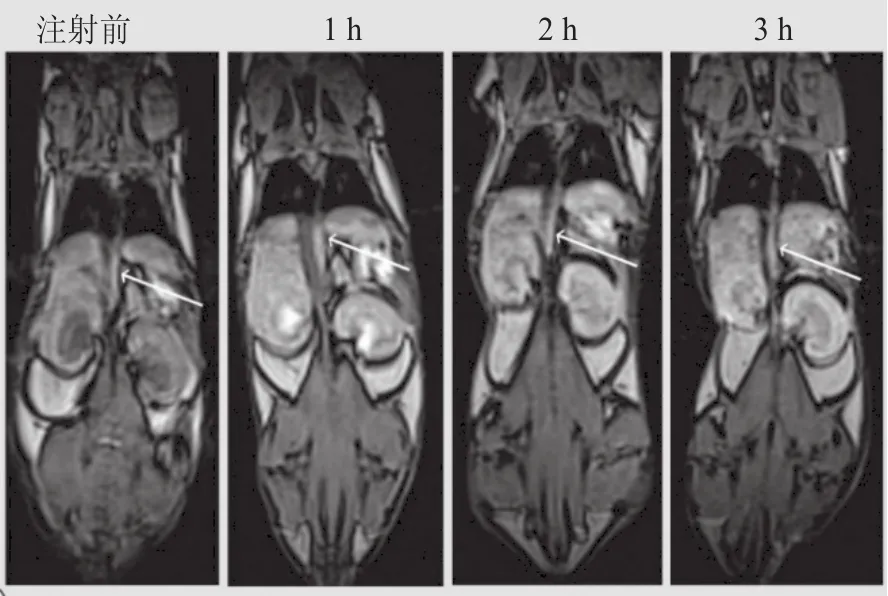
图2 小鼠接受Gd@Au PENP注射后其主动脉T1 MRI图[17]Figure 2 T1-weighted MRI maps of the mouse’s aorta after injection of the Gd@Au PENP[17]
除此之外,氧化钆(Gd2O3)也作为良好的T1成像物质被用来构建多种MRI造影剂[27-28]。Xu等[29]首先将氯化钆(GdCl3)溶解于乙二醇中,以过氧化氢作为氧化剂进行氧化并搅拌,形成纳米混合物后沉淀一周,获得氧化钆纳米颗粒。然后再用1-(3-二甲氨基丙基)-3-乙基-碳二亚胺盐酸盐/N-羟基琥珀酰亚胺(EDC/NHS)偶联反应将荧光素修饰在PEI表面,制备得到高水溶性的荧光素-PEI,最终将纳米氧化钆颗粒加入上述荧光素-PEI溶液中,通过氧化钆纳米颗粒与PEI表面剩余氨基的配位螯合得到PEI包覆的氧化钆纳米粒子,构建具有荧光标记功能的T1MRI造影剂,其具有良好的弛豫率(r1= 6.76 mM-1·s-1,r2= 20.27 mM-1·s-1)。 该 造 影 剂 在 PEI 的包覆下提高了生物相容性,在体内能够实现优异的MRI功能。通过建立肝肿瘤模型发现,构建的该纳米造影剂在肝肿瘤处具有明显的T1增强信号,该纳米造影剂在肝肿瘤处的积累量明显高于正常肝组织,究其原因,在于其能被网状内皮系统细胞主动吞噬,因此体现肝肿瘤的T1成像信号增强效应。
目前构建的基于PEI的钆造影剂在PEI的存在下明显提升了钆造影剂的水溶性、稳定性及生物相容性,可在动物体内实现良好的T1MRI效果。但由于PEI自身结构特点,可进行多种金属纳米颗粒及金属氧化物的包裹,易影响钆元素与水分子的交换速率,从而改变T1弛豫时间,时常会减小钆元素弛豫率进而影响MRI效果,因此基于PEI的钆造影剂由于表面修饰基团及内部包裹或稳定金属纳米颗粒的不同会造成弛豫率的差异,且影响情况不可控。因此,构建基于PEI的钆造影剂,优化其结构与功能使其具有较高的弛豫率,在这方面仍需改进,这也为以后构建基于PEI的钆造影剂提供了思路。
1.2 基于超支化聚乙烯亚胺的锰氧化物造影剂
由于锰元素也具有一定的顺磁性,能改变水分子的交换速率从而缩短组织脏器的T1弛豫时间,因此被作为T1MRI造影剂,在生物医学领域被广泛使用。目前能呈现较好T1MRI效果的锰基造影剂主要为锰氧化物,主要种类有氧化锰(MnO)、二氧化锰(MnO2)、Mn3O4等[30-32]。由于锰氧化物造影剂单独作用时稳定性和体内生物相容性较差、易沉淀,具有一定的毒副作用,因此将其与PEI结合构建基于PEI的锰氧化物造影剂,可明显改善其性能,可增强锰氧化物的水溶性及生物相容性,使其能在体内实现良好的MRI效果。
Luo等[33]构建了PEI稳定的Mn3O4纳米颗粒,以PEI为稳定剂,运用水热合成法,以二甘醇作为还原剂和溶剂,乙酰丙酮锰作为锰源,控制高温,在高压反应釜中通过一步法制备PEI稳定的Mn3O4纳米颗粒(Mn3O4-PEI NP)。随后,在Mn3O4-PEI NPs表面修饰异硫氰酸荧光素(FI)、功能分子PEG化的FA(PEG-FA),以及甲氧基封端的PEG(mPEG),最终将PEI表面剩余氨基乙酰化,制备得到FA靶向的多功能Mn3O4纳米颗粒Mn3O4-PEI-Ac-FI-mPEG-(PEG-FA) NP,其粒径约为8.1 nm,T1弛豫率r1为0.566 mM-1·s-1。表征测试表明,制备得到的Mn3O4-PEI-Ac-FI-mPEG-(PEG-FA) NPs具有良好的生物相容性、水溶性和低血液毒性。形成的Mn3O4-PEI-Ac-FI-mPEG-(PEG-FA) NPs与未修饰靶向分子FA的锰基造影剂相比,对表达FA受体的肿瘤细胞靶向性更好,满足对肿瘤的靶向检测要求,不论在体外还是体内均表现出较强的靶向肿瘤MRI信号。体内MRI效果表明,注射后1 h,构建的Mn3O4-PEI-Ac-FI-mPEG-(PEG-FA) NPs在肿瘤处富集量达到最高,此时肿瘤处的MRI信号最强。之后随着时间的延长肿瘤处的MRI信号逐渐减弱,但各时间点下使用靶向材料的肿瘤MRI信号值均高于使用非靶向材料的肿瘤MRI信号(见图3)。
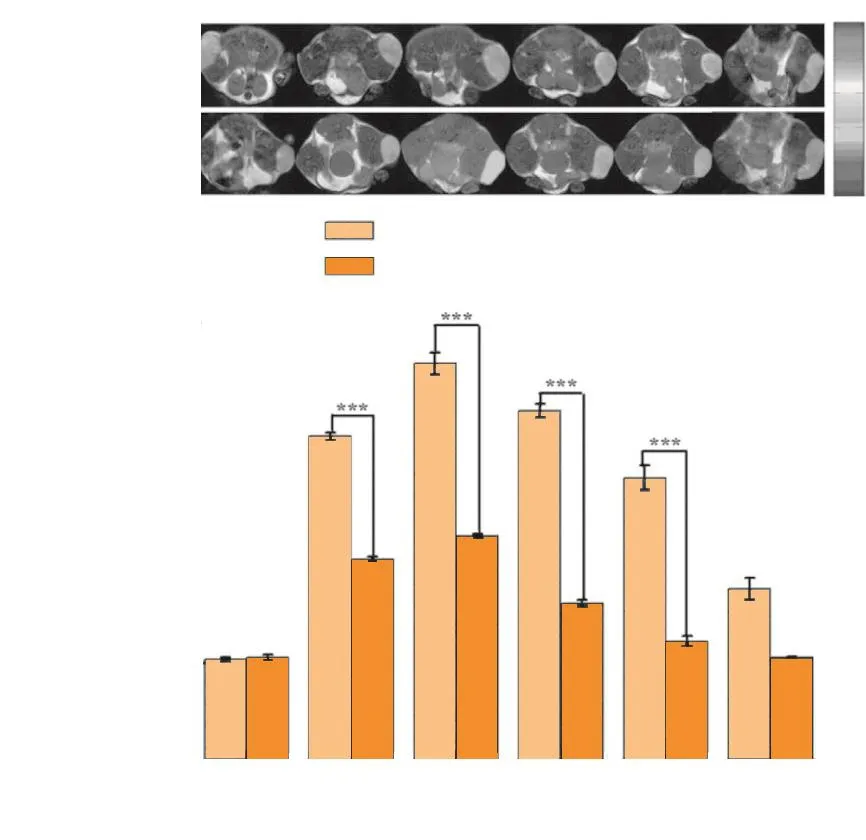
图3 荷瘤小鼠分别接受靶向和非靶向材料注射后其肿瘤处的T1 MRI结果[33]Figure 3 Results of T1-weighted MRI in tumors after injection of targeted and non-targeted materials towards tumor-bearing mice[33]
Zhu等[19]后期同样运用水热合成法制备得到PEI稳定的Mn3O4纳米颗粒,并以此为载体运用PEI表面氨基,进行多功能化修饰,除了荧光素FI、靶向分子FA、生物相容性分子PEG之外,还修饰有大环1,4,7-三氮杂化壬烷-N,N’,N’’-三乙酸(NOTA-NHS)螯合剂,最后以NOTA-NHS为桥梁,将放射性核素铜-64(64Cu)标记在NOTA上以间接标记在构建的功能化Mn3O4纳米颗粒上,构建的64Cu标记的功能化Mn3O4纳米颗粒基于FA的靶向介导能够实现肿瘤对其特异性结合,以进行精准的肿瘤靶向PET/MR成像。值得注意的是,构建的64Cu标记的功能化Mn3O4纳米颗粒与之前报道的PEI稳定的Mn3O4纳米粒子相比具有更高的T1弛豫率(r1= 0.996 mM-1s-1),这可能是由于较高的PEG负载量促使水分子更易接近Mn3O4内核,使其弛豫时间变短、弛豫率升高。
目前构建的基于PEI的锰氧化物造影剂在体内MRI应用中体现出较好的生物相容性,其在体内的毒性要低于钆造影剂,因此在临床上有所应用。但基于PEI的锰氧化物造影剂自身也具有一定的缺陷,在短期内锰氧化物纳米颗粒可在PEI的作用下提升水溶性及稳定性,但长期储存下基于PEI的锰氧化物造影剂易于聚沉,且粒径变大,后期注射入体内易堵塞血管,且其弛豫率低于基于钆的造影剂,MRI效果低于基于钆的造影剂。因此,构建的基于PEI的锰氧化物造影剂在体内稳定性及弛豫率方面的提升仍需深入研究,为今后构建精准的基于PEI的锰氧化物MRI造影剂奠定基础。
2 基于超支化聚乙烯亚胺的T2 MRI造影剂
T2MRI造影剂在MRI中表现出暗场效果,通过降低病灶部位明暗度以突出器官组织病变情况。T2MRI造影剂的典型代表主要为磁性氧化铁纳米颗粒[34-35],由于其纳米粒径较大,以及稳定性和生物相容性较差,常需要加入功能试剂或载体进行稳定或修饰。PEI作为良好的纳米载体,能够有效耐受高温以配合磁性氧化铁高温合成的特点,且其良好的水溶性及生物相容性可提高磁性氧化铁纳米颗粒的稳定性、降低毒副作用。因此,基于PEI的T2MRI造影剂在生物医学领域中被广泛应用。
基于PEI的氧化铁纳米颗粒,由于PEI的介导及稳定作用,可有效避免形成尺寸较大的磁性纳米颗粒,进而避免磁性氧化铁纳米颗粒聚集。Goon等[36]以PEI为稳定剂,一方面阻止磁性氧化铁纳米颗粒聚沉,另一方面PEI可用于负载小尺寸(2 nm)的金纳米颗粒。基于PEI的介导,在氧化铁纳米颗粒表面可形成功能层以阻碍磁性纳米颗粒聚沉。动态光散射研究结果表明,未经PEI稳定的磁性氧化铁纳米颗粒在超声后立即聚集,水动力学半径增长至1 μm,且纳米颗粒很快聚沉至瓶底。然而,PEI稳定的磁性氧化铁纳米颗粒其稳定性明显提升,不易发生聚沉,动态光散射测试结果显示,其粒径恒定在200 nm左右。这种稳定性归功于PEI所具有的静电及位阻排斥力。Steitz等[37]同样以PEI稳定超顺磁性氧化铁纳米颗粒(SPION),发现其在高盐浓度及各种pH条件下仍然具有良好的胶体稳定性。该课题组还测试了不同pH、电解质浓度(2.5 mmol·L-1NaCI)下的纳米粒子浑浊度,发现当pH处于5~11时,SPION发生聚沉,原因是较低的静电排斥作用不足以稳定该纳米体系;然而,同样改变pH环境,PEI稳定的SPION并没有出现任何浑浊现象,说明PEI在不同pH条件下均可增强SPION的胶体稳定性。
Wang等[38]以PEI作为稳定剂热分解乙酰丙酮铁制备水溶性SPION,通过调控合成温度及PEI的相对分子质量,使得SPION平均粒径被调控于6 ~12 nm之间,并掺入PEG和PEI,PEI通过表面氨基连接在SPION表面,PEG通过范德华力和氢键作用连接PEI,以这种方式将PEG和PEI连接在SPION表面。由于PEG和PEI具有强亲水性和生物相容性,使得SPION在去离子水和其他生理溶剂中具有良好的分散性、胶体稳定性和生物相容性。与此同时,PEI的加入,可调控SPION表面电势,使得合成的SPION作为优良的MRI造影剂适用于生物医学领域。
Li等[39]首次采用一锅水热合成法制备PEI稳定的磁性氧化铁纳米颗粒(Fe3O4-PEI NP),随后将功能分子FI、2种不同相对分子质量的透明质酸(HA,HA6K和HA31K)分别修饰在Fe3O4-PEI NP表面并进行靶向效应的对比,其粒径约为15~16 nm,具有良好的分散性和胶体稳定性,体外细胞毒性测试及血液相容性测试结果验证其具有良好的生物相容性。在肿瘤细胞靶向性实验中证明,该课题组构建的基于HA修饰、经PEI功能化的磁性氧化铁造影剂对肿瘤细胞具有良好的靶向功能,可作为肿瘤细胞的有效分子探针。构建的Fe3O4-PEIFI-HA6KNP和Fe3O4-PEI-FI-HA31KNP,其横向弛豫率r2分别为 139.45 和 150.07 mM-1·s-1(见图 4)。Fe3O4-PEI-FI-HA31KNP比Fe3O4-PEI-FI-HA6KNP具有更高的弛豫率是由于HA6K的密集接枝限制了水分子有效进入纳米颗粒表面。构建的Fe3O4-PEI-FIHA6KNP和Fe3O4-PEI-FI-HA31KNP比其他功能化的Fe3O4NP具有更高的横向弛豫率[40-41],可作为良好的T2阴性造影剂用于MRI。
Li等[42]后期在一锅法水热合成PEI稳定的磁性氧化铁纳米颗粒的基础上,将靶向试剂FA通过PEG修饰在其表面,构建的功能化磁性氧化铁纳米颗粒Fe3O4-PEI-Ac-FI-PEG-FA NP能够与高FA受体表达的肿瘤细胞特异性结合。该造影剂仍然具有较低的细胞毒性,良好的生物相容性、水溶性和胶体稳定性。材料MRI研究表明,随着材料浓度的升高,MRI信号值逐渐降低。基于FA的靶向效应,该纳米探针在体内外能够实现灵敏的靶向MRI效果。如图5所示,随着时间的延长,注射Fe3O4-PEI-Ac-FIPEG-FA NP材料的荷瘤鼠肿瘤部位MR信号逐渐减弱,与之相比,经Fe3O4-PEI-Ac-FI-mPEG NP处理的荷瘤鼠肿瘤部位MR信号不随时间的增长而降低。在经Fe3O4-PEI-Ac-FI-PEG-FA NP处理4 h后,肿瘤部位的MR信号降低到最低,后由于材料在体内代谢排出,24 h后肿瘤处MR信号得以恢复。这一结果体现了FA介导的靶向肿瘤MRI的特性。

图4 Fe3O4-PEI-FI-HA6K NP和Fe3O4-PEI-FI-HA31K NP的T2 MRI图及1/T2线性拟合图[39]Figure 4 T2-weighted MRI map and 1/T2 linear fitting chart of Fe3O4-PEI-FI-HA6K NP and Fe3O4-PEI-FI-HA31K NP,respectively[39]
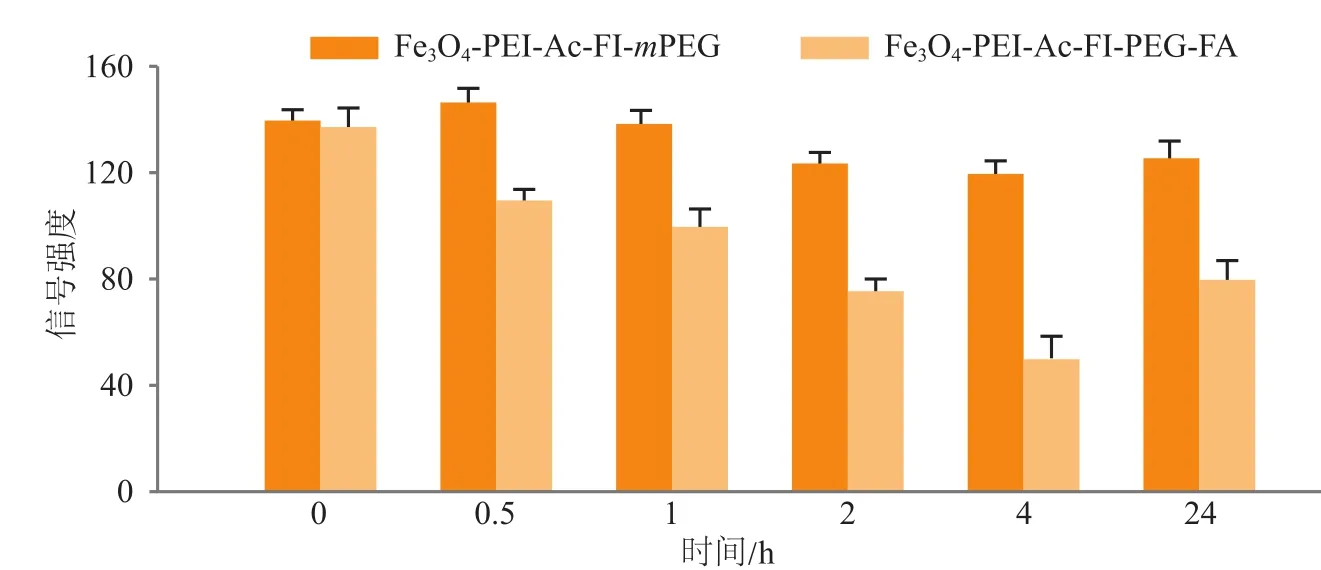
图5 在静脉注射Fe3O4-PEI-Ac-FI-mPEG NP及Fe3O4-PEI-Ac-FI-PEG-FA NP后肿瘤部位的MR信号图[42]Figure 5 MR signal intensity of tumor after intravenous injection of Fe3O4-PEI-Ac-FI-mPEG NP or Fe3O4-PEI-Ac-FI-PEG-FA NP[42]
Do等[43]以PEI作为活性稳定剂控制氧化铁纳米颗粒的合成,通过共沉淀法应用羟胺与PEI制备SPION,且通过PEI调控SPION的颗粒尺寸、纳米簇的水动力学半径、包覆SPION的层厚及弛豫率r2。构建的单分散性PEI-SPION平均粒径为14.4 nm,其弛豫率r2为227.6 mM-1·s-1,在浓度达132 mg·L-1时PEI-SPION仍没有明显细胞毒性。体内MRI研究表明,大鼠肝脏对PEI-SPION具有快速且强效的摄取。构建的PEI-SPION通过PEI介导合成来有效调控SPION的尺寸及提升弛豫率,作为有效且灵敏的MRI造影剂,具有潜在的应用价值。
目前构建的基于PEI的氧化铁纳米T2MRI造影剂,在PEI的作用下增强了氧化铁纳米颗粒在体内的生物相容性、水溶性及稳定性,且其可通过PEI自身的合成调控氧化铁纳米颗粒粒径从而明显提升弛豫率r2。基于PEI的氧化铁纳米造影剂作为阴性造影剂的典型代表被普遍应用于临床,实现体内灵敏的MRI[44]。但构建的用于T2MRI的基于PEI的SPION粒径普遍偏大,在体内进行MRI的过程中易于堵塞血管,在对荷瘤鼠模型进行长期MRI监测观察的过程中荷瘤鼠易死亡。因此,在调控基于PEI的SPION粒径方面仍待改进,这也为构建基于PEI的新型T2MR造影剂提供了思路。
3 基于超支化聚乙烯亚胺的T1/T2双模态MR造影剂
MRI技术可在没有电离辐射的前提下获得成像部位高分辨率解剖学及生理学信息,按照其成像特征分为T1MRI和T2MRI[45],目前构建多模态MRI造影剂已成为趋势,旨在结合T1MRI与T2MRI特征及优势,在成像精确度、灵敏度、分辨率、生物相容性及弛豫率方面有所完善,实现更为精准的MRI[46-47]。
Li等[48]构建了HA修饰的Fe3O4@Mn3O4纳米复合材料,将其用于肿瘤细胞T1/T2双模态MRI,起到了对肿瘤细胞的靶向监测效果。在该项研究中,研究人员首先通过水热合成法一步合成了PEI包覆的Fe3O4@Mn3O4纳米复合材料(Fe3O4@Mn3O4-PEI NC),随后将HA通过PEI表面氨基修饰在PEI包覆的Fe3O4@Mn3O4纳米复合材料表面。构建的Fe3O4@Mn3O4-PEI-HA NC为球型且粒径分布均匀,平均粒径为(23.6 ± 6.5)nm,部分粒子聚集且相互连接在一起(见图6)。在该课题组研究的浓度范围内,其构建的Fe3O4@Mn3O4-PEI-HA NC拥有良好的水分散性、胶体稳定性、生物相容性,且能实现靶向CD44受体表达的肿瘤细胞。构建的Fe3O4@Mn3O4-PEI-HA NC由于包含T1及T2成像元素,因此具有T1/T2MR双模态成像功能,具有较高的T2弛豫率(r2=143.26 mM-1·s-1)、T1弛豫率(r1=2.15 mM-1·s-1),能被用作有效的纳米探针,实现体外肿瘤细胞靶向T1/T2双模态MRI。
Cai等[49]将具有T1MRI功能的氢氧化钆[Gd(OH)3]与具有T2MRI功能的Fe3O4有机结合,构建Fe3O4-Gd(OH)3纳米复合物,实现体内外T1/T2MR双模态成像。该课题组应用水热合成法,将FeCl2·4H2O通过氨水氧化,随后将PEI与Gd(NO3)3混匀并加入装有FeCl2·4H2O的反应釜中,在高温高压反应条件下一步水热合成制得PEI稳定的Fe3O4-Gd(OH)3磁性纳米颗粒[Fe3O4-Gd(OH)3-PEI]。之后为增强其稳定性,通过PEI表面氨基将mPEGCOOH修饰在Fe3O4-Gd(OH)3-PEI表面得到Fe3O4-Gd(OH)3-PEI-PEG。经表征发现,该纳米颗粒具有较高的 T1弛豫率(r1=5.63 mM-1·s-1)、T2弛豫率(r2=151.37 mM-1·s-1),同时具有良好的稳定性及细胞相容性。最重要的是,其在体内能实现精准的T1/T2双模态MRI。注射该材料至小鼠体内,结果显示在肝脏处具有优异的T1/T2双模态成像功能,4 h时T1MR信号强度达到最强,T1显像最亮;T2MR信号强度最低,T2显像最暗。之后随着时间的延长,T1信号逐渐减弱、T2信号逐渐增强。材料在体内的组织分布研究表明,Fe3O4-Gd(OH)3-PEI-PEG纳米材料易于代谢并排出到体外,具有良好的生物安全性。
研究人员以PEI为稳定剂,整合T1MRI元素及T2MRI元素构建基于PEI的T1/T2双模态MR造影剂,其结合了T1成像及T2成像的优势,实现了目标部位的精准成像。但其也存在些许缺陷,往往在呈现最佳T1成像效果之时,T2成像效果并未达到最佳。因此,在T1/T2双模态MR造影剂中应考虑如何调控T1MRI元素及T2MRI元素比例,使其在体内同时达到T1及T2成像所需浓度,与此同时弛豫率r1与r2均能达到各自单独成像时弛豫率的最高值。综上,在后期的研究中,优化调控T1MRI元素及T2MRI元素比例,使其达到各自弛豫率的最高值是研究热点,也为今后构建新型基于PEI的T1/T2双模态MRI造影剂指明了方向。
4 结语与展望
本文总结了基于PEI的MRI造影剂的制备及其生物医学应用进展,主要包括T1MRI、T2MRI和T1/T2双模态成像,详细综述了钆基、锰基及铁基MR纳米造影剂,这些由PEI稳定及负载的纳米造影剂均具有良好的成像功能。通过综述各类基于PEI的MRI造影剂的特性可知,PEI作为优良的纳米载体,不仅能作为良好的稳定剂提高各类MR纳米造影剂的稳定性、水溶性及生物相容性,还能有效调控MR纳米造影剂的尺寸及弛豫率,从而实现更为精准的MR诊断。加之PEI价格低廉、性能优良,其丰富的支链结构为纳米造影剂的多功能化修饰提供了基础,因此目前基于PEI的MR造影剂逐渐向临床转化,用于肿瘤的早期诊断。
总体来说基于PEI的MR造影剂改善了传统的MR造影剂的各项缺陷,具有良好的体内外MRI特性及功能。但仍存在不足之处,如成像灵敏度与其他成像模式相比不高,仍需要别的成像模式辅助及配合。目前构建的PET/MR、MR/CT、SPECT/MR等多模态成像纳米造影剂,可弥补单一成像模式缺陷,实现各成像模式优势互补,成为了研究趋势。因此,构建更为精准且灵敏度较高的基于PEI的多模态成像造影剂以弥补MR成像模式缺陷已成为造影剂研究领域的重点方向,且该技术在今后有望逐渐实现临床转化,推广应用至肿瘤外的其他疾病。
