儿童药物的开发策略
2019-11-13萧凤鸣
萧凤鸣
(英富曼集团医药情报部,香港)
1 以符合儿童用药为由被纳入优先审评审批的药物注册申请分析
儿童用药在全球均是一个未被满足的临床需求,其中包括儿童专用药和在药品说明书中标明儿童用药信息的药品。为了保障儿童用药的基本需求、安全性和科学合理性,我国近年发布了多项促进研发创制儿童药品的法规政策。原国家卫生和计划生育委员会等六部委早在2014年5月21日发布了《关于保障儿童用药的若干意见》(国卫药政发〔2014〕29号)[1]。为了促进儿童药物适宜品种、剂型、规格的研发创制和申报审评,以及满足儿科临床用药需求,国家卫生健康委员会、工业和信息化部、国家药品监督管理局(NMPA)发布了3批鼓励研发申报儿童药品清单,最新一批于2019年7月22日发布,即《第三批鼓励研发申报儿童药品清单》(国卫办药政函〔2019〕642号)[2]。原国家食品药品监督管理总局(CFDA)曾于2017年12月28日发布《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)[3],明确列出优先审评审批的药品注册申请范围,其中范围(二)第6条即为儿童用药品(见表1);截至2019年4月8日,一共有827项药物注册申请被纳入优先审评审批名单,其中80项药物注册申请的纳入依据是儿童用药(见表2)。获取相关政策红利,或可成为儿童药物研发企业的致胜关键。
在上述80项被纳入优先审评审批名单的药物注册申请中,54%(43项)为临床申请,46%(37项)为上市申请。大部分(71%)申请仅以儿童用药品为由被纳入优先审评审批,29%的药品除了是儿童用药品外,还因符合其他范围而被纳入;其中,2项药物上市申请同时还符合范围(一)第3条(属于具有明显治疗优势的药品);另有19项药物注册申请同时还因符合范围(二)第4条(属于罕见病药物)而 被纳入优先审评审批的上市或临床申请名单。

表1 原CFDA发布的优先审评审批的药品注册申请范围Table 1 Scope of drug registration applications with priority review and approval issued by former CFDA
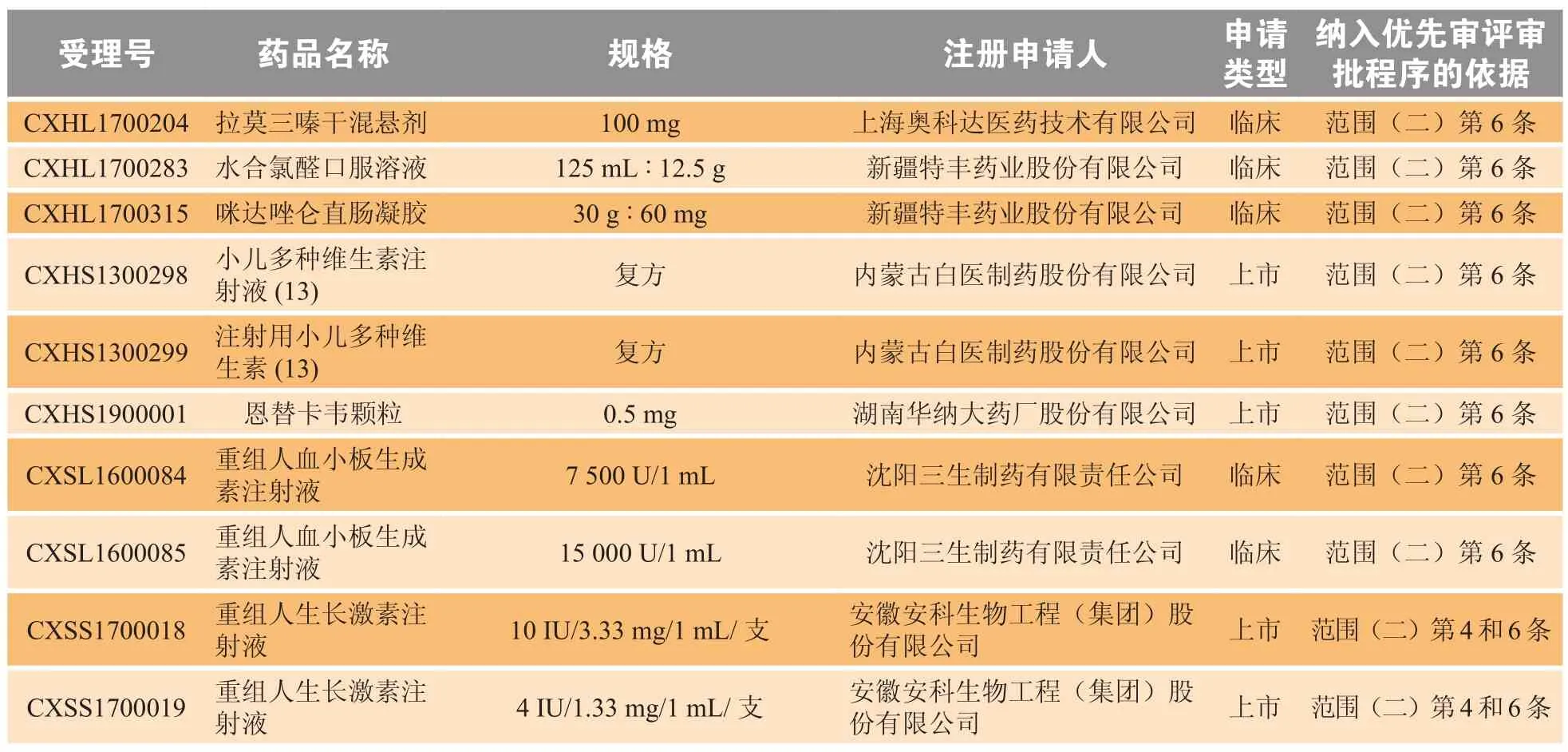
表2 以符合儿童用药为由被纳入优先审评审批名单的80项药品注册申请Table 2 80 drug registration applications included in the priority review and approval list for pediatric drugs

续表2

续表2

续表2
2 儿童药物研发策略:关注境外上市的儿童药物
笔者根据NMPA数据库中的受理号对上述80项药物注册申请进行了分类(见图1)。受理号中第1位的“C”表示境内药物,“J”表示境外药物;第2位的“X”表示新药,“Y”表示已经有国家标准的药品,即仿制药;第4位的“L”表示申请临床,“S”表示申请上市。由图1A可见,上市申请中的境内新药、境内仿制药和境外新药的占比较为平均;临床申请中境外新药占大多数(见图1B)。在上述80项药品注册申请中,境外药物注册申请高达45项(56%),这给予从事儿童药开发的企业一定启示:可多关注境外已上市的儿童药,因其有机会通过优先审评审批的方式进入市场,是一个值得考虑的途径。以下以美国上市的儿童药为例,分析相关政策和药品信息。

图1 80项被纳入优先审评审批程序的药品注册申请的类型分析Figure 1 Different types of 80 drug registration applications included in the priority review and approval process
2.1 美国儿童药的年龄定义
美国联邦法规法典(CFR)定义儿童患者年龄为0至16岁,药物评估和研究中心(Center for Drug Evaluation and Research,CDER)通常将儿科人群分为以下几组。新生儿(neonates):出生到1个月大;婴儿(infants):1个月至2岁;儿童(children):2至12岁;青少年(adolescents):12岁至16岁[4-5]。
2.2 《儿科研究平等法案》
美国FDA会主动要求药企评估新药/生物制剂对儿童患者的安全性和有效性。有关新适应证(indication)、新剂型(dosage form)、新的给药方案(dosing regimen)、新的给药途径(route of administration)、新的活性成分(active ingredient)的药品申请都会触发FDA提出《儿科研究平等法案》(Pediatric Research Equity Act,PREA)的要求。如果药企将会和FDA召开Ⅱ期临床研究总结会议,药企必须在60 d内提交儿童研究计划(Pediatric Study Plan,PSP);如果没有举行这个会议的计划,FDA也会强烈建议药企在开始Ⅲ期临床研究之前提交PSP;PSP必须在提交新药申请(new drug application,NDA)/生物制品许可申请(biologic license application,BLA)申请之前的210 d内提交。用于治疗罕见病的药品可以获得豁免,药企也可以提交延期(deferral)或豁免(waive)申请,如果因为有证据表明该药物对儿童无效或不安全,并根据PREA获授予全部或部分豁免,该信息必须包含在药品的说明书内。欧盟也有类似的计划,名为儿童试验计划(pediatric investigation plan)[6]。建立儿童药物临床试验的强制与激励政策可望进一步鼓励儿童药的开发[7]。
2.3 《最佳儿童药物法案》
《最佳儿童药物法案》(Best Pharmaceuticals for Children Act,BPCA)是让药企自愿开展儿童药物研究所提供的经济激励政策。药企可以提交儿科研究建议书(Proposed Pediatric Study Request,PPSR)给FDA,让FDA发出书面请求(Written Request,WR);FDA也可以在没有PPSR的情况下发出WR。如果药企履行WR就可以获得儿科专属(Pediatric Exclusivity)的资格。如果FDA儿科专属委员会审查后发现研究结果达到WR的条件,该公司就可以获得额外6个月的排他性独家经营权。研究可以扩展至全部适应证,包括标签外使用(offlabel)的适应证;也可以包括罕见病。
2.4 美国药物说明书中有关儿童用药的信息
截至2019年1月30日,FDA收到772项药物说明书中关于儿童用药信息的更新,其中705项更新是基于儿童患者相关的临床试验结果。添加的内容包括以下3类:1)个别药品可以用于儿童的条件,例如年龄、病人群组等;2)明示个别药品还没有足够的证据支持可用于儿童;3)证实个别药品不适用于儿童。
对于儿童药物引进方而言,可以将已经证实的结果作为筛选条件;对于还没有足够证据的药品,引进方可能需要补充相关数据或进行额外的临床试验。以说明书更新次数计算,更新较多(包括上述3类儿童用药信息)的Top10药企列于表3,备注栏详细列出了相关药企最近一次在说明书中添加的儿童药信息(如适用人群和适应证等)和更新日期。从中可以发现多个跨国药企均有适用于儿童的药品在美国获批,部分药品可能成为引进标的或仿制药的参比制剂,原研单位也有可能进口相关药品到我国。
3 儿童药物研发策略:开发罕见病适应证
专注于罕见病药物研发的公司大部分都会以扩展适应证和地域为手段做大做强。部分药企在大品种的基础上,也开始进行罕见病药物的部署,考虑进口已经上市或引进获批概率较高的在研罕见病药物。
在上述被纳入优先审评审批名单的80项药物注册申请中,同时符合范围(二)第4和6条的药品,即用于治疗罕见病的儿童药物,总共19个(24%)品规,即:RO7034067口服溶液用粉末(20 mg/瓶,60 mg/瓶)、emicizumab注 射 液[30 mg(1 mL)/瓶,60 mg(0.4 mL)/瓶,105 mg(0.7 mL)/瓶,150 mg(1 mL)/瓶]、注射用阿加糖酶β(5 mg,35 mg)、注射用美法仑(50 mg)及美法仑原料药、苯丁酸钠散(940 mg/g)、波生坦分散片(32 mg)、重组人生长激素注射液(10 IU/3.33 mg/1 mL/支,4 IU/1.33 mg/1 mL/支)、Spinraza注射液(5 mL : 12 mg)、Ataluren口服混悬液颗粒(125 mg,250 mg,1000 mg)和依库珠单抗注射液(300 mg/30 mL)。

表3 美国药品说明书中关于儿童用药信息的修订Table 3 Changes of pediatric labeling information of US drugs
3.1 全球已上市的罕见病药物概况
利用Pharmaprojects®分析发现,截至2019年3月,全球有813个药品曾在美国、欧盟、日本或澳大利亚获得孤儿药资格认定,其中21个已注册,792个已上市。根据药物数量排序,Top10药企依次为辉瑞、赛诺菲、诺华、罗氏、葛兰素史克、默克、武田、百时美施贵宝、安斯泰来和雅培;原研单位总部所属地区Top10依次为美国、日本、瑞士、英国、法国、德国、爱尔兰、意大利、澳大利亚和以色列;Top10适应证均为肿瘤。
3.2 获批概率高于平均值的在研罕见病药物
Biomedtracker®可通过比较药品的临床结果和竞争优势,评估个别药品的获批概率(likelihood of approval,LOA)是否高于或低于同类药物的平均值。笔者使用Biomedtracker®分析个别在研罕见病药物的获批概率,发现了多个可用于治疗入选我国《第一批罕见病目录》中提及的适应证的药品,且其获批概率(LOA)高于同类的罕见病药物(见表4)。此外,利用Pharmaprojects®可以进一步追踪个别药品在我国的研发历史,发现部分公司曾宣布正在中国寻找合作伙伴。
3.3 罕见病药物在中国的研发趋势
笔者通过Pharmaprojects®分析了在全球(包括美国、欧盟、日本和澳大利亚)获得罕见病药物资格认定的药品在中国的研发趋势。图2中灰色柱状图为在全球获得罕见病药物认定的药品总数,红颜色柱状图和曲线分别表示全球这些获得罕见病药物认定的药品中,正在中国进行开发的数量和占比。分析结果显示,该数量和占比总体趋势均在不断上升,从2001年的6%升至2019年的16%,这样的增长趋势可能是需求使然。不过,开发儿童专用的罕见病药物还需要注意定价、患者人群的基数,以及临床试验设计和入组等因素。可以预见,经济回报和开发难度将会成为药企开发儿童专用罕见病药物的障碍。

表4 部分获批概率高于平均值的在研罕见病药物Table 4 Some orphan drugs with Likelihood of Approval (LOA) above average
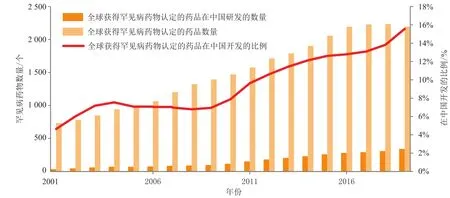
图2 全球获得罕见病药物认定的药品在中国的研发趋势分析Figure 2 R&D trend of globally recognized orphan drugs in China
为进一步规范和指导我国儿童患者群体的药物临床试验,原CFDA于2016年3月1日发布了《儿科人群药物临床试验技术指导原则》(2016年第48号)[8],其中说明药企在参考此指导原则时,也应同时结合人用药品注册技术规范国际协调会(ICH)的指南,例如ICH-E11和ICH-S11中有关儿童药的试验指导原则,阐述了有关伦理学、知情权、招募、保险、数据和安全监察等方面的原则。其中有关儿科罕见病临床试验的内容指出,可靠的动物模型可以为临床试验的设计提供有用的信息,更应结合疾病的流行病学、试验评价方法和统计学假设确定合理的试验样本量。上述指导原则有助于药企开展儿童相关的临床试验。
4 儿童药物研发策略:关注儿童药物制剂新技术
世界卫生组织(WHO)儿童基本药示范目录中指出适合儿童的药物剂型包括咀嚼片、泡腾片、颗粒剂、糖浆剂、贴剂和栓剂等。剂型开发策略包括:从注射剂型改为口服制剂;从普通口服制剂改为更方便使用的滴剂、混悬剂、咀嚼片和泡腾片等剂型;或研发缓释制剂,从而减少服药频次和疗程,也能提高儿童用药的依从性[9]。美国发布的2019年BPCA优先清单列出数个值得进一步研究的儿童药相关技术[10],其中包括:味觉掩盖技术、不需要水的口服可溶解剂型、热稳定和光稳定的剂型、辅料的安全性,以及改善静脉注射制剂水溶性的新技术。
笔者利用Medtrack®检索,发现了多个相关技术,例如法国Ethypharm公司拥有的Flashtab技术是用于制备口腔分散或崩解片剂的技术,可使片剂迅速溶解于口腔中,并且可以在没有水送服的情况下服用片剂,口感舒适。该技术结合了快速融化和掩盖味道这2项关键技术。Flashtab片剂由微涂层颗粒组成,在不到30 s的时间内在口腔中分散,从而使活性成分快速安全地释放到体内。双层Flashtab的片剂技术更可以组合不相容的药物。因为无需水或咀嚼,方便患者在任何地方舒适地使用。Flashtab技术有助改善患者的用药依从性,特别是有吞咽困难的患者。Flashtab技术已经成功用于多个上市药品,以Flashtab技术为基础,多家药企也是Ethypharm公司的合作伙伴(见表5)。赛诺菲的Allegra®正是利用Flashtab技术开发的药品,该产品在2018年的全球总销售额达到1.37亿美金。
美国Adare Pharmaceuticals公司和荷兰Eurand N.V.公司的Microcaps技术可以掩盖味觉。Microcaps技术采用多种精确的涂层技术,均匀地包裹药物颗粒,可用于掩盖药物味道,创建定制释放曲线(customized release pro file),或分隔不相容的成分。吉利德的Viread®正是利用该技术开发的产品,其2016年的全球总销售额超过11亿美金。Microcaps技术已被成功用于开发出多个上市药品(见表6)。
5 结语
我国近年推出多项支持儿童药物开发的政策,充分利用政策红利是儿童药物研发企业的致胜关键。总结上文,儿童药物研发企业可从以下几个途径争取市场。
1)关注境外上市的儿童药物。美国的PREA和BPCA这2条法案鼓励药企进行儿童药的开发,多年来已积累了多个已被证实可以用于儿童患者的药品,这些药品可能成为引进的标的,或仿制药的参比制剂,原研单位也可能加快进口相关药品到中国的步伐。除了美国之外,也可以关注已经在欧盟、日本、印度等地上市的儿童药。
2)开发以罕见病为适应证的儿童药物。截至2019年4月8日,以符合儿童用药为依据被纳入优先审评品种名单中的80项药物注册申请中,有19项(24%)也以罕见病为适应证。目前全球罕见病约有7000多种,部分为遗传病和儿童病,孤儿药市场竞争相对较小,以全球市场和扩展适应证为目标,有望成为业绩的增长点。引进已经上市或在研的罕见病药物,需要分析罕见病的流行病学数据,以及待引进药品过往的销售数据、获批概率、扩展适应证的可能性;选择合作伙伴也需要分析相关公司的研发能力和销售渠道是否完备。
3)与拥有儿童药物剂型核心开发技术的团队合作。开发或引进儿童药品专有剂型核心技术是一举多得的措施:一方面,同一个技术平台可以用于多种药品的研制;可以与更多志同道合的同行合作;在竞争愈发激烈的市场,自研技术能够增加技术壁垒,便于占领市场高地。

表5 利用Flashtab技术开发且获批上市的药品Table 5 Marketed drugs developed with the Flashtab technology
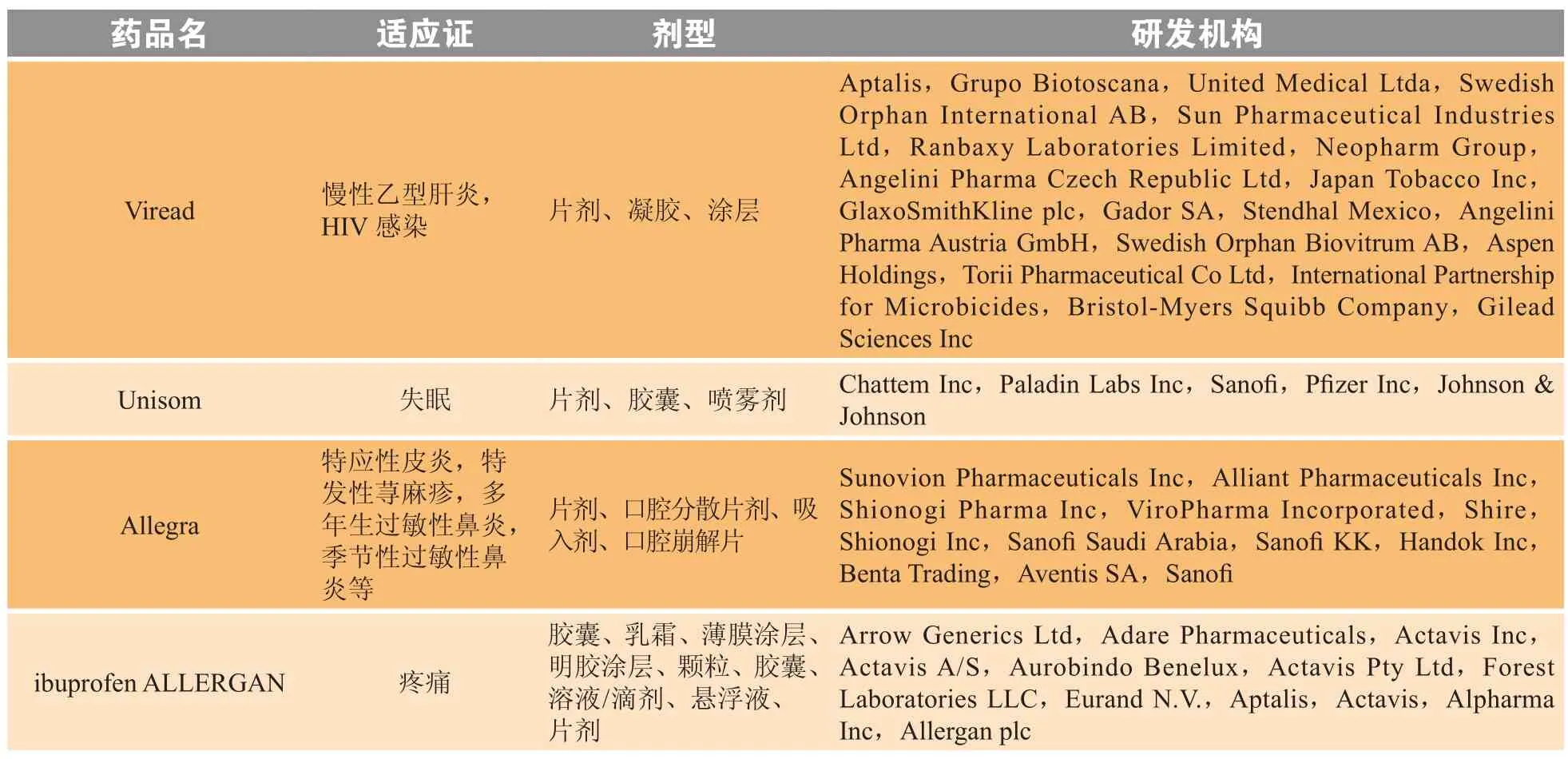
表 6 利用Microcaps技术开发且获批上市的药品Table 6 Marketed drugs developed with the Microcaps technology

续表6
