儿童药物的剂型设计
2019-11-13苏敏
苏敏
(重庆能源学院精准医药与营养研究中心,重庆 402260)
1 引言
1.1 儿童药物概况
儿童药物是指14岁以下未成年人使用的专用药品。儿童不是成人缩小版,而有其独特的生理特点。因此,年龄不同,对药物的吸收、分布、代谢和排泄能力不同,不能仅仅单按体质量、年龄或体表面积(BSA)来换算用药剂量。
《2016年儿童用药安全调查报告白皮书》中指出,我国儿童患病数量占患病人数的19.3%,但是在临床常用的3500多种药品中,儿童用药仅有60多种,专业的儿童用药制造商仅10余家。大部分药品没有儿童用药安全包装,未配备专用量器。同时,儿童用药安全形势严峻。据中国聋儿康复研究中心统计,我国每年有约3万名儿童因用药不当陷入无声世界。
近年,我国针对儿童药物推出不少举措,这些利好政策为儿童药物的研发和生产带来积极影响,但仍未彻底改变儿童药物品种、剂型不足等老问题。
1.2 儿童药物递送系统开发指南
为确保在儿童药物剂型设计时充分考虑到儿童群体的独特性,欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA)等机构商定了有关儿童剂型的指导方针[1-2]。根据其原则,不同年龄儿童适宜剂型如表1所示。

表 1 各年龄段适宜剂型Table 1 Suitable dosage forms for different ages
EMA还规定,在药物研发过程中,必须对剂型选择的可接受性进行研究。表2是EMA建议的开发矩阵(表中的数据是对来自欧洲不同国家40位个人参与者,包括家长、药学家和临床儿科医生的问卷调查结果)。该矩阵的目的是建立年龄、发育、剂型和给药途径之间的关系。
2011年世界卫生组织(WHO)专家委员会就儿童患者剂型提出建议,应该从液体制剂转移到适合于儿童的固体制剂,包括粉末、多颗粒和微片技术。固体制剂具有更好的储存稳定性、更低的运输成本。开发能够基于儿童患者的体质量及体表面积调整剂量的药物递送系统(如多颗粒)具有极大的价值。
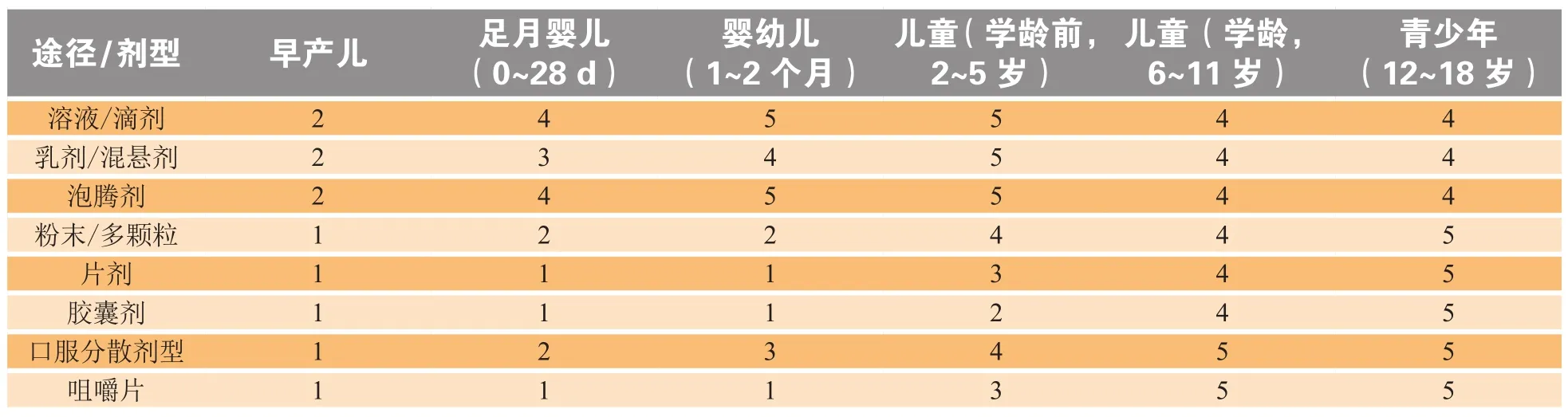
表 2 与年龄有关的口服剂型选择/给药途径开发矩阵Table 2 Development matrix of age-related dosage form selection/administration route
2 儿童的生理特点
与成人比较,儿童还处于生长和发育期。大量关于儿童的解剖和生理方面的数据表明,基于人种、生长条件和环境,以及遗传等因素的不同,同龄儿童也会有不同的身高和体质量。特别是欠发达国家或地区,同龄儿童之间的差异更大。其差异除了身高、体质量等指标外,体表面积也会有差异。
在设计药物剂量时,就需要考虑到这些差异,以保证药物的有效性和安全性。
2.1 人生长发育过程中的体质量、身高、体表面积变化
与其他动物比较,人的生长发育过程很长:身高增长一般需要16年(女性)和18年(男性),体质量增长至约25岁。儿童处于不断生长和发育过程中,按照解剖生理特点可分为:新生儿期(出生至生后28 d)、婴儿期( < 1岁)、幼儿期(1 ~ 3岁)、学龄前期(3 ~ 7岁)、学龄期(7 ~ 11或12岁)、青春期(13 ~ 18岁)。但是,人的生长发育过程与时间并不呈线性关系。图1为体质量与身高、体表面积的关系图[3]。

图 1 人生长发育过程中的体质量、身高、体表面积变化[3]Figure 1 Changes of body mass, height and body surface in the process of human growth and development [3]
2.2 儿童药物的药代动力学
儿童属于特定人群,其药物的体内吸收、分布、代谢、排泄与成人均有差别。在临床上有超过一半超说明书应用于儿童,婴幼儿患者中更是接近90%[4-5]。筛选出“首次儿童( first-in-children)用药剂量”是儿童药物研发过程中的关键[6-8]。
目前对儿童患者用药初始剂量选择有很多研究。早在1940年,Dawson[9]就报道药物给药剂量不随体质量增加而呈线性增加。1950年,体表面积被用于儿童用药剂量调整[10]。近年来,生理药动学(physiologically based pharmacokinetic,PBPK)模型得以应用于确定儿童用药有效剂量,并指导儿童临床试验设计[11]。
图2展示了人在不同年龄身体各部位体表面积的分布比例变化情况。随着年龄增长,儿童的器官也在不断发育,肝和肾占体质量的比例随着年龄增长而降低[12]。
儿童身体组成和器官功能因为生长发育而带来的变化无疑会影响到药物的药动学特性和药理作用。更好地认识和了解上述影响,有助于改进药物对儿童的安全性和有效性。因为儿童的生长发育是动态的,不宜采用某单一的标准剂量。
儿童在出生后头2 ~ 3年生长发育非常迅速,身体组成的变化也主要在这一阶段。青春期时第2个快速生长发育突变期,也与药物的代谢动力学有关联。
除了体质量和器官等发生变化外,儿童身体内的脂肪、蛋白质、细胞内水分等都会发生显著改变。早产儿的身体总水分可达体质量的85%,而足月儿为70% ~ 75%;4个月后将逐渐降低至60%,并保持相对恒定。细胞外水分也在儿童时期逐渐降低(见表 3)[13]。

图 2 不同年龄体表面积分布百分比例[12]Figure 2 Percentage distribution of body surface area (BSA) of different ages [12]
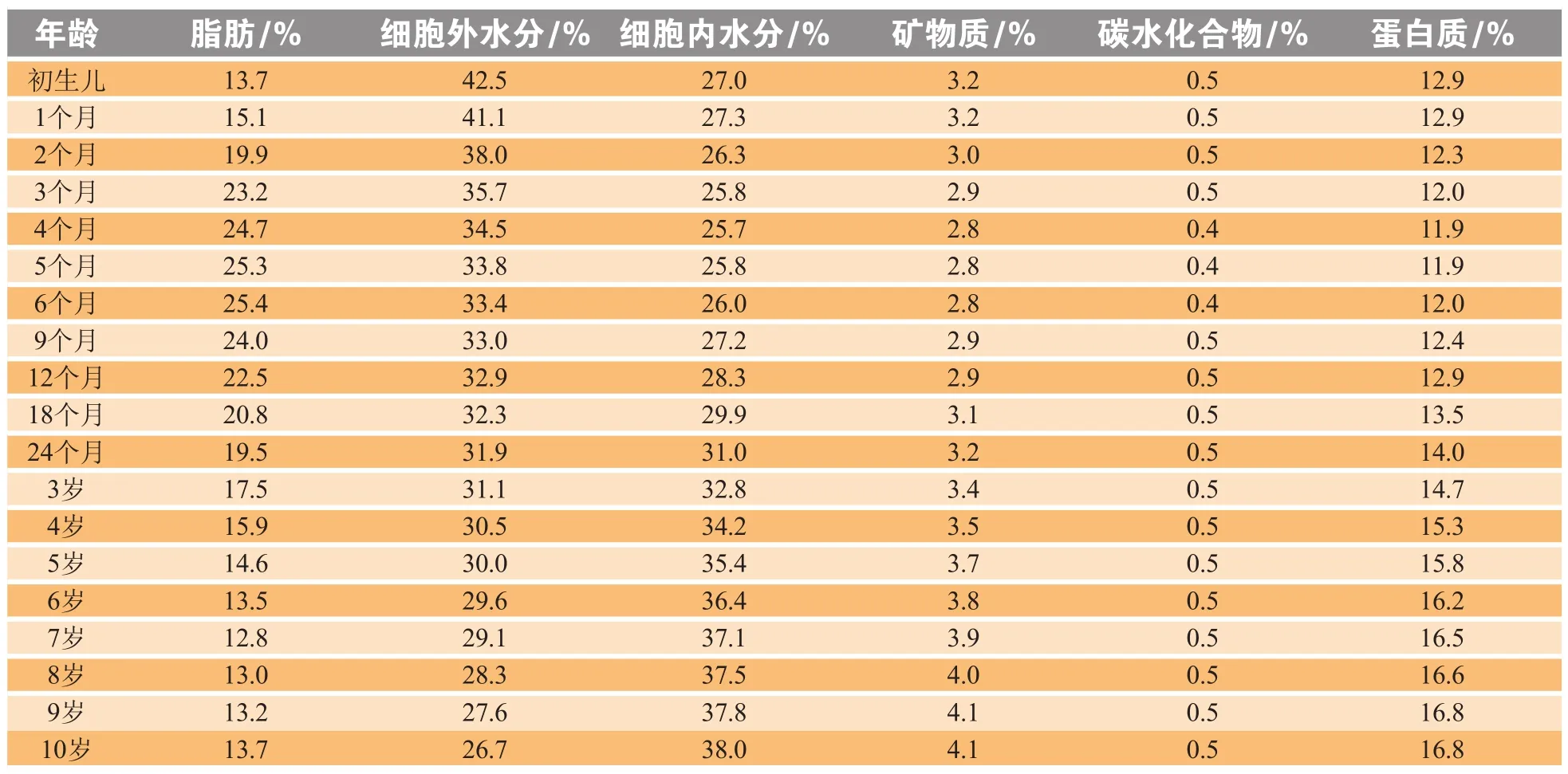
表 3 不同年龄段身体组成变化Table 3 Changes of body composition for different ages
婴儿期影响药物代谢的生理过程变化很大,尤其是在出生后前几个月。药物代谢可以分为吸收、分布、代谢和消除(ADME)。儿童在2岁前和2岁后其药代动力学会有很大差异[14]。
2.2.1 吸收
婴儿和少儿的药物吸收同样遵循成人的规律。药物通过不同给药途径(口服、注射、黏膜、经皮、直肠等)进入体内后受到的影响也与成人类似。但是,由于儿童在不同阶段其身体组成、器官发育以及体内微生物环境等都处于动态变化中,因此,药物的吸收也会不同。以药物吸收的主要部位胃肠道为例,其环境在出生几小时和几天后会因为喂食食物而发生迅速变化。表4显示了不同年龄下胃肠道吸收的变化情况。在婴儿期,其胃酸分泌较成年人少,因此婴儿的胃pH值较高。足月婴儿的胃酸分泌较早产儿快,最高浓度在第4 d。
婴儿的胃排空时间(6 ~ 8 h)也较成人长,通常要到6 ~ 8个月后才达到成人方式。

表 4 不同年龄段胃肠道吸收的变化Table 4 Changes of gastrointestinal absorption for different ages
因此,婴儿服药后,药物会更多地在胃吸收。如果药物需要在肠道吸收起效,对婴儿来说其治疗效果会被延迟。同时,婴儿的肠蠕动也不规律,导致药物需要更长的转运时间(8 ~ 96 h)。婴儿的小肠比表面积与体质量的比值高于成人。婴儿出生时缺少胆盐,新生儿的胰腺外分泌酶活性较低。肠通透性更容易让大分子如蛋白质和大分子药物通过。因为肝中转运体和酶的活性较低,肝脏首过效应也因此减小。婴儿通常会被频繁喂食,延迟排空使胃中也常有营养物滞留。新生儿的胃肠道酶活性、α-淀粉酶和其他十二指肠中的胰酶活性也较低;新生儿的胆酸、脂肪酶浓度低,导致脂溶性药物的吸收减少。新生儿和少儿的CYP3A和P-糖蛋白(P-gp)的低水平表达使药物的生物利用度提高[15]。
儿童经肌内或皮下注射使用药物的吸收效果与成人相似,与通过肌肉的血流速度有关。但是一些生理因素、疾病因素或药物因素会降低血流速度,如心悸、血管收缩、拟交感神经药物、心衰等,使药物吸收变得复杂。如果血流灌注突然改善,药物进入体循环的量会瞬间增加,将可能使药物达到毒性浓度。如强心苷类、氨基糖苷类抗生素、抗惊厥药物等。
皮肤是肌体对抗外界侵袭的自然屏障,但是儿童特别是婴幼儿的皮肤通透性较成人高,故而在通过皮肤进行局部治疗时需要特别警惕可能出现的药物全身吸收。新生儿皮下脂肪及肌肉组织较少,局部血流灌注不足,从而导致肌内注射药物的吸收量较少,如给早产儿肌内注射易形成局部硬结甚至囊肿,还有可能因药物吸收缓慢在局部蓄积而产生“储库效应(depot effect)”。因此,对新生儿尤其是早产儿,肌内或皮下注射不是一个恰当的途径。
2.2.2 分布
随着生长发育,人身体组成也在不断改变,药物的分布容积也在随之变化。新生儿的身体水分(70% ~ 75%)比成人(50% ~ 60%)多。并且,研究人员还观察到足月新生儿身体水分(70%)与早产儿(85%)之间也有差别。新生儿的胞外水分体质量比(40%)比成人(20%)高。因为很多药物需要通过胞外水予以分布,胞外水体积成为药物在受体部位浓度的重要决定性因素,尤其是水溶性药物。早产儿的脂肪体质量比要小于足月儿。成人的器官会积聚较高浓度的脂溶性药物。
另一个决定药物分布的重要因素是药物血浆蛋白结合率。白蛋白是具有最强结合力的血浆蛋白。一般而言,新生儿的药物蛋白结合较低,因此其接受药物后游离药物浓度较高。药物主要是通过游离药物发挥药理作用,因此,这可能导致更强的药效或毒性。有些药物的白蛋白结合与血清胆红素存在竞争性,给黄疸儿用药需要予以考虑。新生儿的血脑屏障透过性较高,胆红素可进入脑内导致核黄疸。
2.2.3 代谢
口服药物一般通过肝脏生物转化而获得药理活性和(或)通过代谢排出体外。2周内的新生儿和早产儿肝脏酶系统还未发育成熟,药物代谢酶的活性较成人低,因此对药物的清除率也较成人低;在某些病理状况下(如缺氧、黄疸等),药物的转化清除速率更低,常规剂量也可能产生蓄积乃至中毒。
微生物定植在出生时就已经开始,其组成与喂养方式(母乳或配方奶粉等)、是否有抗生素治疗以及饮食等有关。动物试验表明饮食等因素使肠道菌群等体内微生物环境发生变化,从而影响到药物的体内生物转化和吸收。
在给小儿用药时必须考虑其成熟过程,特别是需要长期用药时。此外,在给新生儿用药时还需要考虑其母亲在怀孕时是否使用了能够诱导胎儿肝酶的药物(如苯巴比妥)。如是,新生儿对某些药物的代谢能力会较强,同等剂量的药物其血药浓度降低而影响疗效。
2.2.4 消除
肾脏是药物的主要清除器官,新生儿因发育不完全,新生儿肝、肾功能的不完善,肾血流量及肾小球滤过率低,肾小管清除功能不完全,因此,新生儿和早产儿易发生药物及其代谢产物的蓄积与中毒。
3 口服制剂的设计
3.1 口服制剂设计的一般考虑
口服给药是儿童最常用的给药方式。口服制剂的有效性可能受到外在因素(配方、营养和联合用药)和内在因素(生理和疾病变异)的影响。
人体在生长发育过程中,其吞咽反射、排泄消化酶、肠蠕动、转运时间、肠道转运蛋白和药物代谢酶水平会发生变化。例如,药物外排转运体的变化导致药物排出回肠腔减少或增加,从而使药物口服生物利用度改变。
了解药物吸收胃肠道过程的个体差异,有助于更准确地预测各年龄段儿童的口服药物处置情况。开展药物溶出度/溶解度试验、体外药物代谢和转运体研究以及体内药物微剂量研究等,可阐明胃肠道过程中与年龄相关的变化,以更好地了解和设计儿童口服药物。将这些数据应用于生理药动学(PB-PK)模型,可进一步指导个性化的儿科药物治疗。
3.1.1 吞咽反射
吞咽反射是新生儿在食物入口时所引起的一系列有关肌肉的反射性、顺序性收缩反应。该反射通过两大神经系统传入和传出,其中传入神经分布于软腭、咽后壁、会咽等处,传出神经则存在于第5、9、12对脑神经及迷走神经的分支中。早期婴儿的反射能力弱,不宜给此期间的婴儿喂食非液体食物。因吞咽反射较差,早产儿和3 ~ 4个月的婴儿还不能利用舌的动作将食物送到口腔后部及咽部。
食道和喉部括约肌功能对口服喂药非常重要。吞咽反射将影响婴幼儿口服制剂的设计,通常必须采用液体形式喂药。由于婴幼儿无用药自主性,对于带有苦味或者异味的药物会有严重的抵触,在不能很快吞咽进入食道的情况下,会有吐出等行为,可能会将药物带入气道而导致窒息。
因此,在设计制剂处方时,需要考虑患儿的口腔容积和胃容积。新生儿胃容积通常不超过50 mL,口服制剂的体积应该尽可能小。
目前临床上缺乏针对儿童某一年龄的特定制剂,通常需要就现有的制剂进行分剂量使用,片剂和胶囊很难进行准确的分剂量。微粒型固体制剂和微片等将是儿童固体制剂设计的一个重要方向[16-17]。
3.1.2 pH值
胃酸在食物消化中起着重要作用,是胃肠道防御的重要屏障。胃的pH值通常是通过间歇性的胃液吸入或持续的胃内pH监测(24 h)来测量的。
在所有年龄段,胃的pH值都是强酸性的。只有刚出生的孩子出生后几秒钟的平均值是7左右,但几个小时后即下降到2 ~ 3。这一现象是由于羊水的吞咽而引起的。其他研究结果显示,所有年龄段儿童的胃pH值保持在2 ~ 3[18]。
一般而言,非解离形式(分子型)的药物分子才能通过细胞膜而被吸收。药物进入膜内水介质中,成为解离形式而发挥作用。解离形式和非解离形式药物的比例与药物的解离常数(pKa)和体液介质的pH有关。
根据酸碱平衡理论,酸性药物pKa>pH时,分子型药物所占比例高;pKa= pH时,解离型和分子型药物各占一半;可以预测,酸性药物在pH低的胃中、碱性药物在pH高的小肠中,药物更多以分子型呈现,其吸收率较高。
3.1.3 胃排空
胃排空及其速率也可影响药物吸收。小肠表面积大,是大多数药物的吸收部位。胃排空加快,药物到达小肠时间就会缩短,使得药物被快速吸收。
胃排空时间受胃内容物影响。研究表明,健康儿童(12.1~16.0岁)的果糖和葡萄糖摄入后半排空时间(half-emptying time)分别为45.5和64.3 min[19]。固体食物能够增加胃半排空时间,平均胃半排空时间为121 min。乳糜泻可能会延长胃排空时间,但若采用无麸质饮食则无此现象[20]。
3.1.4 十二指肠收缩
胃排空是由十二指肠蠕动活性、基底收缩、幽门括约肌松弛及肠运动活性的协同作用所决定。无论空腹或饱食状态,早产儿和足月儿的胃窦运动活性没有差别。然而,在早产儿中十二指肠活动的窦状簇所占的比例远低于足月新生儿。随着孕龄的增加,窦房结和十二指肠活动程度也随之增加,收缩对运动的影响也增大。空腹时早产儿的十二指肠活动持续时间比足月儿短,喂养时十二指肠活动相应增加。十二指肠活动的成熟依赖于口服食物的引入时机,较早的喂食时间(3 ~ 4 d)比较晚的喂食时间(10 ~ 14 d)更加显著。
3.1.5 小肠转运时间
胃肠蠕动的有效性反映在口-盲肠传输时间(oro-cecal transit time)。胃排空和小肠转运时间决定了药物在小肠黏膜表面分散的速度。同时,药物在小肠黏膜的分散速度还受到小肠疾病的影响。对于年龄很小的儿童患者,口服药物的达峰时间可能会延长很多。
3.1.6 胆盐和胰酶
研究表明,出生后的前几周早产儿小肠胆汁浓度为4.55 mmol · L-1。喂食方式会影响胆酸浓度,母乳喂养的新生儿其胆酸浓度比接受配方奶粉喂养的新生儿要高。新生儿的胆酸浓度在几天到几个月内就达到与成人相近。胰腺分泌的消化酶在早产儿中呈现异常,在出生后的前2 d仅有足月儿的43%。但是一般在2周后就达到成人水平[21]。
脂溶性药物在体内的溶解和吸收受到胆汁功能的影响。未发育成熟的肝肠循环、胆盐向肠腔转运缺失等都会降低脂溶性维生素和脂类药物的摄取。
3.1.7 肠转运
肠转运对口服药物的生物利用度极为重要。药物外排转运体将药物推回肠腔将降低药物生物利用度。多药耐药蛋白1(MDR1)是最重要的外排转运体之一[22]。
CYP3A随个体发育而变化,可以通过mRNA表达、蛋白表达或活性水平来体现。CYP3A蛋白表达水平随着年龄增加而升高,而CYP3A4和CYP3A5 mRNA表达水平通常在第1年很高,然后降低到成人水平。
3.1.8 感觉器官
人体有多种感觉器官,主要是眼、耳、鼻、舌、皮肤等,就口服制剂设计而言,需要考虑味觉(舌)和嗅觉(鼻)这2个因素[23]。
甜、酸、苦、咸是最基本的味觉,对味道的感觉,通常为4种味觉的混合。4种基本味觉刺激在舌面的感受性分布性不同,甜感主要在舌尖、酸感在舌边后部、苦感在舌根,而舌边前部对咸味的感觉灵敏。舌部对滋味感觉极快,仅为1.5 ~ 4.0 ms,远远快于听觉、视觉和触觉。
嗅觉由嗅神经系统和鼻三叉神经系统参与,与味觉整合并互相作用。与味觉不同的是,嗅觉是一种远感。
3.2 固体制剂处方设计策略
3.2.1 药物掩味
儿童用固体制剂通常会在临床使用时改变成容易服用的形式,如加水成为混悬剂、乳剂、溶液剂等液体形式,特别是对于6岁以下的婴幼儿患者。在这一过程中,患儿不可避免会通过口腔味蕾感受到药物的味道。大多数药物都有不良口感,但是儿童患者,特别是婴幼儿患者,对口感不好的药物通常会拒绝服用。因此,口感成为儿童药物的一个极其关键的考虑因素。如何掩味(taste-masking)是儿童用药制剂设计的重要考量。掩味主要通过降低味蕾直接接触的药量(药物浓度)和(或)改变味蕾对苦味的敏感程度来实现[24]。通常有以下掩味手段:
1)包衣。包衣是常用的掩味方法,通过衣膜物理障碍作用而达到掩味目的。
2)环糊精包合。药物分子进入环糊精空穴后形成包合物,药物与味蕾的接触量减少,从而降低苦味感。
3)形成离子交换树脂复合物。离子型药物在离子交换树脂(ion exchange resins,IERs)上吸附形成不溶性复合物,降低药物与味蕾直接接触。此外,口腔中唾液量较少,离子浓度很低,离子型药物不能及时解吸附,药物的苦味得以降低[25]。
4)多孔物质吸附。多孔物质如沸石、活性炭等均可作为载体,药物进入载体空隙,控制药物的释放,降低唾液中的药物浓度,从而起到掩味作用[26]。
5)改变味蕾对苦味的敏感度。通过添加矫味剂、甜味剂、芳香剂等改变味蕾对苦味的敏感度也是一种常用的掩味方法。
需要注意的是,一些人工甜味剂可能对某些患儿有害。比如阿斯巴甜,来源于苯丙氨酸,不能用于苯丙酮尿症患儿的治疗药物设计。甜蜜素和糖精属于磺胺类,对于磺胺类药物过敏的患者,需要注意避免使用。有研究表明,人工甜味剂如三氯蔗糖等可能导致肠道菌群减少,使用时也需要全面评估[27]。
3.2.2 固体制剂
3.2.2.1 分散型、可溶性、泡腾型 分散型、可溶性、泡腾型这几类固体制剂都是在使用时加水分散或者溶解。分散型和可溶性可在加水后迅速分散或者溶解在水中,形成均一的液体。一般还可以分散或者溶解在牛奶中,因此特别适合半岁前的婴儿。泡腾剂也可以加水后分散或溶解,但一般需要更多的水,这对不愿意喝太多水的小儿是一个难题。
3.2.2.2 口腔分散型 口腔分散型(orodispersible forms)包括口腔崩解片(ODT)和口溶膜(ODF)。此类制剂使用时直接放入口腔内,能够在唾液作用下快速崩解或者溶化,通常不需要喝水送服。设计这类制剂的2个关键点是:制剂处方需要快速崩解;良好的掩味效果也非常重要。
3.2.2.3 咀嚼型 咀嚼型药物通过咀嚼口服,需要有适宜的口感。除咀嚼片外,还有咀嚼胶等。儿童的乳牙通常6个月开始冒出,2岁到2岁半长至20颗。咀嚼型制剂被批准用于2岁以上儿童。
3.2.2.4 片剂和胶囊 不同年龄的儿童需要选择合适大小的片剂或胶囊。EMA制订了一个指南作为参考,见表5。

表 5 儿童用药可接受的片剂尺寸Table 5 Acceptable sizes of pediatric tablets
3.2.2.5 多颗粒体系 多颗粒体系(multiparticulate system)可以作为儿童用药的通用技术平台,包括小的分割单元,如粉末、小丸、微珠、小球等,可以进一步制备成其他固体剂型(包括片剂、胶囊、口崩或者咀嚼制剂等形式)。其最大优势是剂量灵活性和多功能性(见图3)。
粉末可以填在硬胶囊中,也可以撒在食物或者饮料中服用。对于在说明书中指明可以撒在食物上服用的多颗粒体系,为保证其剂量准确,FDA推荐颗粒大小为2.5 mm,偏差不超过10%(最大不超过2.8 mm)[28]。
多颗粒体系的小颗粒单元粒径允许连续通过胃幽门括约肌,因此,基本不受胃排空影响,较少受胃肠道通过时间和食物类别的影响;可使药物在胃肠道内均匀分散,减少对胃肠道的刺激,减少个体差异;因每个单元在释药系统中都是独立的个体,少数几个单元的释药失败危险性远低于单个单元系统,使药物突释风险得以避免;生物利用度高,更适用于复方以及儿科制剂等。

图3 多颗粒技术在剂型和给药途径选择中的多功能性Figure 3 Multifunctional multiparticulate technique in choice of dosage forms and drug administration routes
3.2.2.6 微片 微片(mini-tablets)是指一种新型多单元固体制剂,一般直径小于3 mm,WHO专家委员会建议直径不超过4 mm。微片直径小、剂量灵活、释药速率可控,且易于吞咽,特别适合儿童患者服用。微片可以单独服用,也可以根据具体药物剂量或临床需求,装入胶囊[29]。
3.3 液体制剂
液体制剂是最适合儿童使用的制剂。但是,液体制剂需要有良好的口感;同时,因为药物处于溶媒中,其稳定性也是一个重要的考量。
3.4 半固体制剂
口服半固体制剂主要有3种:1)软糖型;2)咀嚼凝胶;3)果冻样的半固体。患者用药依从性是药物治疗的基础,因此,合适的剂型对于特定疾病的治疗很重要。此类剂型不仅方便儿童使用,且患儿用药依从性也较高。
3.4.1 软糖型
软糖型一般是以明胶为基质的糖块。在药房和超市可以看到很多种类的软糖型补充剂,如维生素、矿物质、纤维素、二十二碳六烯酸(DHA)、二十碳五烯酸(EPA)及其他膳食补充剂。
软糖型口服剂型主要是基于糖果技术,由明胶、天然或人工甜味剂、天然或人工色素、柠檬酸、调味剂,以及其他物质包括椰子油、蜂蜡及防止黏连的淀粉等组成。
3.4.2 凝胶型
柔软的咀嚼剂型颇受儿童患者及其父母的欢迎,是儿童药物剂型的一大进步。这种剂型容易吞咽,不易导致窒息,且因为有较大体积,载药量可以较大,也方便携带。这类凝胶还可以做成儿童喜欢的各种形状,增加患儿用药的依从性。
在设计处方时,不仅需要考虑外观,其稳定性和微生物污染等都是重要的考量。此类制剂需要测定其凝胶延展力(断裂点)、剪切力等进行评价。
3.4.3 果冻样制剂
果冻是备受少年儿童喜爱的食品。将药物添加到果冻中,可赋予果冻药用功能,使患儿较易接受。例如,将解热镇痛药物对乙酰氨基酚制备成果冻样制剂[30]。
4 非口服给药途径制剂设计
4.1 经皮给药制剂
经皮给药制剂主要包括透皮制剂和局部给药制剂。
4.1.1 透皮制剂
透皮制剂使药物通过皮肤吸收而发挥局部或者全身治疗作用,能够避免药物的“首过效应”,且无胃肠道刺激,是一种特别适合儿童的剂型[31]。美国已有许多产品用于临床[32]。
妥洛特罗贴剂采用了“药物结晶储存系统”这一独特技术,使溶解的妥洛特罗分子与均匀分散的妥洛特罗结晶共存于膏体中。贴剂一旦贴附于皮肤,膏体中溶解的妥洛特罗分子经皮肤转移被人体吸收,而妥洛特罗晶体则不断析出游离妥洛特罗分子加以补充扩散,因此膏体中溶解的药物分子浓度能保持相对稳定,并且也使得持续释放药物分子成为可能[33]。
为了克服皮肤屏障,研究人员利用微针刺穿皮肤角质层产生瞬时通路传导小分子或大分子药物。微针针头微小,一般不刺激神经,故无痛感,在儿童透皮制剂上具有诸多优势[34]。
新生儿各个器官组织尚未发育成熟,皮肤的结构也未发育完全,而且,儿童的皮肤面积通常只有成年人的1/10 ~ 1/2,其通透性较高。因此,在设计儿童透皮制剂时需要考虑不同年龄儿童的皮肤生理特点。
4.1.2 局部给药制剂
皮肤外用剂型有软膏剂、硬膏剂、涂膜剂、酊剂、擦剂、粉剂、气雾剂等。在此类制剂设计时,应充分了解所治疗疾病的病理特点及临床应用,筛选适当的赋形剂、溶剂、助溶剂,尽可能避免不良反应发生。
4.2 注射剂
静脉注射给药使药物直接进入血液循环,适合儿童临床急救,胃肠道易降解的药物也适合设计制备成注射剂[35]。由于新生儿皮下脂肪和肌肉组织少,局部血流灌注不足,药物容易局部滞留,形成囊肿或硬结,同时也影响药物的正常吸收。故不主张对新生儿肌内或皮下注射给药[36]。
4.3 鼻腔给药制剂
鼻黏膜细胞上有很多微细绒毛,药物通过鼻腔给药,其有效吸收面积较大;此外,鼻黏膜细胞下具有丰富的血管和淋巴管,有利于药物直接进入血液循环。鼻腔内药物代谢酶少,对于大分子药物,如多肽类、蛋白类药物或疫苗,均可设计成鼻腔给药制剂。
4.3.1 儿童呼吸道特点
呼吸系统由呼吸道和肺组成,呼吸道根据位置分为上、下呼吸道。上呼吸道包括鼻腔、鼻窦、咽喉,下呼吸道包括气管、支气管、叶支气管、肺泡管、肺泡。小儿鼻腔相对短小且狭窄,容易因感染而黏膜肿胀,从而发生堵塞。小儿的气管和支气管相对狭窄,纤毛运动差,因此清除能力弱,易因感染而发生呼吸道狭窄和阻塞。小儿肺脏组织弹性较差,肺泡数量较少,故易发生感染导致肺不张、肺气肿、间质性肺炎等。
4.3.2 影响鼻腔给药的因素
鼻腔给药的有效性与鼻腔的解剖结构密切相关[37]。
1)吸收途径:鼻黏膜吸收途径包括经细胞膜脂质通道和细胞间的水性孔道。鼻黏膜上的水性孔道分布较丰富,药物经鼻黏膜吸收的机制为主动转运或被动扩散。
2)鼻腔pH:鼻腔的pH是影响药物吸收的因素之一。婴幼儿鼻腔pH为5.0 ~ 6.0。由于鼻腔黏液较少,每天仅分泌1.5 ~ 2.0 mL,缓冲能力差,鼻用制剂的pH对药物的解离度和吸收有较大影响,通常在pH 4.5 ~ 7.5间选择一个最佳值以提高药物的吸收效果。
3)鼻腔血液循环:鼻黏膜内毛细血管丰富,药物能够快速吸收进入体循环。
4)纤毛运动:鼻黏膜纤毛具有清除作用,可缩短药物的鼻腔滞留时间而影响药物生物利用度。有些药物鼻腔吸收良好,生物利用度与静脉注射相当,但可能对鼻黏膜纤毛具有严重毒性,会不可逆地抑制纤毛运动。
将药物制备成凝胶剂、原位凝胶(in situ gel)或生物黏附制剂,能够延长药物与鼻黏膜接触时间,降低鼻腔纤毛的清除作用,改善药物的吸收[38]。
4.4 吸入制剂
吸入剂通过呼吸道吸入给药,直接作用于病灶,起效迅速。鉴于吸入制剂在临床用药时需要患者高度配合,故不适合婴幼儿。雾化吸入给药是一种解决途径,但是婴幼儿的吸气峰流量小,协同性差,需要对吸入装置特别设计。4岁以下儿童还应使用面罩,防止药物外溅[39]。
4.5 直肠给药制剂
对于胃肠道刺激性较大、易被胃液破坏的药物,或者针对口服困难的患者,可将药物设计成直肠给药制剂,如适合儿童肛门大小的栓剂、胶囊栓等剂型。儿童退热栓已经在临床广泛应用,解决婴儿无法准确给药的问题[40]。
4.5.1 栓剂
儿童用栓剂的设计重点是规格尺寸,对规格尺寸有较高要求(通常为1 g)。栓剂质量与规格尺寸的关系如表6所示。
需要注意的是,由于小儿栓的规格尺寸较小,不适合剂量大的药物。
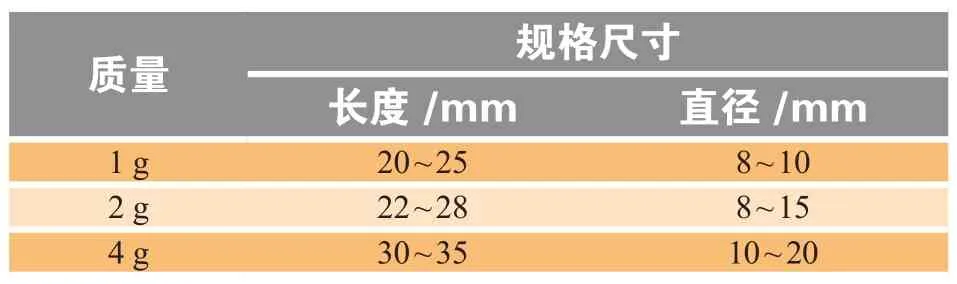
表 6 栓剂质量与规格尺寸Table 6 Weight and size of suppository
4.5.2 灌肠剂
根据临床需要,可以将某些药物或营养剂制备成水性、油性溶液或混悬液,灌注于直肠,起到治疗、诊断或营养的目的。灌肠液比栓剂载药量大,因此其局部治疗作用较强,且安全可靠,适用于儿童用药。
为减少刺激性,灌肠剂应具有中性pH并接近等渗。通常成人灌肠剂所用的辅料也适用于儿童。
4.5.3 凝胶
凝胶也可以作为直肠给药的载体。凝胶剂能够在局部滞留,延长药物作用时间,提高药物生物利用度[41]。
4.5.4 泡沫剂
将某些药物设计成泡沫剂,利用其膨胀特性,使药物逆行扩展至乙状结肠上部,渗入皱襞和褶皱深部,均匀地分布和被吸收,该类制剂常被用于治疗炎症性肠病。如Colifoam®Rectal Foam(含氢化可的松10%)被用于治疗12 ~ 18岁青少年的肠道炎症。
5 结语
由于历史原因,儿童用药短缺已成为全球性问题,引起了包括WHO在内的国际组织以及各国政府的高度关注[34,42]。儿童涵盖了从新生儿到少年(小于16岁)各个不同年龄段的群体,不同年龄儿童的生理条件、体质量、身高以及体内与药物吸收代谢等有关的因素如胃液、肠道的pH值、体内代谢酶等均与年龄和个体发育有关,导致药物的开发从筛选、临床前研究(如适当的动物模型选择以及药物有效性和安全性评价)到临床试验等药物研发过程面临极大挑战[43]。此外,儿童药物剂型设计是一项复杂而艰巨的工作,提高儿童用药安全性和依从性是开展该项工作的重点考量。除了剂量准确、安全性高等,还应根据不同年龄儿童的生理和药动学特征、患儿的病理特点[44],以及考虑到儿童特殊心理特征,从而设计出恰当的剂型。
