甘蓝型油菜湿害胁迫响应性状的全基因组关联分析及候选基因预测
2019-11-13李阳阳荆蓉蓉吕蓉蓉石鹏程周清元李加纳唐章林
李阳阳 荆蓉蓉 吕蓉蓉 石鹏程 李 欣 王 芹 吴 丹 周清元 李加纳 唐章林,*
甘蓝型油菜湿害胁迫响应性状的全基因组关联分析及候选基因预测
李阳阳1,2,3,**荆蓉蓉1,3,**吕蓉蓉1,2,3石鹏程1,2,3李 欣1,2,3王 芹1,2,3吴 丹1,2,3周清元1,3李加纳1,2,3唐章林1,2,3,*
1西南大学农学与生物科技学院, 重庆 400715;2西南大学农业科学研究院, 重庆 400715;3重庆市油菜工程技术研究中心, 重庆 400715
湿害严重影响油菜的产量和品质, 前人在耐湿机制和生理响应等方面已经做了许多研究, 但涉及油菜耐湿相关基因的研究相对较少。本研究以248份甘蓝型油菜品种(系)为材料, 进行湿害胁迫处理, 调查了8个湿害响应的相关性状, 基于60K Illumina Infinium SNP芯片基因型数据对各性状耐湿系数进行了全基因组关联分析和湿害响应候选基因预测。结果显示, 湿害胁迫较正常灌溉油菜幼苗绿叶数减少, 地上部干重和鲜重以及叶片可溶性蛋白含量降低, 叶片POD酶活性和MDA含量略有升高。地下部干重和鲜重在多数材料中降低, 而在有些材料中升高, 变化幅度均较小。经全基因组关联分析共检测到与耐湿系数显著关联的SNP标记36个, 可解释表型变异8.28%~12.95%, 其中17个所关联的耐湿系数在基因型间具有显著(<0.05)或极显著(<0.01)差异, 其所在的Blocks共覆盖了71个候选基因, 包括Blast到同源拟南芥基因64个, 主要编码转录因子(如Transcription initiation factor IIF、bZIP68、myb-like HTH transcriptional regulator family protein)、转运蛋白(如SUC2)、生长抑制子(如ING2)、蛋白磷酸酶(如Protein phosphatase 2C family protein)、DNA/RNA结合蛋白[如bHLH DNA-binding superfamily protein、RNA-binding (RRM/RBD/RNP motifs) family protein]、激素响应蛋白(如ARF8、ADC2、ERD6、NF-YC9)以及氧化胁迫、渗透胁迫、盐胁迫或水分剥夺响应蛋白(如ERD6、NP1、TIR-NBS-LRR、CRT1b)等。本研究可为揭示甘蓝型油菜耐湿机理和培育耐湿新品种奠定基础。
甘蓝型油菜; 湿害胁迫响应性状; 全基因组关联分析; 候选基因
水分是影响作物生长发育的重要非生物因子, 水分过多或过少均会对作物产生不同程度的危害。湿害是由于土壤水分超过田间最大持水量并长期处于饱和状态, 对作物生长发育产生的危害[1], 主要是对作物产生次生胁迫[2], 导致作物根系缺氧, 出现生理失水, 严重时会使根系腐烂发臭[3]。湿害可造成细胞质膜过氧化, 离子渗漏量增加, 无机营养吸收在植株体内重新分布, 丙二醛含量升高, 总糖量和淀粉酶活性降低, 保护酶系统受损, 严重时会使蛋白质分解、原生质结构破坏而致死[4]。湿害会使植株变矮, 生长缓慢, 生育期延长, 叶片由下至上逐渐黄化, 绿叶面积减少, 与光合作用相关的酶活性降低, 光合作用减弱, 光合产物减少且运输减慢, 从而影响植株生长发育和作物产量、品质[5-8]。
油菜是我国重要的油料作物之一, 也是我国食用植物油的主要来源, 其种植面积和总产量均占全球的30%左右[9]。长江流域是我国冬油菜主要种植区域, 其种植面积和产量均占全国90%以上[10]。该区域秋季多阴雨且实行水旱轮作制度, 土壤黏重、透气性差、排水困难、地下水位高[11], 是油菜湿涝灾害的多发地和重灾区。
作物的耐湿能力取决于形态结构和生理代谢上对缺氧的适应能力。作物对湿害胁迫的响应极其复杂, 不仅表现出长期适应性[12], 在细胞结构、组织和形态, 甚至线粒体、内质网和核糖体等亚细胞结构方面也表现出适应反应[13], 同时还通过基因表达调控调节自身的内环境和代谢途径[14]。油菜的不同类型、品种或品系的耐湿性不同, 张学昆等[15]研究甘蓝型油菜耐湿性发现, 缺氧胁迫下, 耐湿品种的活性氧清除系统能降低膜脂过氧化程度, 同时显著增加渗透调节的有机物含量, 提高对抗缺氧胁迫的能力。目前, 针对油菜, 特别是甘蓝型油菜耐湿性的研究较少, 且主要采用缺氧萌发种子或其他水淹处理, 通过测定幼苗相关性状筛选耐湿资源[11,16-18]。在遗传研究方面, 丛野等[19]发现, 甘蓝型油菜耐湿性的遗传受2对完全显性的主基因+加性-显性多基因控制。李真[4]利用150个甘蓝型油菜DH系, 通过183个SSR标记和157个AFLP标记在对照和湿害胁迫下共检测到45个QTL, 其中在2个环境下同时检测到9个, 与耐湿系数相关的有11个。
本研究调查湿害胁迫响应相关性状, 构建耐湿系数, 基于60K Illumina Infinium SNP芯片基因型数据进行全基因组关联分析, 并预测耐湿候选基因, 旨在为利用分子标记辅助选择培育耐湿甘蓝型油菜新品种和揭示甘蓝型油菜湿害响应分子机制研究奠定基础。
1 材料与方法
1.1 试验材料及处理
将248份甘蓝型油菜品种(系)播种于重庆市油菜工程技术研究中心歇马基地旱棚的盆钵(直径25 cm, 高30 cm)中, 当幼苗长至四叶一心时, 选取幼苗长势均匀、植株大小一致的盆钵进行正常灌溉(well watering, WW)和湿害胁迫(waterlogging, WL)处理, WW组土壤含水量维持在20%~23%之间, WL组维持土壤最大持水量(30%左右)且土壤表面无积水, 采用浙江托普仪器有限公司的TZS-1K土壤水分测定仪测定土壤含水量。持续处理4周后调查幼苗的绿叶数(green leaf number, GLN)、地上部鲜重(shoot fresh weight, SFW)和干重(shoot dry weight, SDW)、地下部鲜重(root fresh weight, RFW)和干重(root dry weight, RDW)以及叶片过氧化物酶(peroxidase, POD)活性、可溶性蛋白(soluble protein, Protein)含量和丙二醛(malondialdehyde, MDA)含量, 并计算各性状的耐湿系数(waterlogging resistance index, WLRI): 耐湿系数 = WL性状表型值/WW性状表型值。
1.2 性状调查和测定
1.2.1 GLN调查 心叶完全平展视为1片叶, 绿色面积超过叶片面积1/2的视为绿叶。
1.2.2 SFW、SDW、RFW和RDW测定 随机选取每材料WL和WW各3株, 称其地上部鲜重(g), 将根部洗净擦干后称其地下部鲜重(g)。然后于110℃杀青30 min, 75℃烘至恒重, 称其地上部干重(g)和地下部干重(g)。
1.2.3 叶片POD活性和Protein、MDA含量测定
取倒数第二、三片叶的混合样品, 采用南京建成生物工程研究所提供的试剂盒(A084-3)测定POD活性(U g-1FW), 参照邹琦[20]所用考马斯亮蓝-G250染色法测定Protein含量(mg g-1FW), 参照李合生[21]所用硫代巴比妥酸法测定MDA含量(µmol g-1FW)。各材料每个处理3个生物学重复。
1.3 基因型分析
采用油菜60K Illumina Infinium SNP芯片(包含52,157个SNP标记)进行基因型分析, 按照Qu等[22]的方法删除位置不确定的标记以及缺失率大于20%和最小等位基因频率小于5%的标记, 保留32,839个SNP标记用于后续分析。
1.4 连锁不平衡分析
使用Tassel 5.2.1[23]基于32,839个SNP标记对各染色体进行连锁不平衡分析,2的衰减阈值定为0.2。
1.5 群体结构分析
使用STRUCTURE 2.3.4[24]进行群体结构分析,值依次取1~10, 每个值运算5次, 蒙特卡罗迭代(Markov Chain Monte Carlo, MCMC)和模拟参数迭代(length of bum-in period)值均为100,000。
1.6 亲缘关系分析
使用Tassel 5.2.1进行亲缘关系分析, 小于0的亲缘关系值取为0[25]。
1.7 关联分析、单倍型分析和候选基因预测
利用Tassel 5.2.1及6种模型(naïve, Q, PCA, K, K+Q, K+PCA)对8个性状的WLRI进行关联分析, 根据各模型检测到的值与期望值的偏离程度选择最佳模型, 利用MATLAB 2015b绘制QQ图(Quantile-quantile Plot)和最佳模型Manhattan图。显著关联SNP标记的阈值为3.045×10-5(1/32,839)。
对各关联SNP不同基因型材料的耐湿系数进行测验, 将不同SNP基因型间具有显著(<0.05)或极显著(<0.01)差异的标记称为显著性标记。利用haploView[26]对显著性标记所在LD区间的SNP进行单倍型分析, 参照Qu等[22]设定参数。根据已公布的甘蓝型油菜“”基因组信息(http://www. genoscope.cns.fr/brassicanapus/)获取显著性标记所在的Block区间的基因及序列, 通过BLAST与拟南芥基因进行同源性比对, 根据拟南芥基因注释(https://www.arabidopsis.org/)预测甘蓝型油菜耐湿响应相关候选基因的功能。
2 结果与分析
2.1 表型数据分析
8个性状的方差分析结果表明, 每个性状在水分间、材料间以及水分×材料互作间均存在极显著(<0.01)差异(表1)。由图1可知, 绝大多数材料GLN、SDW、SFW和Protein的耐湿系数小于1, MDA、POD的耐湿系数略大于1; 部分材料RFW和RDW的耐湿系数小于1, 但大多数材料RFW和RDW的耐湿系数接近于1。由此可见, 湿害会降低油菜幼苗的绿叶数、地上部鲜重、干重和叶片的可溶性蛋白含量, 会使叶片的丙二醛含量、POD活性升高, 地下部干重和地下部鲜重的变化在多数材料中表现为降低, 在有些材料中表现为升高, 但变化幅度较小。
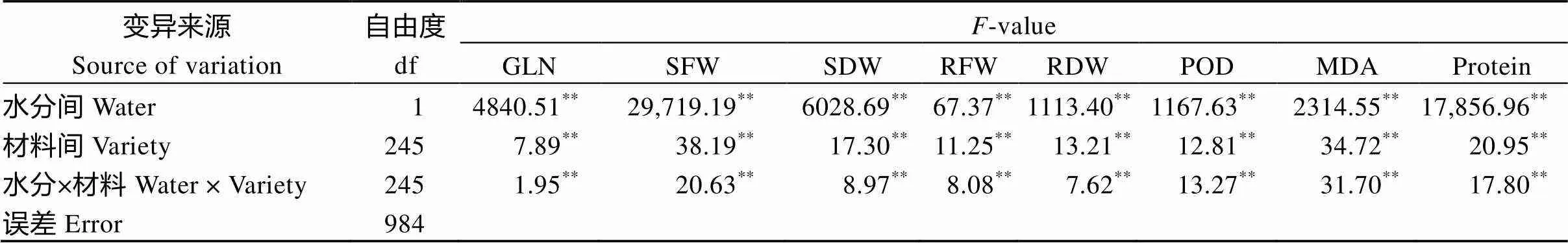
表1 甘蓝型油菜幼苗湿害胁迫响应性状的方差分析
GLN: 绿叶数; SFW: 地上部鲜重; SDW: 地上部干重; RFW: 地下部鲜重; RDW: 地下部干重; POD: 过氧化物酶活性; MDA: 丙二醛含量; Protein: 可溶性蛋白含量。**< 0.01。
GLN: green leaf number; SFW: shoot fresh weight; SDW: shoot dry weight; RFW: root fresh weight; RDW: root dry weight; POD: peroxidase activity; MDA: malondialdehyde content; Protein: soluble protein content.**< 0.01.
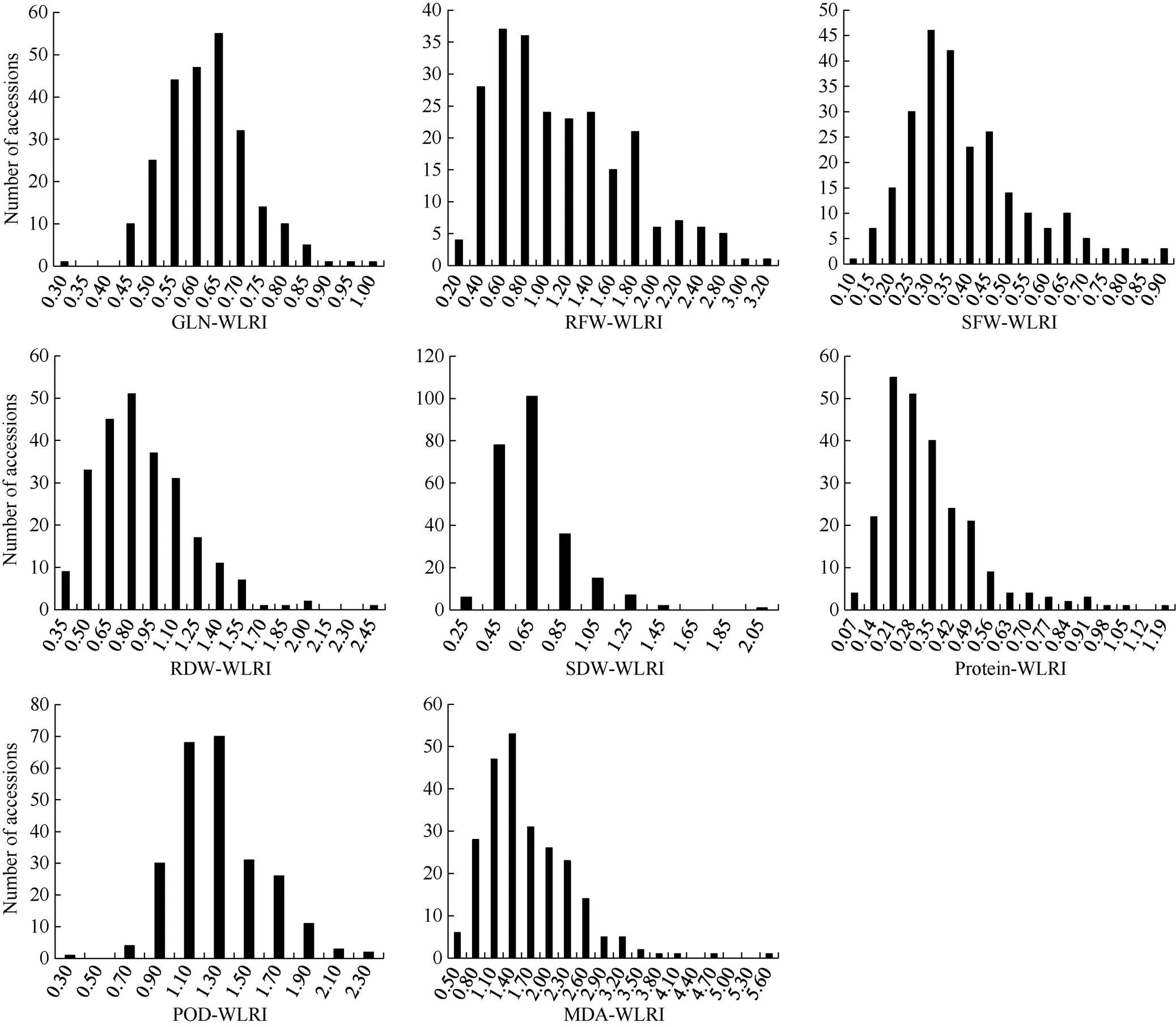
图1 甘蓝型油菜幼苗湿害胁迫响应性状耐湿系数频数分布图
缩写同表1。Abbreviations are the same as those given in Table 1.
2.2 亲缘关系和群体结构
由图2可知, 91%的材料间的亲缘系数小于0.2, 其中亲缘系数为0的材料占56%。由此可见, 试验材料间的亲缘关系较弱。
由群体结构分析结果(图3)可知, 当=2时,D有最大值, 试验材料可分为2个亚群(P1和P2), 如图4所示。将Q矩阵的临界值设为0.7, 其中16个材料属于P1亚群, 大多数为来源于丹麦、加拿大和中国的春性甘蓝型油菜; 168个材料属于P2亚群, 大多数为来源于中国的冬性或半冬性甘蓝型油菜。64个材料位于P1亚群与P2亚群之间, 大多数为来源于中国的半冬性甘蓝型油菜。
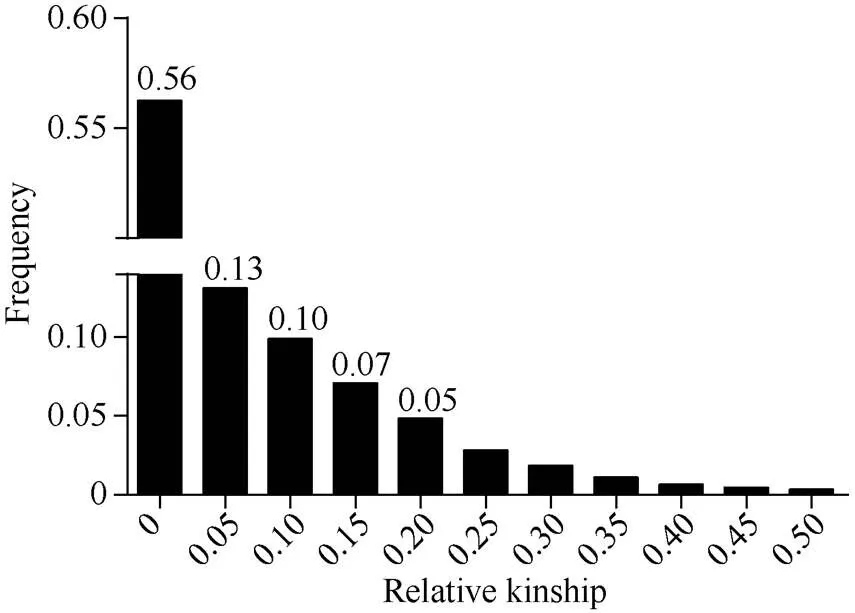
图2 248份甘蓝型油菜品种(系)的亲缘系数频率分布图

图3 2个连续K值所对应的后验概率的变化速率(DK)

图4 248份甘蓝型油菜品种(系)群体结构分布图
2.3 LD分析
连锁不平衡分析LD (2)平均值与遗传距离(Mb)之间的变化如图5所示, 当2阈值设为0.2时, 估算的各染色体衰减距离如表2所示。由图5和表2可知, A亚基因组的衰减速率较C亚基因组快。
2.4 关联分析
为了较好地控制关联分析的假阳性和假阴性, 利用32,839个有效SNP位点, 基于naïve、Q、PCA、K、K+Q和K+PCA 六种模型对湿害胁迫响应的8个性状进行关联分析, 结果如图6、图7和表3所示。根据各性状的WLRI, 基于6种模型的-lg()观察值与期望值的接近程度, 选择最佳模型。最终, SDW和RFW的最佳模型为Q模型, SFW和GLN的最佳模型为PCA模型, RDW的最佳模型为K+Q模型, POD、MDA和Protein的最佳模型为K+PCA模型。
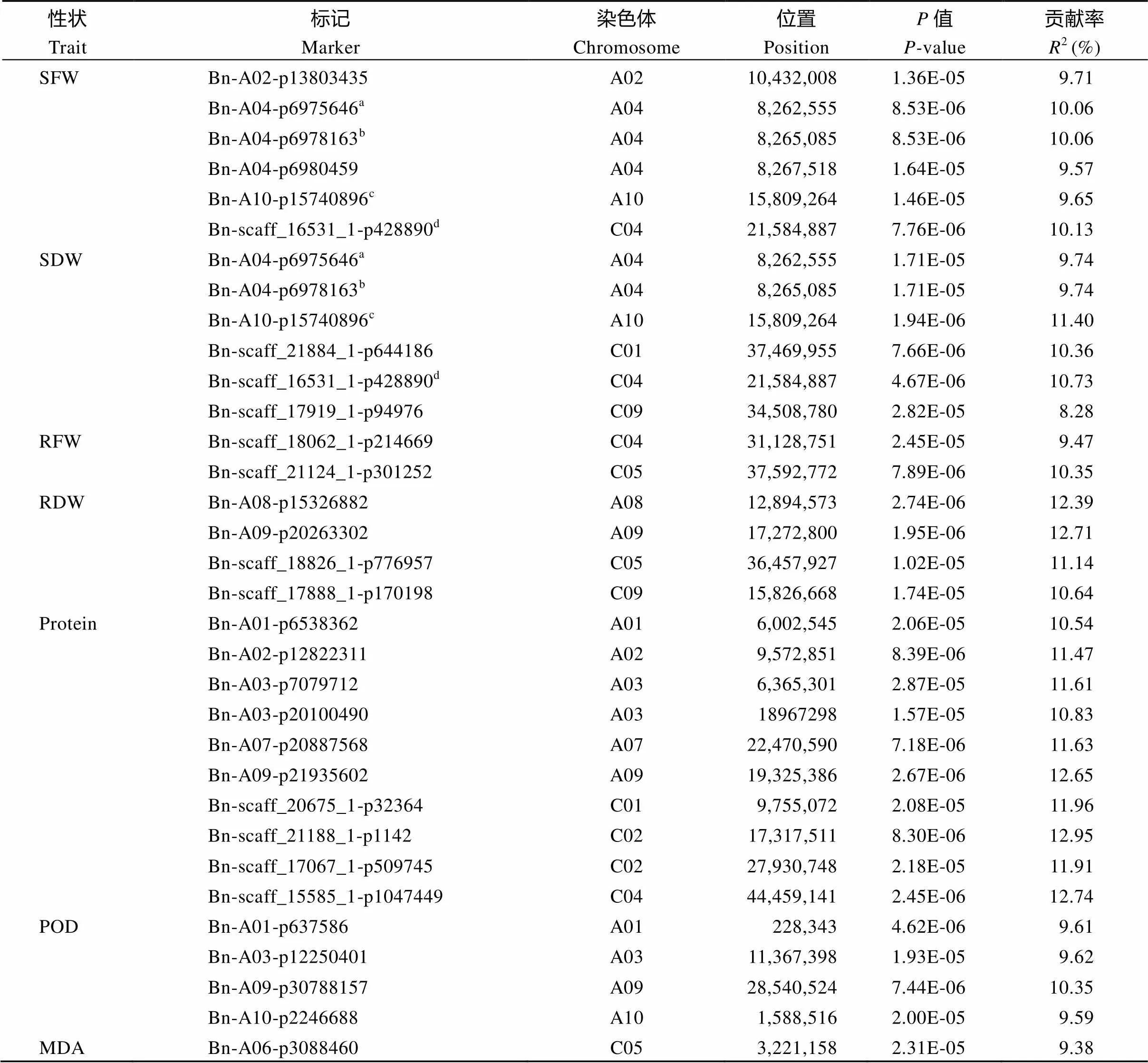
对各性状WLRI共筛选到36个显著相关的SNP位点, 分布在A01、A02、A03、A04、A07、A08、A09、A10、C01、C02、C03、C04、C05、C07、C09等15条染色体上, 可解释的表型变异为8.28%~ 12.95% (表3)。对SFW-WLRI与SDW-WLRI检测到4个相同的显著关联SNP位点(Bn-A04-p6975646、Bn-A04-p6978163、Bn-A10-p15740896和Bn-scaff_ 16531_1-p428890), 与SFW-WLRI显著关联的Bn- A04-p6980459、Bn-A04-p6975646和Bn-A04-p6978163位于同一LD区间, 与GLN-WLRI显著关联的Bn- scaff_20901_1-p1110262和Bn-A06-p3088460位于同一LD区间。
测验结果显示, 17个SNP标记(后续称为显著性SNP标记)所关联的WLRI在不同的SNP基因型间具有显著(<0.05)或极显著(<0.01)的差异(表4)。
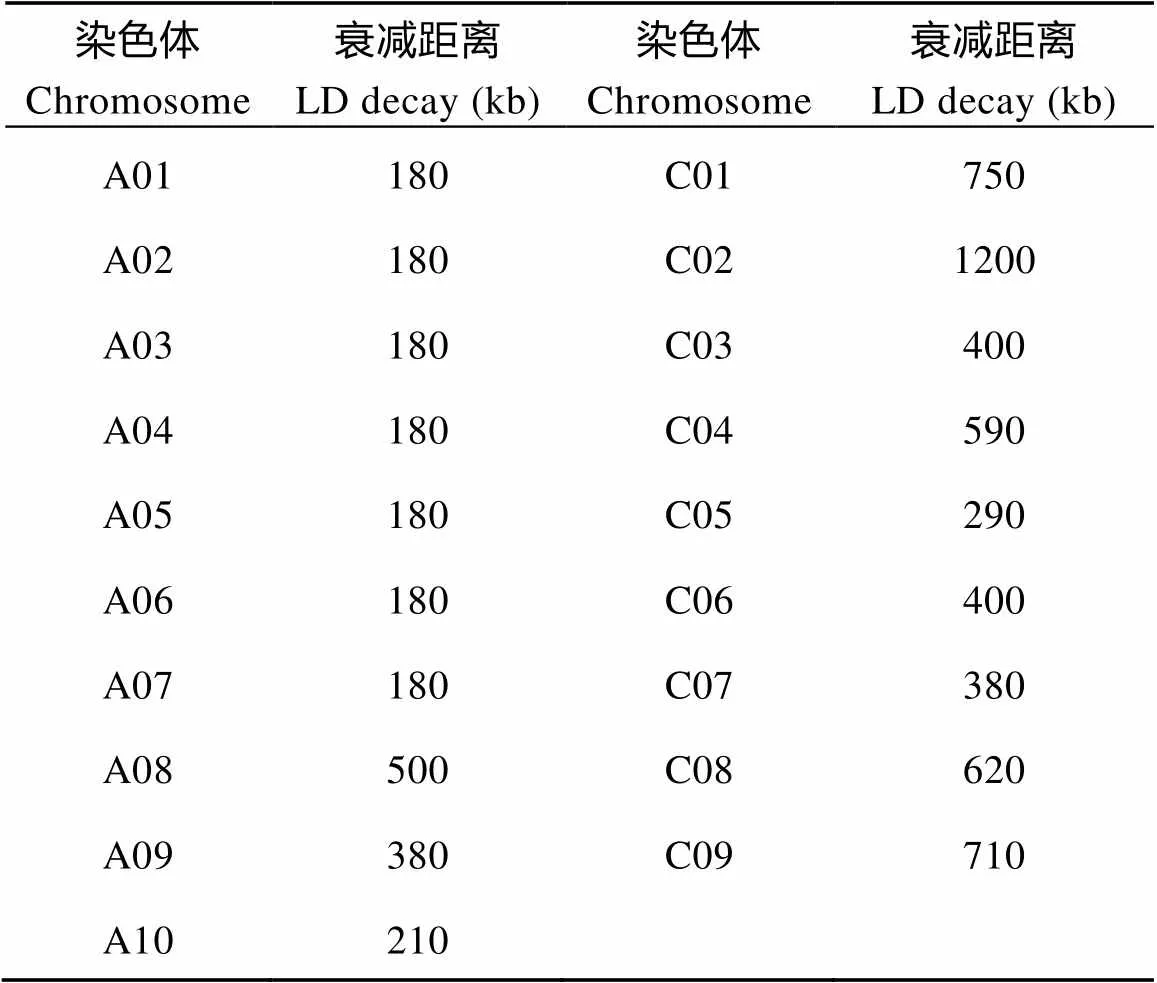
表2 甘蓝型油菜各染色体的衰减距离

图5 甘蓝型油菜染色体连锁不平衡衰减曲线
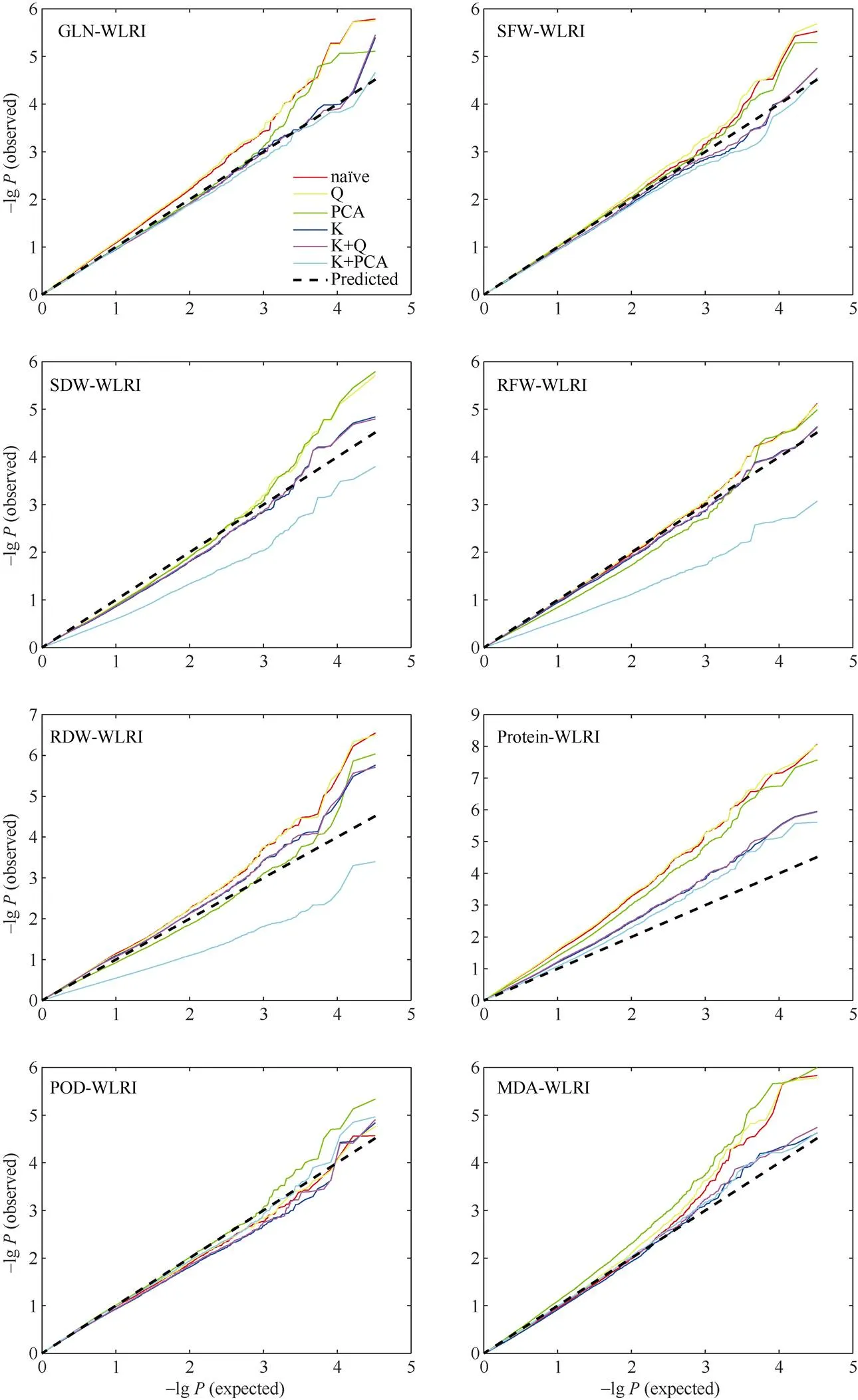
图6 甘蓝型油菜湿害胁迫响应性状耐湿系数基于6种模型的关联分析QQ图
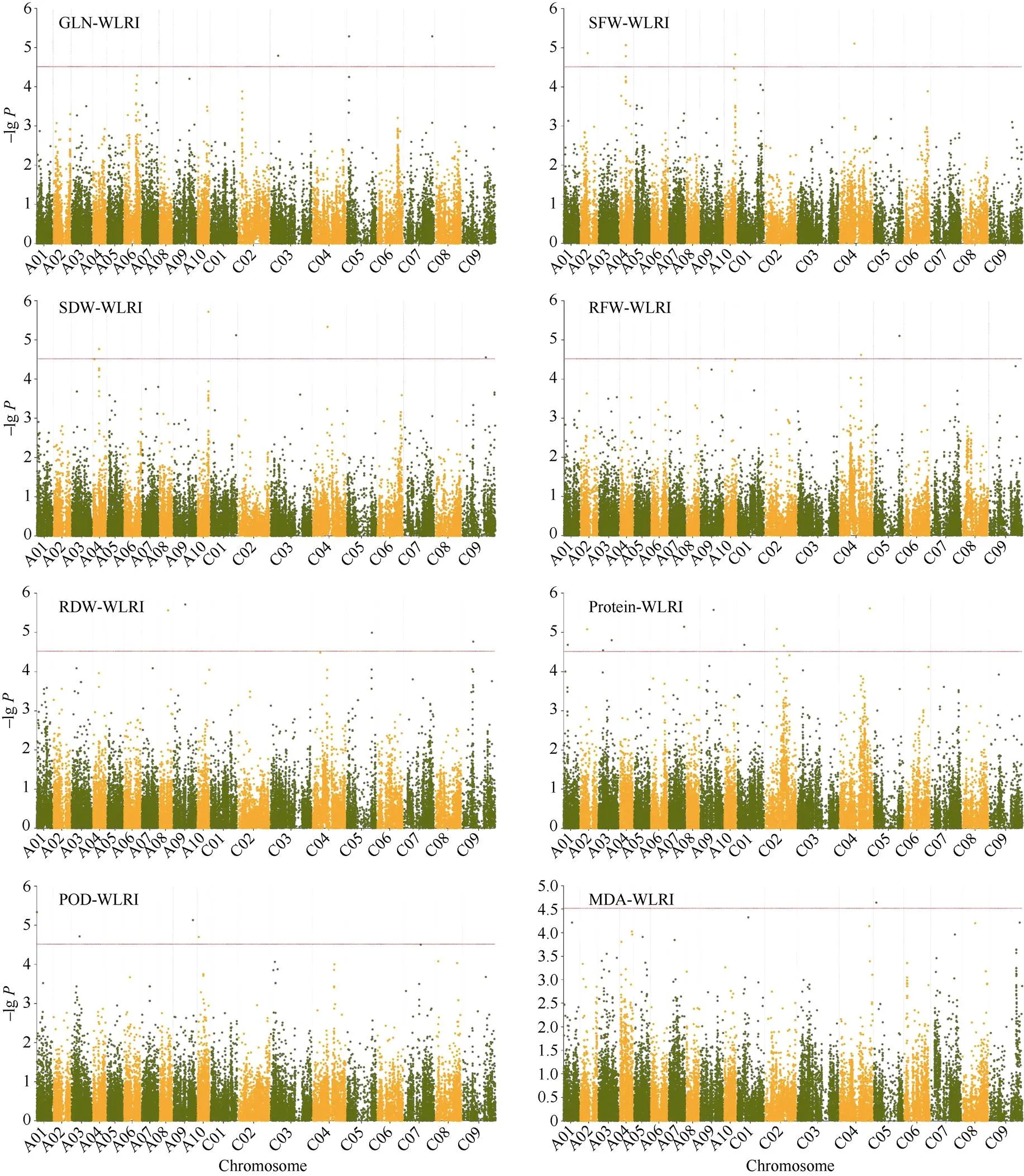
图7 甘蓝型油菜湿害胁迫响应性状耐湿系数基于最佳模型关联分析的Manhattan图

表3 甘蓝型油菜湿害胁迫响应性状WLRI显著关联的SNP标记
(续表3)
a、b、c、d标注的为对不同湿害胁迫响应性状耐湿系数关联分析所检测到的相同SNP位点。缩写同表1。
The SNPs marked with a, b, c, d were identified by GWAS for WLRI of different waterlogging-responding traits. Abbreviations are the same as those given in Table 1.

表4 甘蓝型油菜湿害胁迫响应性状显著关联SNP标记不同基因型的耐湿系数

(续表4)

(续表4)
括号内数值为具有此类基因型的材料数; 同一SNP标记下不同基因型间的耐湿系数, 标有不同大写字母表示差异达到1%显著水平, 标有不同小写字母表示差异达到5%显著水平。缩写同表1。
The value in bracets is the number of materials with such genotypes. Under the same SNP marker, the WLRIs between different genotypes are marked with different capital letters indicating the difference reached the significant probability level of 1%, and those with different lowercase letters indicating the difference reached the significant probability level of 5%. Abbreviations are the same as those given in Table 1.
2.5 单倍型分析
对17个显著性标记所在LD区间的SNP进行单倍型分析表明, 显著性标记Bn-A02-p13803435、Bn-A09- p20263302、Bn-A09-p21935602、Bn-A10- p15740896、Bn-scaff_16531_1-p428890、Bn-scaff_ 17919_1-p94976、Bn-A06-p3088460和Bn-scaff_18062_1-p214669与至少1个SNP标记位于同一Block, 显著性标记Bn- A04-p6975646、Bn-A04-p6978163和Bn-A04- p6980459与其他7个SNP位于同一个72 kb跨度的Block, Bn-A03-p7079712、Bn-A03-p11122273、Bn-scaff_21884_1-p644186、Bn-A09-p30788157、Bn-scaff_23954_1-p1045541和Bn-scaff_20901_1- p1110262未与其他SNP形成Block (图8)。由于在后续分析中未筛选到候选基因, 因此Bn-A03- p11122273、Bn-scaff_17919_1-p94976和Bn-scaff_ 21884_1-p644186未在图8中列出。
2.6 候选基因预测
显著性标记所在Block区间共包含71个候选基因(图8和表5), 其中、、、、、和共7个未Blast到同源的拟南芥基因, 其余64个均可通过同源的拟南芥基因注释预测其功能, 它们主要编码转录因子(如, transcription initiation factor IIF;, bZIP68;, myb-like HTH transcriptional regulator family protein), 转运蛋白(如, SUC2),液泡蛋白质分拣蛋白[如, vacuolar protein sorting 41 (VPS41)], 生长抑制子(如, ING2), DNA/RNA结合蛋白[如和, basic helix-loop-helix (bHLH) DNA-binding superfamily protein;, RNA-binding (RRM/RBD/ RNP motifs) family protein], 酶类(如, protein phosphatase 2C family protein;, UDP-glucose 6-dehydrogenase family protein;, HXXXD-type acyl-transferase family protein;, saccharopine dehydrogenase;, alpha/beta-Hydrolases superfamily protein), 激素响应蛋白[如, SAUR- like auxin-responsive protein family;, auxin response factor 8 (ARF8);, arginine decarboxylase 2 (ADC2);, nuclear factor Y (NF-YC9)], 氧化胁迫、渗透胁迫、盐胁迫或水分剥夺响应蛋白[如, EARLY RESPONSE TO DEHYDRATION 6 (ERD6);, NPK1-related protein kinase 1 (NP1);, TIR-NBS-LRR;, calreticulin 1b (CRT1b)]等。和所编码的蛋白功能未知。
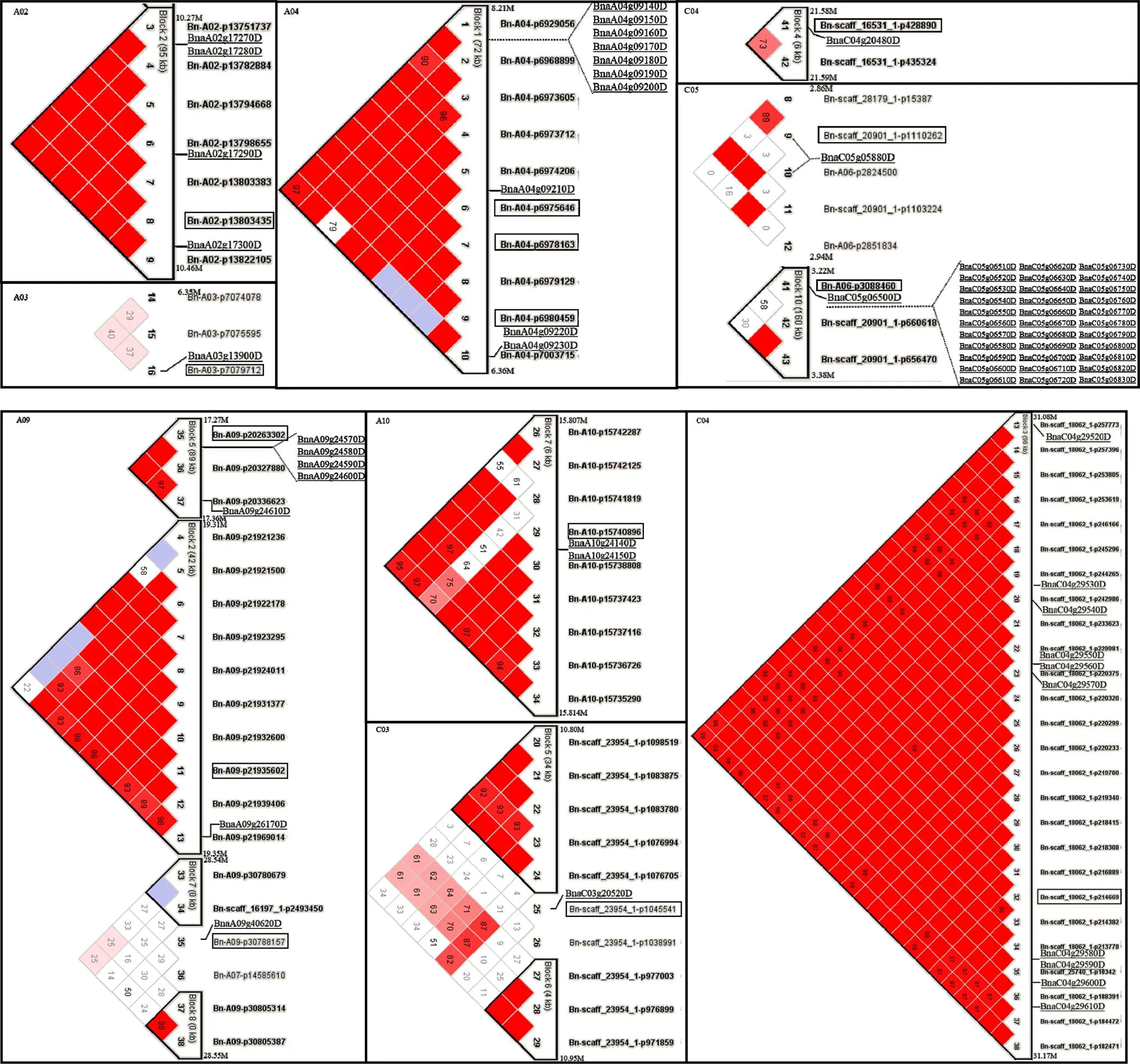
图8 显著性标记所在的Blocks及候选基因
显著性标记用黑色边框标示, 候选基因用下画线标示。
Significant markers are marked with black border and the candidate genes are underlined.
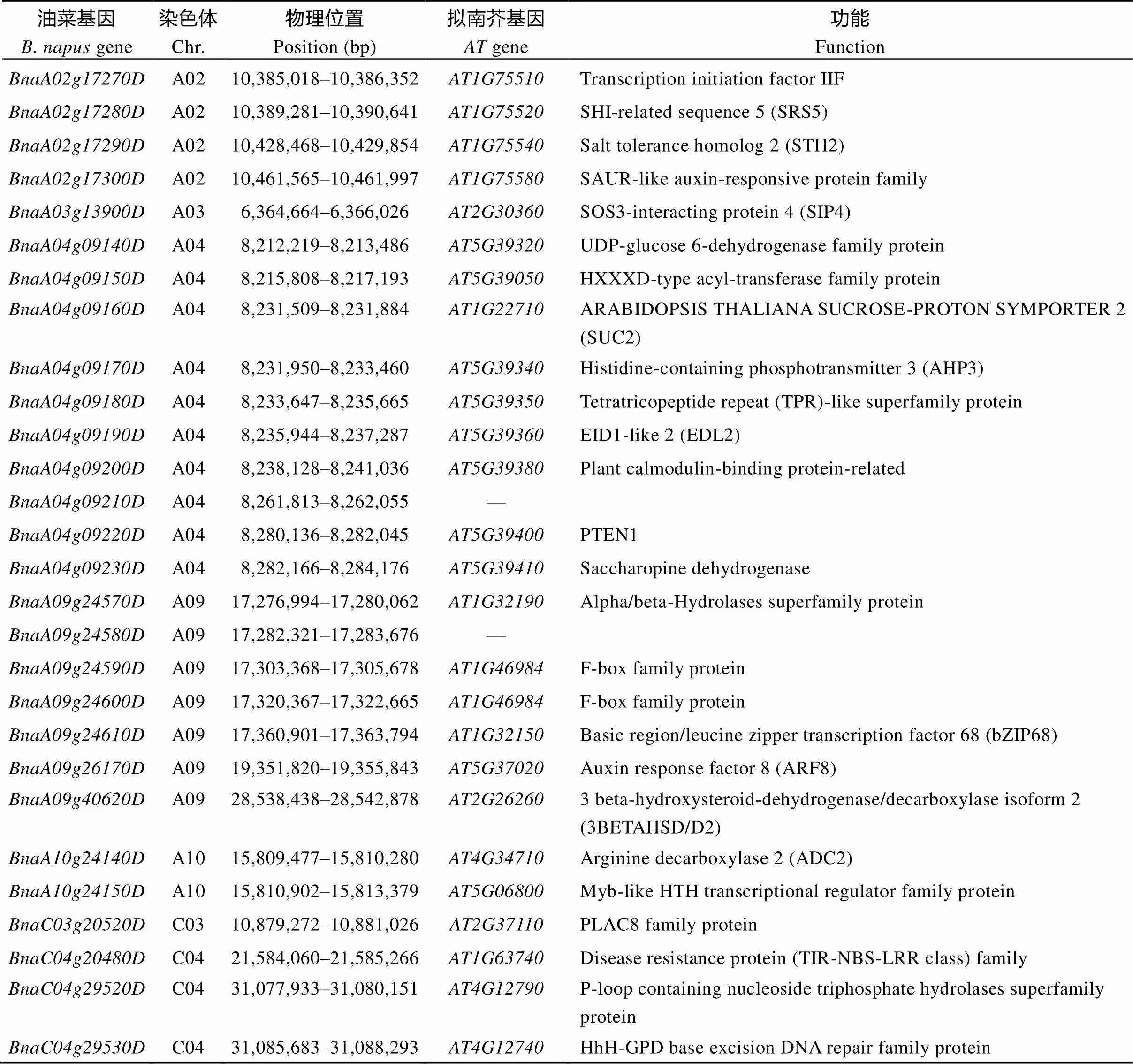
表5 甘蓝型油菜湿害胁迫响应性状耐湿系数候选基因相关信息
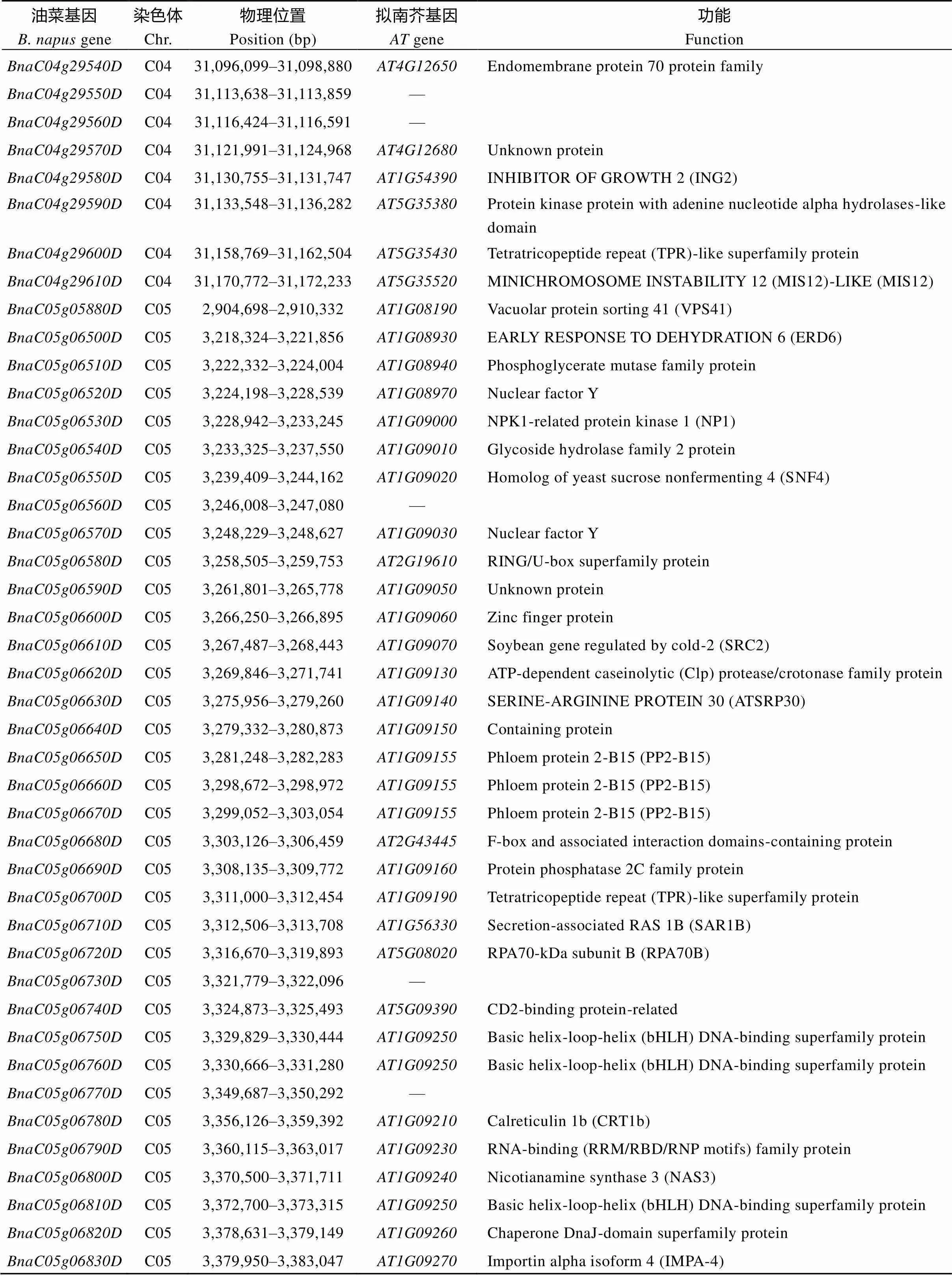
(续表5)
3 讨论
张学昆等[15]研究发现, 油菜苗期湿害处理使植株变得矮小, 叶片发黄, 茎秆纤细, 可溶性糖和丙二醛含量升高, SOD酶活性增强, 而POD酶活性在耐湿材料中显著提高, 在湿害敏感材料中显著降低。李浩杰等[27]认为, 湿害胁迫抑制了油菜生长, 使得根冠比、根干重下降。李真等[11]对油菜DH群体苗期的耐湿性鉴定发现, 湿害胁迫后各家系的根干重、地上部干重都较正常灌溉组下降。涂玉琴等[28]研究发现甘蓝型油菜幼苗的绿叶数在湿害胁迫后明显减少, 黄叶数增加, 地上部鲜重和干重显著低于对照。本研究结果显示, 湿害胁迫后, 甘蓝型油菜幼苗绿叶数减少, 地上部鲜重、干重均降低, POD酶活性和MDA含量升高, 这与前人研究结果基本一致。
陈龙等[29]认为植物在遭受逆境胁迫时, 一些原有的蛋白质合成受到抑制, 逆境蛋白被诱发合成以提高植物的耐胁迫能力。湿害胁迫对油菜幼苗可溶性蛋白含量的影响, 前人的研究结果不尽一致。范其新[30]研究发现湿害胁迫前后油菜幼苗的可溶性蛋白含量变化不大。张学昆等[15]发现湿害处理使油菜幼苗可溶性蛋白含量升高。在薛远超[31]研究中, 湿害胁迫下油菜苗期可溶性蛋白含量耐湿系数为0.68~1.44, 说明在有的材料中可溶性蛋白含量升高, 而有的材料降低。陈娟妮等[18]对长江流域主要甘蓝型油菜品种苗期耐湿性鉴定发现, 湿害使可溶性蛋白有不同程度的降低, 本研究的结果与此一致。湿害胁迫下, 可溶性蛋白含量的变化可能与试验材料的耐湿性强弱、湿害胁迫程度和时间有关。本研究的湿害胁迫时间为4周, 可能由于多数材料可溶性蛋白的分解加剧, 合成受阻, 导致可溶性蛋白含量有所降低。
李真等[11]和涂玉琴等[28]发现, 湿害胁迫后油菜幼苗地下部鲜重和干重均显著低于对照, 而薛远超[31]对油菜苗期进行淹水处理(保持水面高于土面3 cm), 发现不同材料地下部干重耐湿系数为0.24~3.91, 平均为1.03, 说明大多数材料在受到湿害胁迫后地下部干重会增加。本研究的结果与此一致, 其可能原因是本研究的湿害胁迫处理土壤表面无积水, 对部分耐湿性强的材料根系生长抑制较小, 且受到湿害胁迫后形成了部分不定根, 使根的总量超过了正常灌溉的对照。李真等[11]也发现油菜DH群体受到淹水处理后部分耐湿性强的株系植株下胚轴接近水表面处形成了许多不定根。
本研究对8个湿害胁迫响应性状的耐湿系数进行全基因组关联分析, 共检测到36个显著相关的SNP位点, 可解释8.28%~12.95%的表型变异, 其中17个显著性标记所关联的耐湿系数在不同的SNP基因型间具有显著(<0.05)或极显著(<0.01)的差异, 而其余19个差异不显著, 原因可能是关联分析所采用的阈值(1/32,839)对于某些性状偏高, 导致出现假阳性的关联位点。17个显著性标记所在的Blocks覆盖了71个候选基因, 其中64个可通过同源的拟南芥基因注释预测其功能。有研究表明, ARF8为根生长发育调控所必须, 参与生长素激活的信号通路[32], 精氨酸脱羧酶ADC2响应ABA、JA、冷胁迫、渗透胁迫、氧化胁迫、盐胁迫、机械损伤等[33], TIR- NBS-LRR蛋白具有应激响应和信号传导功能[34], ERD6响应ABA、盐胁迫和水分剥夺[35], NF-YC9参与脱落酸激活和赤霉素介导的信号通路[36], NPK1- related protein kinase 1 (NP1)响应氧化胁迫[37], CRT1b响应氧化胁迫和盐胁迫[38-39]。它们对应的甘蓝型油菜同源基因在本研究中都被预测到。许多研究发现, miRNA和可变剪接在湿害胁迫响应过程中具有重要作用, Zou等[40]对甘蓝型油菜苗期湿害胁迫下根部转录组分析检测到了一系列“DNA/RNA binding”基因。本研究检测到了3个DNA binding候选基因和1个RNA binding候选基因。根据这些候选基因注释的功能可以推测, 甘蓝型油菜可能通过miRNA或可变剪接调控、转录因子调控、生长调节、激素响应及一系列酶类和功能蛋白等响应湿害胁迫, 同时也可能存在与其他非生物胁迫和应激响应相关的基因参与湿害胁迫响应过程。本研究筛选的与甘蓝型油菜湿害胁迫响应性状显著关联的分子标记和候选基因, 为进一步进行基因功能验证、阐释湿害胁迫响应机制奠定了基础, 将有助于耐湿品种的培育。
4 结论
湿害胁迫较正常灌溉, 油菜幼苗绿叶数减少, 地上部干重和鲜重以及叶片可溶性蛋白含量降低, 叶片POD酶活性和MDA含量略有升高。地下部干重和鲜重在多数材料中降低, 而在有些材料中升高, 变化幅度均较小。共检测到与耐湿系数显著关联的SNP标记36个。17个所关联的耐湿系数在基因型间具有显著(<0.05)或极显著(<0.01)差异, 其所在的Blocks共覆盖71个候选基因, 其中64个Blast到同源拟南芥基因, 主要编码转录因子、转运蛋白、生长抑制子、蛋白磷酸酶、DNA/RNA结合蛋白、激素响应蛋白以及氧化胁迫、渗透胁迫、盐胁迫或水分剥夺响应蛋白等。
[1] 王三根. 植物抗性生理与分子生物学. 北京: 现代教育出版社, 2009. pp 211–226. Wang S G. Plant Hardiness Physiology and Molecular Biology. Beijing: Modern Education Press, 2009. pp 211–226 (in Chinese).
[2] Levitt J. Responses of Plants to Environmental Stresses, Volume II: Water, radiation, salt, and other stresses. New York: Academic Press, 1980. pp 213–228.
[3] 刘友良. 植物水分逆境生理. 北京: 农业出版社, 1992. pp 144–177. Liu Y L. Plant Water Stress Physiology. Beijing: Agriculture Press, 1992. pp 144–177 (in Chinese).
[4] 李真. 甘蓝型油菜苗期耐湿性和抗旱性相关QTL分析. 华中农业大学硕士学位论文, 湖北武汉, 2008. Li Z. Study on QTL Associated with Waterlogging Tolerance and Drought Resistance during Seedling Stage inL. MS Thesis of Huazhong Agricultural University, Wuhan, Hubei, China, 2008 (in Chinese with English abstract).
[5] 蔡士宾, 曹旸, 方先文. 小麦耐湿性变异及其配合力分析. 江苏农业学报, 1996, 12(3): 1–5. Cai S B, Cao Y, Fang X W. Studies on the variability and combining ability of waterlogging tolerance in common wheat., 1996, 12(3): 1–5 (in Chinese with English abstract).
[6] 魏凤珍, 李金才, 董琦. 孕穗期至抽穗期湿害对耐湿性不同品种冬小麦光合特性的影响. 植物生理学通讯, 2000, 36(2): 119–122. Wei F Z, Li J C, Dong Q. Effects of waterlogging at booting and heading stages on photosynthetic characteristics in different varieties of wet-resistant winter wheat., 2000, 36(2): 119–122 (in Chinese with English abstract).
[7] 李金才, 董琦, 余松烈. 不同生育期根际土壤淹水对小麦品种光合作用和产量的影响. 作物学报, 2001, 27: 434–441. Li J C, Dong Q, Yu S L. Effect of waterlogging at different growth stages on photosynthesis and yield of different wheat cultivars., 2001, 27: 434–441 (in Chinese with English abstract).
[8] 吕军. 渍水对冬小麦生长的危害及其生理效应. 植物生理学报, 1994, 20: 221–226. Lyu J. The injury to winter wheat growth by soil waterlogging and its mechanism., 1994, 20: 221–226 (in Chinese with English abstract).
[9] 张舟, 朱谨文. 成都地区油菜产业发展现状及对策分析. 四川农业科技, 2013, (6): 12–13. Zhang Z, Zhu J W. Present situation and countermeasure analysis of rapeseed industry development in Chengdu area., 2013, (6): 12–13 (in Chinese).
[10] 郭燕枝, 杨雅伦, 孙君茂. 我国油菜产业发展的现状及对策. 农业经济, 2016, (7): 44–46. Guo Y Z, Yang Y L, Sun J M. Present situation and countermeasures of rapeseed industry development in China., 2016, (7): 44–46 (in Chinese).
[11] 李真, 蒲圆圆, 高长斌, 周广生, 涂金星, 傅廷栋. 甘蓝型油菜DH群体苗期耐湿性的评价. 中国农业科学, 2010, 43: 286–292. Li Z, Pu Y Y, Gao C B, Zhou G S, Tu J X, Fu T D. Evaluation of waterlogging tolerance in rapeseed (L.) DH lines at seedling stage., 2010, 43: 286–292 (in Chinese with English abstract).
[12] Crawford R M M. Oxygen availability as an ecological limit to plant distribution., 1992, 23: 93–185.
[13] Justin S H F W, Armstrong W. The anatomical characteristics of toots and plant response to soil flooding., 1987, 106: 465–495.
[14] Sachs M M, Subbaiah C C, Saab I N. Anaerobic gene expression and flooding tolerance in maize., 1996, 47: 1–15.
[15] 张学昆, 范其新, 陈洁, 李加纳, 王汉中. 不同耐湿基因型甘蓝型油菜苗期对缺氧胁迫的生理差异响应. 中国农业科学, 2007, 40: 485–491. Zhang X K, Fan Q X, Chen J, Li J N, Wang H Z. Physiological reaction differences of different waterlogging-tolerant genotype rapeseed (L.) to anoxia., 2007, 40: 485–491 (in Chinese with English abstract).
[16] 卢长明, 龚学明. 缺氧条件下油菜种子发芽特性的遗传参数研究. 江西农业大学学报, 1989, 11(4): 23–26. Lu C M, Gong X M. Study on the genetic parameters of germination characteristics of rapeseeds (L.)., 1989, 11(4): 23–26 (in Chinese with English abstract).
[17] 范其新, 张学昆, 谌利, 李加纳. 缺氧对甘蓝型黄籽与黑籽油菜发芽的影响. 中国油料作物学报, 2005, 27(3): 84–87. Fan Q X, Zhang X K, Chen L, Li J N. Effects of anoxic condition on germination of the yellow and black-seeded lines inL., 2005, 27(3): 84–87 (in Chinese with English abstract).
[18] 陈娟妮, 梁颖. 长江流域主要甘蓝型油菜品种苗期耐湿性鉴定. 中国生态农业学报, 2011, 19: 626–630. Chen J N, Liang Y. Determining rapeseed tolerance to waterlogging at seedling stage in the Yangtze River basin., 2011, 19: 626–630 (in Chinese with English abstract).
[19] 丛野, 程勇, 邹崇顺, 张学昆, 王汉中. 甘蓝型油菜发芽种子耐湿性的主基因+多基因遗传分析. 作物学报, 2009, 35: 1462–1467. Cong Y, Cheng Y, Zou C S, Zhang X K. Wang H Z. Genetic analysis of waterlogging tolerance for germinated seeds of rapeseed (L.) with mixed model of major gene plus polygene., 2009, 35: 1462–1467 (in Chinese with English abstract).
[20] 邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2003. pp 129–130. Zou Q. Plant Physiology Experiment Instruction. Beijing: China Agriculture Press, 2003. pp 129–130 (in Chinese).
[21] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000. pp 260–261. Li H S. Experimental Principles and Techniques of Plant Physiology and Biochemistry. Beijing: Higher Education Press, 2000. pp 260–261 (in Chinese).
[22] Qu C M, Jia L D, Fu F Y, Zhao H Y, Lu K, Wei L J, Xu X F, Liang Y, Li S M, Wang R. Genome-wide association mapping and identification of candidate genes for fatty acid composition inL. using SNP markers., 2017, 18: 232. doi: 10.1186/s12864-017-3607-8.
[23] Bradbury P J, Zhang Z, Kroon D E, Casstevens T M, Ramdoss Y, Buckler E S. TASSEL: software for association mapping of complex traits in diverse samples., 2007, 23: 2633–2635.
[24] Evanno G, Regnaut S, Goudet J. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study., 2005, 14: 2611–2620.
[25] Yu J, Pressoir G, Briggs W H, Vroh B I, Yamasaki M, Doebley J F, McMullen M D, Gaut B S, Nielsen D M, Holland J B, Kresovich S, Buckler E S. A unified mixed-model method for association mapping that accounts for multiple levels of relatedness., 2006, 38: 203–208.
[26] Barrett J C, Fry B, Maller J, Daly M J. Haploview: analysis and visualization of LD and haplotype maps., 2005, 21: 263–265.
[27] 李浩杰, 张雪花, 蒲晓斌, 张锦芳, 蒋俊, 柴靓, 蒋梁材. 甘蓝型油菜对田间模拟湿害胁迫的生理响应. 西南农业学报, 2013, 26(1): 84–88.Li H J, Zhang X H, Pu X B, Zhang J F, Jiang J, Chai L, Jiang L C. Physiological reaction of field waterlogging treatment inL., 2013, 26(1): 84–88 (in Chinese with English abstract).
[28] 涂玉琴, 汤洁, 涂伟凤, 戴兴临, 张弢. 甘蓝型油菜与蔊菜属间杂种后代的苗期耐湿性综合评价. 植物遗传资源学报, 2015, 16: 895–902. Tu Y Q, Tang J, Tu W F, Dai X L, Zhang T. Comprehensive evaluation of waterlogging tolerance of progenies betweenL. and(L.) Hiern., 2015, 16: 895–902 (in Chinese with English abstract).
[29] 陈龙, 王贤. 植物水分胁迫诱导蛋白的特性和功能. 生物学教学, 2003, 28(11): 2–3. Chen L, Wang X. Characteristics and functions of proteins induced under water stress in plant., 2003, 28(11): 2–3 (in Chinese).
[30] 范其新. 甘蓝型油菜耐湿品种资源筛选及耐湿机理研究. 西南农业大学硕士学位论文, 重庆, 2005. Fan Q X. Identification ofL. of High Tolerance to Waterlogging and Research on Physiological Adaptability Mechanism to Anaerobiosis. MS Thesis of Southwest Agricultural University. Chongqing, China, 2005 (in Chinese with English abstract).
[31] 薛远超. 甘蓝型油菜EMS诱变材料的耐湿性鉴定与筛选. 西南大学硕士学位论文, 重庆, 2011. Xue Y C. Indentification and Screening of Waterlogging Tolerance inMutated by EMS. MS Thesis of Southwest University, Chongqing, China, 2011 (in Chinese with English abstract).
[32] Wang Y, Li K, Chen L, Zou Y, Liu H, Tian Y, Li D, Wang R, Zhao F, Ferguson B J, Gresshoff P M, Li X. Micro RNA167-Directed regulation of the auxin response factorsandis required for soybean nodulation and lateral root development., 2015, 168: 984–999.
[33] Alvarez-Gerding X, Espinoza C, Inostroza-Blancheteau C, Arce-Johnson P. Molecular and physiological changes in response to salt stress inW. plants overexpressingCBF3/DREB1A., 2015, 92: 71–80.
[34] Jens S, Maria K, Svante B, Christina D. Transgressive segregation reveals twoTIR-NB-LRR resistance genes effective against, causal agent of blackleg disease., 2006, 46: 218–230.
[35] Kohji Y, Yuriko O, Junya M, Kazuo N, Yasunari F, Kazuo S, Kazuko Y S. Functional analysis of anabiotic stress-inducible facilitated diffusion transporter for monosaccharides., 2010, 285: 1138–1146.
[36] Bi C, Ma Y, Wang X F, Zhang D P. Overexpression of the transcription factor NF-YC9 confers abscisic acid hypersensitivity in., 2017, 95: 425–439.
[37] Kovtun Y, Chiu W L, Tena G, Sheen J. Functional analysis of oxidative stress-activated mitogen-activated protein kinase cascade in plants., 2000, 97: 2940–2945.
[38] Kim J H, Nguyen N H, Nguyen N T, Hong S W, Lee H. Loss of all three calreticulins, CRT1, CRT2 and CRT3, causes enhanced sensitivity to water stress in., 2013, 32: 1843–1853.
[39] Hironori K, Keiko F, Yuki T, Atsushi O, Shunji S. ER stress-induced protein, VIGG, disturbs plant cation homeostasis, which is correlated with growth retardation and robustness to ER stress., 2011, 405: 514–520.
[40] Zou X L, Tan X Y, Hu C W, Zeng L, Lu G Y, Fu G P, Cheng Y, Zhang X K. The transcriptome ofL. roots under waterlogging at the seedling stage., 2013, 14: 2637–2651.
Genome-wide association analysis and candidate genes prediction of waterlogging-responding traits inL.
LI Yang-Yang1,2,3,**, JING Rong-Rong1,3,**, LYU Rong-Rong1,2,3, SHI Peng-Cheng1,2,3, LI Xin1,2,3, WANG Qin1,2,3, WU Dan1,2,3, ZHOU Qing-Yuan1,3, LI Jia-Na1,2,3, and TANG Zhang-Lin1,2,3,*
1College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China;2Academy of Agricultural Sciences, Southwest University,Chongqing 400715, China;3Chongqing Engineering Research Center for Rapeseed, Chongqing 400715, China
The yield and quality of rapeseed are significantly affected by waterlogging. Many researches on waterlogging of rapeseed mostly aimed at its mechanism and physiological response, but a few of them identified the genes related to waterlogging. In this study, 248L. accessions were planted in flowerpots with treatments of waterlogging and well watering for four weeks when the plants had four true leaves in rain-proof installation, and eight waterlogging-responding traits were investigated. The genome-wide association analysis was carried out based on 60K Illumina Infinium SNP genotype data and the candidate genes associated with waterlogging responses were predicted. Under waterlogging, the number of green leaf, the shoot fresh weight and dry weight, the leaf soluble protein content were lower, and the leaf POD activity, the MDA content were higher than those under well watering. The root fresh weight and dry weight were lower in most accessions and higher in some accessions under waterlogging stress. A total of 36 SNPs were identified associated with waterlogging traits and explained the phenotypic variation of 8.28%–12.95%. There were significant (< 0.05) or extremely significant (< 0.01) differences in the waterlogging resistance index among genotypes of 17 SNPs. The Blocks containing 17 SNPs covered 71 candidate genes. Among them, 64 candidate genes were homologous togenes by blast. They encoded transcription factors (e.g. transcription initiation factor IIF, bZIP68, myb-like HTH transcriptional regulator family protein), transport protein (e.g. SUC2), inhibitor of growth (e.g. ING2), protein phosphatase (e.g. protein phosphatase 2C family protein), DNA/RNA binding proteins [e.g. bHLH DNA-binding superfamily protein, RNA-binding (RRM/RBD/RNP motifs) family protein], hormone response proteins (e.g. ARF8, ADC2, ERD6, NF-YC9), oxidative/osmotic/cold stress or water deprivation response proteins (e.g. ERD6, NP1, TIR-NBS-LRR, CRT1b). These results would be benefit for revealing the waterlogging resistance mechanism and cultivating new varieties with waterlogging resistance inL.
L.; waterlogging-responding traits; genome-wide association analysis; candidate genes
本研究由重庆市社会事业与民生保障科技创新主题专项(cstc2016shms-ztzx80010), 国家重点研发计划项目(2018YFD0100504)和中央高校基本科研业务费专项资金项目(XDJK2019D021)资助。
This study was supported by the Science and Technology Innovation Project of Chongqing Social Undertakings & Livelihood Security (cstc2016shms-ztzx80010), the National Key R&D Program of China (2018YFD0100504) and the Fundamental Research Funds for the Central Universities (XDJK2019D021).
唐章林, E-mail: tangzhlin@swu.edu.cn, Tel: 023-68251264
**同等贡献(Contributed equally to this work)
李阳阳, E-mail: liyangyangswu@163.com; 荆蓉蓉, E-mail: m15525440862@163.com
2019-02-25;
2019-06-24;
2019-07-16.
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20190715.1553.004.html
10.3724/SP.J.1006.2019.94027
