猪繁殖与呼吸综合征病毒抗体间接ELISA检测方法的建立
2019-11-11李群范娟魏荣荣叶正琴丁国伟
李群 范娟 魏荣荣 叶正琴 丁国伟

摘 要:猪感染猪繁殖与呼吸综合征病毒(Porcine Reproductive and Respiratory Syndrome Virus,PRRSV)14 d后就可以产生针对非结构蛋白(Non-Structural Protein 7,Nsp7)的抗体,而且抗体水平很高,与N蛋白抗体水平相似,但比N蛋白抗体持续时间更长。另外,检测Nsp7抗体可用于区分PRRSV I型和II型的感染。本试验旨在建立一种快速、特异且敏感的检测血清中PRRSV抗体的方法。试验根据NCBI数据库录入的Nsp7蛋白序列(GenBank:EF536003)设计引物,利用聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增Nsp7基因,构建原核表达载体pET28a-Nsp7,转化大肠杆菌BL21(DE3)感受态细胞,并诱导重组蛋白表达。利用亲和层析纯化重组蛋白,Western Blot鉴定表达产物。将纯化后的重组蛋白按不同浓度包被酶标板,通过方阵滴定法确定最佳抗原包被浓度及血清稀释度,并对其条件进行优化,最终建立检测PRRSV Nsp7抗体的间接酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay,ELISA)方法。结果表明,试验表达了重组Nsp7蛋白,重组的Nsp7蛋白能与PRRSV阳性血清发生特异性反应,建立了一种基于重组Nsp7蛋白的间接ELISA检测方法。建立的间接ELISA检测方法分别与商品化PRRSV抗体检测试剂盒检测结果相比,两者符合率为87.74%。试验表明,建立的间接ELISA方法可以用于PRRSV抗体的检测。
关键词:猪繁殖与呼吸综合征病毒;Nsp7基因;原核表达;间接酶联免疫吸附测定
中图分类号:S852.65 文献标志码:A 文章编号:1001-0769(2019)08-0012-07
猪繁殖与呼吸障碍综合征(Porcine Reproductive and Respiratory Syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine Reproductive and Respiratory Syndrome Virus,PRRSV)引起的一种高度接触性传染病,主要表现为患病母猪发热、厌食、流产和产死胎、木乃伊胎和弱仔等繁殖障碍以及仔猪严重的呼吸道疾病,具有较高的死亡率[1]。由于病死猪呈特征性的耳朵发绀现象,该病又被称为猪蓝耳病。该病目前存在于我国的大部分省市,给我国的养猪业造成了巨大的经济损失。2006年夏季,我国南方部分省市大规模暴发以高热、高发病率和高死亡率为特征的“猪高热病”,后确诊为高致病性猪蓝耳病,其病原为PRRSV的变异株高致病性猪繁殖与呼吸综合征病毒(Highly Pathogenic Porcine Reproductive and Respiratory Syndrome Virus,HP-PRRSV),与经典的PRRS病毒株相比,以非结构蛋白(Non-Structural Protein 2,Nsp2)中有一个特征性30个氨基酸缺失为特征,具有更强的致病性。后来有研究证明,毒株的毒力增强与Nsp2特征性缺失30个氨基酸无关,目前对其毒力增强的原因尚不清楚[2-3]。病毒变异可能是引起PRRS大规模暴发的原因,也给该病的防治带来了新的挑战。建立快速可靠的PRRSV抗体检测方法,监测PRRS流行病学以及检测猪群接种PRRS疫苗后的抗体水平对该病的预防具有重要意义。
PRRSV属于尼多病毒目动脉炎病毒科动脉炎病毒属,是一种有囊膜的且不分节段的正链单股RNA病毒。PRRSV基因组长为15.1 kb~15.5 kb,含有9个开放阅读框(Open Reading Frame,ORF),分别编码PP1a、PP1ab,GP2a、GP2b、GP3、GP4、GP5、M和N蛋白,其中PP1a经病毒蛋白酶消化分解产生9个非结构蛋白(Nsp1α、Nsp1β、Nsp2~Nsp8),PP1ab经消化分解为4个非结构蛋白(Nsp9~Nsp12)[4]。在上述结构蛋白和非结构蛋白中,N蛋白、GP5蛋白和Nsp7蛋白是检测抗体的重要靶点[5]。其中,针对Nsp7蛋白的抗体产生较早,猪感染PRRSV 14 d后就可以产生针对Nsp7的抗体,而且抗体水平很高,几乎可以达到N蛋白和Nsp2的抗体水平,而且比N蛋白抗体持续时间更長,这表明Nsp7与机体免疫应答关系密切。Nsp7基因在非结构蛋白基因中相对保守,虽然北美型和欧洲型Nsp7氨基酸序列同源性仅有45%,但各型之间的同源性却很高,欧洲型的同源性在96.7%~97.4%,美洲型的同源性为84.9%~100%,这一特点使得Nsp7蛋白成为检测抗原、检测PRRSV抗体水平及区分不同毒株抗体的首选抗原[6-7]。
本研究拟从PRRSV经典株VR2332株基因组中扩增出编码Nsp7蛋白基因片段,重组至表达载体pET-28a(+)中,并进行诱导表达、纯化与鉴定,以表达的Nsp7蛋白为包被抗原建立间接ELISA检测方法,为PRRSV抗体检测试剂盒的研发和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种和载体
E. coli TOP10、E. coli BL21 (DE3)感受态细胞和pET-28a载体,均购于Invitrogen公司。pMD19-T载体购于TaKaRa公司。
1.1.2 病毒和血清
JAX1株和猪PRRSV阳性血清由扬州优邦生物药品有限公司提供。
1.1.3 主要试剂
FastPfu DNA聚合酶、dNTPs、BamH I、Xho I、Trans2K plus DNA marker和Blue plus Protein marker均购自北京全式金生物技术有限公司。质粒提取试剂盒和胶回收试剂盒购自美国Axygen公司。Trizol@ Reagent试剂盒均购自天根生化科技有限公司。HiScript 1st Strand cDNA Synthesis Kit购自南京诺唯赞生物科技有限公司。HRP标记的鼠抗猪IgG酶标二抗和IPTG均购自Sigma公司。其他试剂为分析纯级试剂,购自国药集团化学试剂有限公司。IDEXX PRRS X3试剂盒购自爱德士。
1.2 方法
1.2.1 引物设计与合成
根据GenBank中公布的PRRSV VR2332序列(登入号:EF536003),利用oligo7.27设计引物,引物合成由南京金斯瑞生物科技有限公司负责。
Nsp7-up:CGCGGATCCTCTCTGACTGGTGCCC TCGC。
Nsp7-down:CCGCTCGAGTTATTCCCATTGAACTCTTCCATTC。
1.2.2 PRRSV总RNA提取
按照试剂盒说明书提取总RNA。
1.2.3 PRRSV Nsp7基因片段扩增
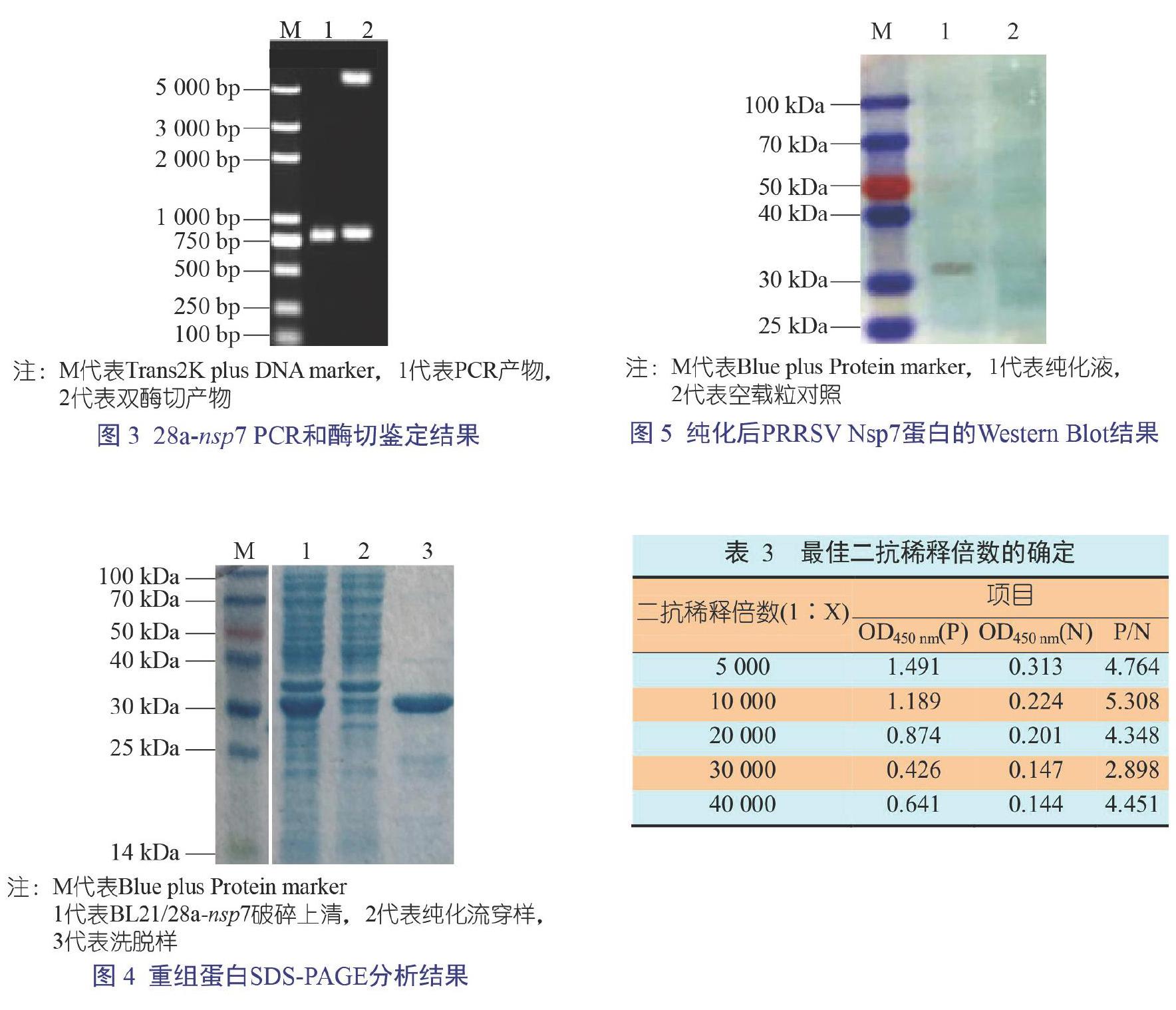
按照试剂盒说明书合成cDNA。以cDNA为模板,Nsp7-up和Nsp7-down为引物,进行聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增。反应体系为:1 ?L模板、1 ?L Nsp7-up、1 ?L Nsp7-down、10 ?L缓冲液、4 ?L dNTPs、1 ?L Fastpfu和32 ?L ddH2O。反应条件为:95 ℃ 2 min,95 ℃ 20 s、60 ℃ 20 s和72 ℃ 45 s,30个循环,72 ℃ 5 min。PCR反应结束后取10 μL进行琼脂糖凝胶电泳,鉴定片段大小。大小合适的PCR产物按照胶回收试剂盒说明进行胶回收。
1.2.4 PRRSV Nsp7基因片段的克隆与鉴定
将经胶回收的目的片段连接到pMD19-T载体上,转化E. coli Top10感受态细胞,获得重组pMD19-Nsp7。将经菌落PCR鉴定正确的单克隆送金斯瑞公司测序。
1.2.5 原核表达系统的构建与鉴定
将测序正确的重组质粒pMD19-Nsp7用 BamH I和Xho I双酶切处理。酶切产物电泳,胶回收目的片段,与进行同样操作的pET-28a进行连接,得到的重组质粒命名为28a-Nsp7。将重组质粒28a-Nsp7转入E. coli BL21 (DE3)感受态细胞,挑去阳性克隆进行菌落PCR和酶切鉴定,鉴定正确的重组菌命名为BL21/28a-Nsp7。
1.2.6 BL21/28a-Nsp7的诱导表达
挑取重组菌BL21/28a-Nsp7单菌落接种到LB培养基(含卡那霉素终浓度100 μg/mL)中,37 ℃、220 r/min,培养至光密度(Oplicald Dnsity,OD)600 nm=0.8左右,加入终浓度为 0.4 mmol/L的IPTG进行诱导,诱导过夜,诱导温度为20 ℃,诱导时转速为150 r/min。
1.2.7 重组蛋白的纯化与鉴定
诱导结束后离心收集菌体,将收集到的菌体用磷酸盐缓冲溶液(Phosphate Buffer Saline,PBS)洗涤2次,并用PBS缓冲液重悬菌体。在冰浴条件下超声波裂解菌体,裂解结束后分别对裂解上清和沉淀取样,并进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,SDS-PAGE)。使用镍柱对重组蛋白进行纯化,纯化步骤为:细胞破碎上清在结合缓冲液中过夜透析,透析液上样过柱(5 mL HisTrap,GE HealthCare),再用结合缓冲液洗涤5个柱体积,最后用洗脱缓冲液洗涤5个柱体积,收集洗脱组分,并用SDS-PAGE蛋白电泳鉴定。
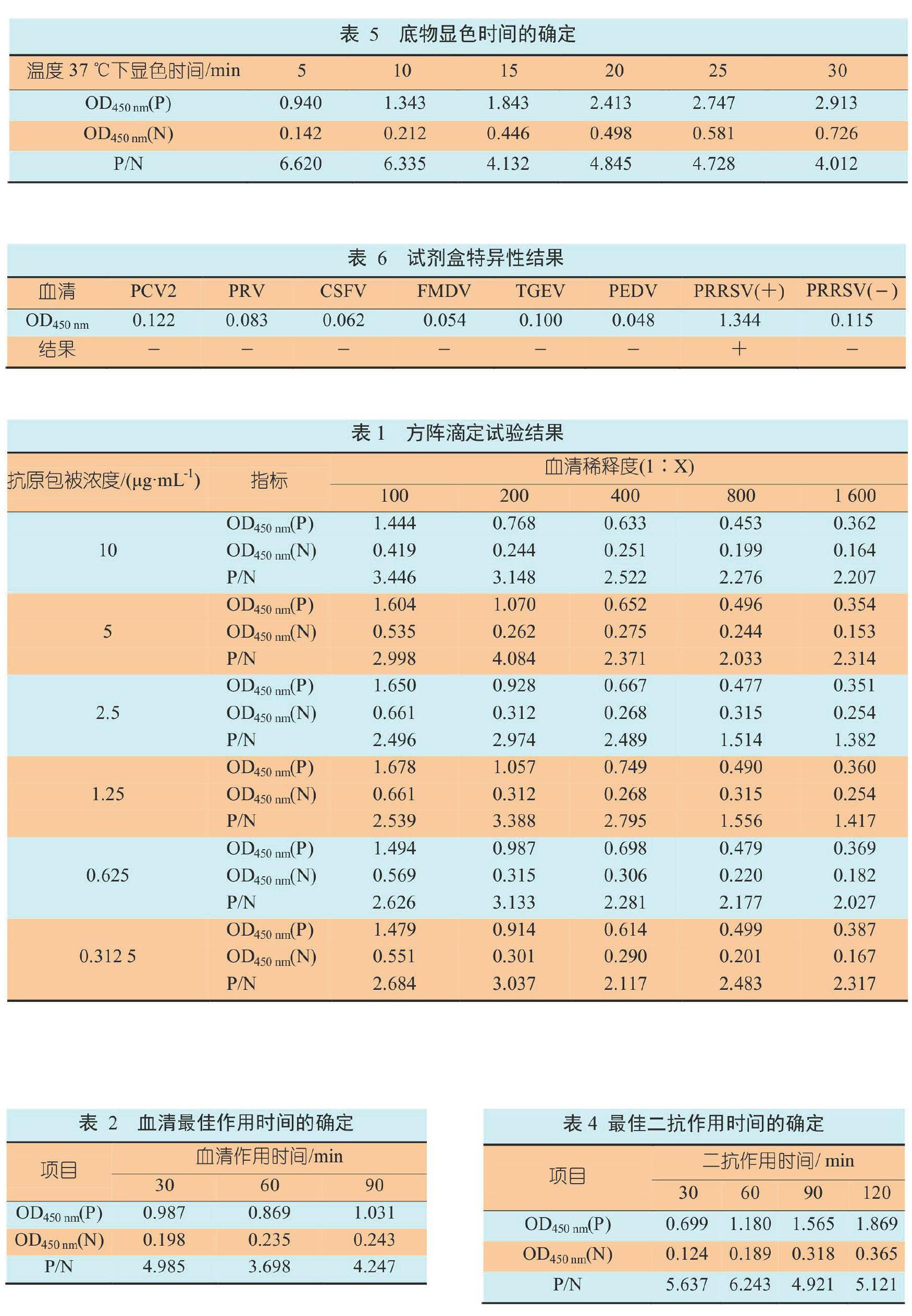
1.2.8 Western Blot鉴定
蛋白样品跑完SDS-PAGE后,进行转膜操作,转膜采用湿转方式进行,转膜缓冲液为:三羟甲基氨基甲烷(Tris)3.0 g,甘氨酸(Gly)14.4 g,甲醇200 mL,加去离子水至1 000 mL。转膜完成后用5%脱脂乳封闭,4 ℃过夜,封闭结束后用PBST洗三遍,加PRRSV阳性血清孵育2 h,孵育结束后用PBST洗5遍,加辣根过氧化酶(HRP)标记的鼠抗猪IgG孵育1 h,孵育结束后用PBST洗5遍,最后加沉淀型四甲基联苯胺(TMB)显色10 min~30 min,拍照。
1.2.9 间接ELISA检测方法的建立
● 最佳抗原包被浓度和血清稀释度的确定
按照方阵滴定法确定最佳抗原包被浓度和血清稀释度。用pH 9.6的碳酸盐缓冲液将纯化抗原做6个包被梯度,分别稀释至终浓度为 10 μg/mL、5 μg/mL、2.5 μg/mL、1.25 μg/mL、0.625 μg/mL和0.312 5 μg/mL,4 ℃过夜包被酶标板。PRRSV阴性和阳性血清按1∶100、1∶200、1∶400、1∶800和1∶1 600倍稀釋后进行方阵试验,每个稀释度2个重复,取其平均值,计算每个条件下阳性血清OD450 nm(P)/阴性血清OD450 nm(N)。选择阳性血清OD450 nm值接近1.0,P/N值最大的反应组合作为间接ELISA的最佳反应条件。
● 血清最佳作用时间的选择
加入一抗后,分别在37 ℃作用30 min、60 min和90 min后进行间接ELISA测定。
● 二抗稀释浓度的选择
以最适抗原包被浓度、封闭液以及最佳PRRSV阴性和阳性血清稀释度分步加入反应后,鼠抗猪IgG-HRP分别做1∶5 000、1∶10 000、 1∶20 000、1∶30 000和1∶40 000稀释,然后按常规间接ELISA程序测定。
● 二抗作用时间的选择
按最佳条件进行包被、封闭和加样,加入二抗后37 ℃下分别孵育30 min、60 min、 90 min和120 min,通过间接ELISA测定阳性血清的OD450 nm值和阴性血清的OD450 nm值,比较P/N值以选择最适二抗作用时间。
● 显色时间的确定
按照已筛选条件进行间接ELISA试验,最后加入TMB分别显色5 min、10 min和15 min,测定其阳性血清的OD450 nm值和阴性血清的OD450 nm值。
● ELISA临界值的确定
用建立的间接ELISA方法检测43份PRRSV抗体阴性血清,在最佳反应条件下进行间接ELISA试验。计算平均值(x)和标准差(s),根据统计学原理,以OD450 nm 1.2.10 间接ELISA试剂盒特异性试验 用建立的间接ELISA方法检测猪圆环病毒2型(Porcine CircoVirus Type 2,PCV2)、伪狂犬病病毒(Pseudorabies Virus,PRV)、猪流行性腹泻病毒(Porcine Epidemic Diarrhoea Virus,PEDV)、猪瘟病毒(Classical Swine Fever Virus,CSFV)、口蹄疫病毒(Foot-and-Mouth Disease Virus,FMDV)和猪传染性胃肠炎病毒(Porcine Transmissible Gastroenteritis Virus,TGEV)阳性血清,同时设置PRRSV标准阳性和阴性血清对照,验证该检测方法的特异性。 1.2.11 比对试验 取临床血清767份(来源于全国养殖户送检血清),用建立的间接ELISA方法和进口的PRRSV抗体检测试剂盒同时测定血清样品,可疑样品重复检测一次,若仍为可疑,即判为阳性。比较检测结果,计算二者符合率。 2 结果与分析 2.1 PRRSV Nsp7基因扩增 运用设计的特异性引物扩增PRRSV的Nsp7非结构蛋白基因,扩增得到了一条大小约为777 bp的目的片段(图1),与理论片段大小一致。 2.2 pMD19-Nsp7的PCR和酶切鉴定 将重组质粒pMD19-Nsp7进行PCR鉴定,可以扩增出大约777 bp大小的特异性片段,经双酶切鉴定,可以得到与理论大小一致的片段(图2)。 2.3 PRRSV Nsp7蛋白原核表达系统的构建与鉴定 用菌落PCR初步鉴定阳性克隆,再利用双酶切对其进行酶切鉴定,结果如图3。 2.4 Nsp7蛋白的诱导表达与纯化 重组菌在20 ℃、0.4 mmol/L IPTG以及150 r/min条件下过夜诱导,离心收集菌体,超声波裂解菌体,对全菌和破碎上清进行SDS-PAGE鉴定,由图4可以看出,目的蛋白获得了较好的可溶性表达。重组蛋白经镍柱纯化后,用SDS-PAGE蛋白电泳鉴定纯化后的表达产物,在30 kDa处得到一条单一条带,与理论大小相符,表明该条带为PRRSV Nsp7蛋白(图4)。纯化后的蛋白经SDS-PAGE蛋白电泳后转至NC膜,进行Western Blot鉴定,如图5所示。 2.5 重组PRRSV Nsp7蛋白间接ELISA检测方法的建立 2.5.1 最佳抗原包被浓度及最佳血清稀释度的确定 由方阵滴定结果可知(表1),当重组抗原包被浓度为5 μg/mL,血清稀释倍数为1∶200时,阳性血清OD450 nm读值接近1.0,且P/N值最大。因此,确定最佳抗原包被浓度为5 μg/mL,血清稀释度为1∶200。 2.5.2 血清最佳作用时间的确定 表2结果显示,当血清作用30 min时,P/N值最大。因此,血清最佳作用时间为30 min。 2.5.3 最佳二抗稀释度和二抗作用时间的确定 按照2.5.1和2.5.2试验结果进行间接ELISA操作,试验结果见表3和表4,二抗以1∶10 000稀释,37 ℃作用60 min时OD450 nm最为适宜,P/N值最大,因此二抗的最佳作用浓度为1∶10 000,最佳作用时间是60 min。 2.5.4 最适底物作用时间的确定 抗原、血清和酶标抗体按照以上最适工作条件进行,加入底物后,于37 ℃分别作用 5 min、10 min、15 min、20 min、25 min和30 min,终止反应,测定OD450 nm值。测定结果(表5)显示,在37 ℃下作用10 min可以作为显色时间的最佳条件。 2.5.5 臨界值的确定 选取43份阴性血清,按照上述建立的间接ELISA检测方法进行检测,将测得的OD450 nm进行处理,平均值为0.353,标准差为0.022,x+2s=0.397,x+3s=0.419。因此,OD450 nm< 0.397判为阴性,OD450 nm≥0.419判为阳性,0.397≤OD450 nm<0.419为可疑。 2.5.6 与IDEXX试剂盒比较试验结果 选取IDEXX试剂盒检测过的血清样品,总计767份,使用上述试验建立的间接ELISA检测方法对这些样品进行检测。试验结果与IDEXX产品对比显示,IDEXX试剂盒检测样品的阳性率为92.4%,阴性率为7.5%;上述试验建立的方法检测样品的阳性率为94.7%,阴性为5.2%;两者符合率为87.74%。
2.5.7 特异交叉反应试验结果
利用重组Nsp7蛋白建立的间接ELISA检测方法检测PCV2、PRV、CSFV、FMDV、TGEV和PEDV阳性血清,结果均为阴性,PRRSV阴阳性血清对照均成立(表6)。结果说明建立的间接ELISA检测方法具有较高的特异性。
3 讨论
用于PRRSV检测的ELISA试剂盒包被用抗原主要有纯化的PRRSV全病毒和重组N蛋白两种[8]。由于全病毒抗原纯化工艺复杂,有些细胞培养成分不易纯化干净,容易引起较强的非特异性反应或背景反应,而且会有潜在的散毒危险,故当前很少使用[9]。ORF7编码的N蛋白是PRRSV主要的结构蛋白之一,也是PRRSV病毒粒子中含量最多的病毒蛋白。PRRSV感染猪体后,首先诱导产生抗N蛋白的抗体。1977年Denal等首先报道了用杆状病毒表达系统获得重组N蛋白,建立了重组N蛋白间接ELISA方法[10]。Dea S等用大肠杆菌表达的重组N蛋白建立了竞争ELISA方法[11]。近年有研究人员利用GP5-AB蛋白、重组Nsp7蛋白和重组Nsp2蛋白建立检测PRRSV的ELISA方法,敏感性和特异性也较高[12]。
本研究使用重组Nsp7蛋白作为包被抗原建立ELISA方法,这是由于在PRRSV感染中,Nsp7抗体产生较早,猪体感染PRRSV 14 d后就可以产生针对Nsp7的抗体,免疫原性较高,抗体水平几乎可以达到N蛋白和Nsp2的抗体水平,而且比N蛋白持续时间更长。
本研究的重组Nsp7蛋白以可溶形式存在,具有正确的高级结构,可以增加检测的特异性和敏感性。再通过优化各种检测条件,建立了特异性、重复性和灵敏度较好的间接ELISA方法,从而进行PRRSV的阻断及疫苗免疫效果评价。通过与IDEXX生产的PRRSV抗体ELISA检测试剂盒平行检测767份临床血清样本对比发现,本研究建立的ELISA方法检测结果与商品化试剂盒符合率为87.74%。造成这一现象的原因可能是两种试剂盒所用包被抗原不同,商品化试剂盒采用重组N蛋白作为抗原,而本研究采用重组Nsp7蛋白作为抗原。PRRSV N蛋白有一定的变异性,本研究选取具有保守性的基因(Nsp7)进行原核表达,以此建立间接ELISA检测方法,可增加對变异株产生抗体的检出率,增加检测方法的敏感性和特异性,减少假阴性的出现。
综合上述结论,本研究建立的基于PRRSV Nsp7蛋白的间接ELISA方法,具有良好的重复性和特异性,并可能在临床上成为检测猪群中PRRSV抗体水平及检测PRRS流行情况的有效方法。□□
参考文献:(12篇,略)
