叶酸靶向CdSe/CdS/ZnS荧光量子点对肝癌HepG2细胞的体外检测
2019-11-11曹艳娟石云峰刘明芳石继飞
曹艳娟,石云峰,刘明芳,石继飞
(1.内蒙古科技大学 包头医学院医学技术学院,内蒙古 包头014040;2.安阳师范学院 化学化工学院,河南 安阳455000)
肝癌是严重影响人类健康的一种恶性肿瘤,在全世界常见恶性肿瘤中致死率排名第三位[1].根据临床研究报告显示,恶性肿瘤的死亡率高,主要是因为癌症早期多无明显症状,一旦出现症状就已经是癌症晚期,有些已经转移至临近的组织器官,对后期的治疗造成极大的困难.所以,治愈癌症的关键,应该在于早期的发现和治疗,特别是对肝癌HepG2细胞的检测十分必要,这将为早期诊断、致癌反应机理的深入研究及疗效评价提供更为有效的工具.
在生物学研究中,量子点得到了广泛的关注,它具有吸收光谱相对较宽,发射光谱相对较窄,对荧光淬灭效应有一定抗性,荧光强度高及稳定性强等特点,主要用于细胞成像[2-4]、肿瘤定位诊断[5-6]、DNA分子检测和生物传感器[7-9]等领域.硒化镉(CdSe)半导体纳米粒子具有水溶性强、易于功能化的特殊优点[10-11],通过明胶等保护涂层可显著提高其发光效率和生物相容性[12].
叶酸受体是一种跨膜糖蛋白,与叶酸及其衍生物具有高亲和性,在肿瘤细胞中过表达,是一种具有较强选择性的肿瘤标志物,恶性肿瘤细胞比正常组织细胞表面的叶酸受体含量要高[13].人们根据叶酸受体的这一特征,对肿瘤特异性显像和治疗展开了研究.目前,研究者用巯基乙酸包被的量子点在体外成功检测到人卵巢癌细胞[14].Gerard等人用叶酸对BSA-MPA量子点进行修饰,检测到量子点成功对乳腺癌细胞进行了标记[15].另一方面,也应该考虑到量子点对生物系统的毒性,因为大多数量子点都是基于镉(Cd)的半导体.不但核壳量子点的外壳可以减少量子点核心的Cd泄漏,而且量子点的一些生物分子涂层可以进一步降低量子点的细胞毒性.研究表明,一种常用的蛋白质分子牛血清白蛋白(BSA)的涂层显著地降低了细胞的毒性[16].
本文主要研究叶酸修饰的CdSe/CdS/ZnS核壳量子点(QDs)对肝癌HepG2细胞的检测效果.将制备的表面为羧基CdSe/CdS/ZnS量子点外包覆BSA,然后与FA反应,形成FA-BSA-QDs,该功能化量子点可以特异性识别表面高表达叶酸受体的肝癌HepG2细胞.
1 实验材料与方法
1.1 试剂
十八烷烯(1-octadecene,ODE)、油胺(oleylamine,OLA)、油酸(oleic acid, OAc)、三正辛基膦(trioctylphosphine,TOP)、三辛基氧化膦(Trioctylphosphine oxide,TOPO)、无水氯化镉(Anhydrous cadmium chloride,Cd-Cl2)、乙酸锌(zinc acetate,ZnAc2)、醋酸镉水合物(Cadmium acetate hydrate,Cd(Ac)2·H2O)、二氧化硒(selenium dioxide,SeO2)、硒粉(selenium powder,Se)、二苯基膦(diphenylphosphine,DPP)、硫磺粉(sulfur powder ,S)、1,2-十六烷二醇(1,2-hexadecanediol,HDD);巯基乙酸(mercaptoacetic acid,MAA)、FA、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(1-Ethyl-3-(3-dimethylaminopropyl)-carbodiimide(EDC))、二甲基亚砜(DMSO)、N-羟基琥珀酰亚胺(NHS);人类肝癌细胞株HepG2取自上海通派生物细胞库,储备液用缓冲溶液.实验用水为去离子二次蒸馏水,其他试剂均为分析纯.
1.2 CdSe/CdS/ZnS核壳型量子点的制备
本实验参照文献[17]合成了CdSe/CdS/ZnS水溶性核壳型量子点,具体步骤如下:采用传统的方法合成了直径为3.0 nm CdSe.纯化后,壳层ZnS逐层生长.在典型的生长反应中,将提纯的核原料注入12 mL的ODE和6 mL的OLA,放入250 mL的真空圆底烧瓶内,在40℃~50℃的条件下进行蒸发,在氮气下加热到120℃~130℃.将第一个0.8 mL壳层的S前体5~10 min滴加完毕,使反应持续20 min.用同样的方法加入相同量的Zn前体,使反应持续20 min,以完成第一个周期.同时逐渐增加Zn的比例和反应温度直至200℃,当达到所需要的发射波长时,添加额外的Zn前体注入,并将粒子退火约20 min,使量子点表面富含金属.混合物冷却后,以-20℃的条件储存在冰箱中.
1.3 用叶酸对CdSe/CdS/ZnS量子点进行表面修饰
在制得的表面为羧基CdSe/CdS/ZnS量子点外包覆BSA,形成BSA-QDs,然后对其表面进行处理,用羟基乙酸使其具有亲水性,然后参照文献[18]将FA和QDs表面的巯基乙酸进行化学连接.首先在4 mL BSAQDs体系中分别加入浓度均为0.05 mol/L的NHS和含EDC的DMSO溶液各0.1 mL.在室温黑暗的条件下,磁力搅拌过夜,然后将液体样品离心40 min.去除多余的FA、EDC等小分子物质,得到经过叶酸修饰的量子点,形成稳定的FA-BSA-QDs.
1.4 细胞的培养及量子点标记
将人肝癌HepG2细胞和CdSe/CdS/ZnS量子点共同孵育.将人类肝癌细胞株HepG2接种于培养基中,在37℃下,加入10%胎牛血清(Hyclone)和1%链霉素,放入5%CO2培养箱中进行培养.培养基每隔一天更新一次,细胞达到80%融合时进行传代.在细胞对数生长期时加入浓度为0.05 mol/LFA-BSA-QDs溶液0.1 mL共同培养8 h.用冷磷酸盐缓冲液冲洗3次,多聚甲醛固定15 min,再用磷酸盐缓冲液冲洗,最后用共聚焦显微镜仔细观察量子点与细胞的融合情况.
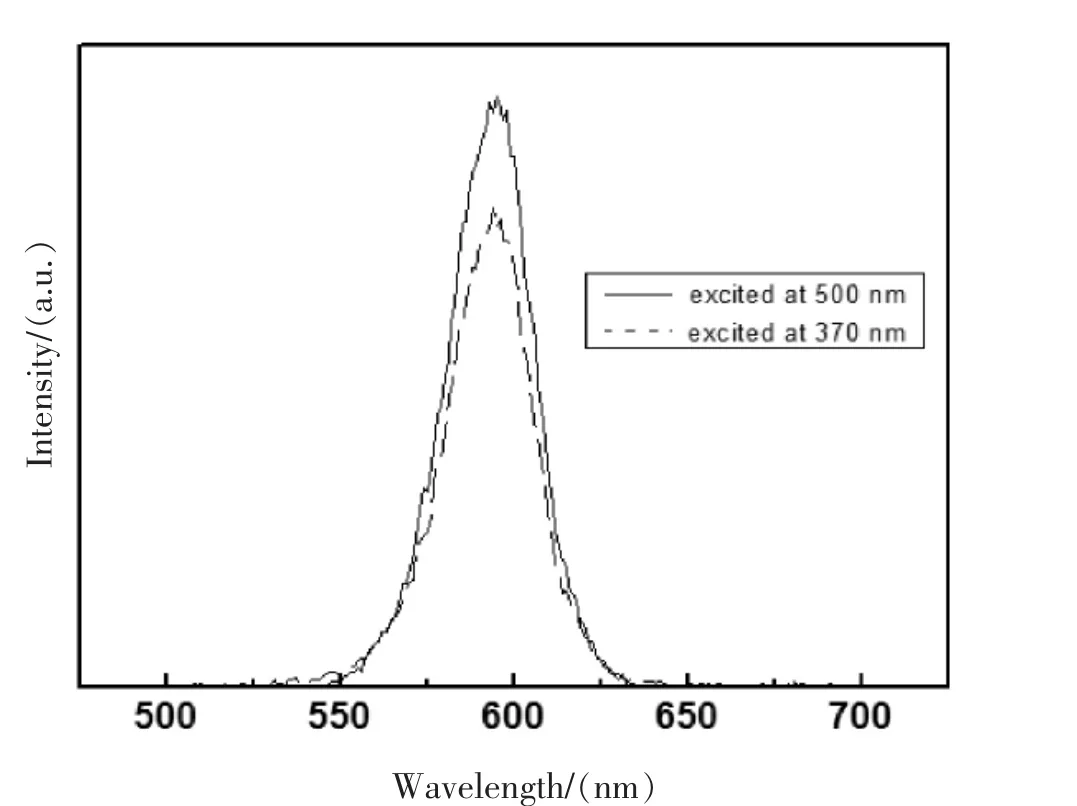
图1 橙色量子点CdSe/CdS/ZnS在激发波长为370 nm和500 nm下的荧光光谱
2 结果与讨论
2.1 反应体系的光谱性质
由图1核壳型量子点CdSe/CdS/ZnS的荧光发射光谱图可见,该激发光的激发波长分别为370 nm和500 nm,窄缝宽度都为2.5 nm.当激发波长为370 nm的时候,在591 nm处出现最大荧光发射峰;当激发波长为500 nm的时候,在596 nm处出现最大荧光发射峰.
杨芳芳等研究了CdSe/CdS/ZnS的表征特性,表明双壳层结构的纳米微粒比单一的纳米粒子和单核壳层结构的纳米粒子具有优异的发光特性,荧光强度有很大的提高[19].图中荧光发射峰可以看出核壳型量子点没有单独成核,而是在核CdSe表面外延生长.庄庆一等对量子点进行了包裹,发现可以减少量子点的毒性[20].该量子点的最大荧光峰位置与激发波长有关[21],随着激发波长的增加,最大荧光峰位置右移.可以利用量子点的这种特性进行生物荧光标记,通过对量子点直径的调节,得到不同波长颜色的荧光,从而来满足生物医学研究工作中跟踪标记的不同要求.
2.2 透射电子显微镜分析
从透射电镜照片中能够清晰地看到,橙色量子点没有出现集聚成团的现象,呈现均匀的粒径分布,近似呈球形,其粒径约为6 nm,该粒子的尺寸大于核量子点CdSe,详见图2.

图2 CdSe/CdS/ZnS橙色量子点的透射电镜观测结果
2.3 共聚焦电子显微镜分析量子点与肝癌细胞
图3 为叶酸修饰的核壳型量子点CdSe/CdS/ZnS与肝癌HepG2细胞在共聚焦显微镜下的观测结果.橙色荧光量子点荧光强度大部分较弱且均一,有几个量子点偏亮主要是量子点数目加入偏多,个别量子点没有进入细胞内部所致.橙色荧光强度较弱且均一,表明有量子点被细胞内吞的情况发生,这有可能是普遍存在不同于受体介导的选择性吸附的其他吸附途径[22].从而得出该功能化量子点对肝癌细胞具有特异性识别功能.

图3 核壳型量子点CdSe/CdS/ZnS与肝癌HepG2细胞共聚焦显微镜观测结果
3 结论
本实验采用连续的异质外延生长法合成了CdSe/CdS/ZnS水溶性核壳型量子点,并用叶酸对该量子点进行了表面修饰.结果表明,该量子点对肝癌HepG2细胞具有特异性识别的功能.该功能化量子点有可能对其他高表达叶酸受体的肿瘤细胞也具有特异性识别功能,未来将会成为一种新型的功能化量子点材料.
