猪丹毒丝菌生产用菌种CVCC43005株最高扩繁代次的确定及疫苗佐剂的筛选
2019-11-11魏财文张一帜辛凌翔王秀丽彭国瑞蒋玉文
张 媛,魏财文,李 建,张一帜,辛凌翔,王秀丽,彭国瑞,刘 博,蒋玉文
(中国兽医药品监察所,北京 100081)
猪丹毒是由丹毒丝菌引起的一种严重威胁养猪业的重要传染病,其临床特征为高热、急性败血症、皮肤疹块、慢性心内膜炎,或皮肤坏死与多发性非化脓性关节炎,临床上常与猪圆环病毒、猪细小病毒、猪肺炎支原体等病原混合感染,同时丹毒也是一种人和其它多种动物都能感染的共患病。接种猪丹毒疫苗是预防猪丹毒的一种重要手段,丹毒丝菌CVCC43005株是猪丹毒灭活疫苗的生产用菌株,由中国兽医药品监察所负责检定、保管和供应,具有自主知识产权,该菌种毒力稳定、免疫原性好,是一株优良的疫苗株[1]。该菌种现有检定依据为《中华人民共和国兽用生物制品规程》(二〇〇〇年版,第5次修订)[2],该标准执行至今已近20年,其明确了CVCC43005株菌种基础种子代数,但没有明确生产种子最高扩繁代次,且菌种免疫原性是将其制备为氢氧化铝胶佐剂疫苗后通过小鼠的免疫攻毒实验予以评价。近20年来市场上已经出现多种新型佐剂,这些佐剂对菌种免疫原性是否有所影响不得而知。为研究该菌种作为生产用菌种的最高扩繁代次以及新型佐剂对该菌种免疫原性的影响,建立了猪丹毒丝菌CVCC43005株的种子批,并对不同佐剂进行筛选,为修订菌种检定依据奠定了基础。
1 材料与方法
1.1 菌株 CVCC43005株F5、F10、F15、F20代冻干菌种,检验用CVCC43008株、CVCC43006株菌种,均由中国兽医药品监察所冻干、保存。
1.2 培养基及试剂 猪丹毒培养基、革兰氏染色液,购自购自青岛高科技工业园海博生物技术有限公司。TSA培养基,购自BD公司。TG培养基、TSB培养基、5%蔗糖脱脂牛奶,购自北京中海动物保健科技公司。马血清,购自Gbico公司。细菌鉴定试剂盒,购自Biomerieux公司。裂解血细胞全血、猪丹毒分型血清、猪丹毒抗体阳性血清、猪丹毒抗体阴性血清、矿物质白油、氢氧化铝胶、40%氢氧化铝胶生理盐水,由中国兽医药品监察所细菌制品检测室提供。MONTANIDETMIMS1313VGNST佐剂、GEL01PR佐剂,购自法国赛比克公司。水溶性佐剂、水性复合免疫佐剂由洛阳赛威公司赠送。
1.3 实验动物 16~18 g ICR小白鼠、18~22 g ICR小白鼠,购自北京维通利华实验动物技术有限公司。
1.4 种子批的建立 以具有良好毒力、免疫原性、繁殖特性和纯净性的1986年冻干的CVCC43005菌株为原始种子,将原始种子用含4%马血清及0.1%裂解血细胞全血TSA培养基连续传代,每代于37 ℃培养24 h,各代命名为F1~F20。将生长纯粹的F5、F10、F15、F20代菌分别用5%蔗糖脱脂牛奶洗下后分装安瓿,冻干,抽真空后融封,用于后续检定,依据检定结果建立种子批。
1.5 形态 取菌种培养物进行革兰氏染色,镜检。
1.6 生化特性 参照试剂的使用说明书检定。
1.7 培养特性 菌种接种含4%马血清及0.1%裂解血细胞全血TSA平板,37 ℃培养48 h,观察细菌生长特性。
1.8 血清学特性 参照试剂的使用说明书检定。
1.9 纯粹 按《中国兽药典》2015年版要求进行检定[3]。
1.10 真空度 按《中国兽药典》2015年版要求检定[3]。
1.11 剩余水分 按《中国兽药典》2015年版要求检定[3]。
1.12 毒力 参照《中华人民共和国兽用生物制品规程》二〇〇〇年版[2]用小鼠进行最小致死剂量测定。将F5、F10、F15和F20代菌种分别用猪丹毒培养基制备成菌液后,皮下注射体重18~22 g小白鼠,根据菌液预数结果,将菌液稀释为1、3、5、7、9、11、13、15 CFU/0.2mL,每个剂量组注射5只小鼠,每只小鼠注射0.2 mL,同时对菌液进行复数,根据复数结果计算每个剂量组小鼠实际注射的活菌数。7个观察日内记录小鼠死亡情况,结合每只小鼠实际注射的活菌数判定各代次菌种对于小鼠的毒力。
1.13 免疫原性 用小鼠进行免疫原性检定。将F5、F10、F15、F20代菌种参照《中华人民共和国兽用生物制品规程》二〇〇〇年版[2]分别制备成氢氧化铝胶灭活抗原。取100只16~18 g小白鼠分为12组。第1、2、3、4组,每组10只,分别皮下注射F5、F10、F15、F20代灭活抗原0.1 mL;第5、6、7、8组,每组10只,分别皮下注射F5、F10、F15、F20代灭活抗原40%氢氧化铝胶生理盐水4倍稀释液0.2 mL;第9、10、11、12组,每组5只,不注射疫苗,作为对照组。免疫21 d后,每个免疫组各取5只小鼠,连同对照小鼠5只各注射1000 MLD(最小致死量,Minimum Lethal Dose) CVCC43008强毒菌液,另取5只对照小鼠注射1 MLD CVCC43008强毒菌液;每个免疫组剩余5只小鼠,连同对照小鼠5只各注射1000 MLD CVCC43006强毒菌液,另取5只对照小鼠注射1 MLD CVCC43006强毒菌液。攻毒后观察10 d,统计保护率。
1.14 小鼠最小免疫剂量测定 将F5代菌株制备的菌液活菌计数后,经甲醛灭活,取灭活菌液40 mL,与8 mL氢氧化铝胶充分混匀后置2~8 ℃静置2 d后弃去上清28 mL,其作为抗原原液。用40%氢氧化铝胶生理盐水将抗原原液进行4倍、8倍、16倍稀释,取各稀释度抗原免疫16~18 g小白鼠,每个剂量免疫10只小鼠。免疫21 d后,每个免疫组各取5只小鼠,连同对照小鼠5只各注射1000 MLD CVCC43008强毒菌液,另取5只对照小鼠注射1 MLD CVCC43008强毒菌液;每个免疫组剩余5只小鼠,连同对照小鼠5只各注射1000 MLD CVCC43006强毒菌液,另取5只对照小鼠注射1 MLD CVCC43006强毒菌液。攻毒后观察10 d,统计保护率。
1.15 不同佐剂疫苗的制备 分别将F5代菌株制备的甲醛灭活菌液用铝胶佐剂、矿物质白油佐剂、洛阳赛威公司的水溶性佐剂、水性复合免疫佐剂以及法国赛比克公司的MONTANIDETMIMS1313VGNST、GEL01PR 6种佐剂按各自使用说明制备猪丹毒灭活疫苗。然后参照《中国兽药典》2015年版要求进行性状和无菌检验[3]。
1.15.1 铝胶佐剂疫苗的制备 灭活菌液5份加灭菌的氢氧化铝胶1份,充分混合均匀后,静置沉淀3日,弃去上清,浓缩至全量的2/5,充分混合。用40%氢氧化铝胶生理盐水进行8倍、16倍、32倍稀释,分别标记铝1、铝2、铝3。
1.15.2 白油佐剂疫苗的制备 灭活菌液5份加灭菌的氢氧化铝胶1份,充分混合均匀后,静置沉淀3日,弃去上清,浓缩至全量的2/5,充分混合。用40%氢氧化铝胶生理盐水进行4倍、8倍、16倍稀释,取稀释后的抗原分别与吐温-80混匀作为水相,再分别与等量的油相进行乳化,乳化后分别标记油1、油2、油3。
1.15.3 水溶性佐剂疫苗的制备 灭活菌液5份加灭菌的氢氧化铝胶1份,充分混合均匀后,静置沉淀3日,弃去上清,浓缩至全量的2/5,充分混合。用40%氢氧化铝胶生理盐水进行4倍、8倍、16倍稀释,取稀释后的抗原分别与等量的水溶性佐剂混匀,分别标记水1、水2、水3。
1.15.4 水性复合免疫佐剂疫苗的制备 灭活菌液5份加灭菌的氢氧化铝胶1份,充分混合均匀后,静置沉淀3日,弃去上清,浓缩至全量的2/5,充分混合。用40%氢氧化铝胶生理盐水进行4倍、8倍、16倍稀释,取稀释后的抗原分别与等量的水性复合免疫佐剂混匀,分别标记复1、复2、复3。
1.15.5 IMS1313VGNST佐剂疫苗的制备 灭活菌液5份加灭菌的氢氧化铝胶1份,充分混合均匀后,静置沉淀3日,弃去上清,浓缩至全量的2/5,充分混合。用40%氢氧化铝胶生理盐水进行4倍、8倍、16倍稀释,取稀释后的抗原分别与等量的IMS1313VGNST佐剂混匀,分别标记IMS1、IMS2、IMS3。
1.15.6 GEL01PR佐剂疫苗的制备 灭活菌液用PBS进行4倍、8倍、16倍稀释,取稀释后的抗原分别与GEL01PR佐剂按9∶1的比例混匀,分别标记GEL1、GEL2、GEL3。
1.16 疫苗安全检验 取180只18~22 g小白鼠,随机分成18组,每组10只,分别于背部皮下注射标记为铝1、铝2、铝3、油1、油2、油3、水1、水2、水3、复1、复2、复3、IMS1、IMS2、IMS3、 GEL1、GEL2、GEL3的灭活疫苗0.3 mL/只,观察10日。
1.17 疫苗效力检验 取200只16~18 g小白鼠,随机分成22组。其中1~18组,每组10只,分别于背部皮下注射标记为铝1、铝2、铝3、油1、油2、油3、水1、水2、水3、复1、复2、复3、IMS1、IMS2、IMS3、 GEL1、GEL2、GEL3的灭活疫苗0.1 mL/只;第19、20、21、22组,每组5只,不注射疫苗,作为对照组。免疫21 d后,每个免疫组各取5只小鼠,连同对照小鼠5只各注射1000 MLD CVCC43008强毒菌液,另取5只对照小鼠注射1 MLD CVCC43008强毒菌液;每个免疫组剩余5只小鼠,连同对照小鼠5只各注射1000 MLD CVCC43006强毒菌液,另取5只对照小鼠注射1 MLD CVCC43006强毒菌液。攻毒后观察10 d,统计保护率。
2 结果与分析
2.1 形态 经染色观察,F5、F10、F15、F20代菌种均为革兰氏阳性纤细小杆菌。
2.2 生化特性 F5、F10、F15、F20代菌种的生化特性均符合猪丹毒丝菌的特性。
2.3 培养特性 F5、F10、F15、F20代菌种在含4%马血清及0.1%裂解血细胞全血TSA平板上均生长为形态完整的呈微蓝灰色露珠状小菌落,在低倍显微镜下观察,菌落可呈光滑型或粗糙型,菌落中部含有黄褐色点状颗粒。
2.4 血清学特性 F5、F10、F15、F20代菌种的血清型均为2型。
2.5 纯粹 F5、F10、F15、F20代菌种均纯粹,没有杂菌生长。
2.6 真空度 将失真空的F5、F10、F15、F20代菌株淘汰,保留的菌株真空度检查均呈现白色、粉色或紫色辉光。
2.7 剩余水分 F5、F10、F15、F20代菌株剩余水分测定结果见表1,各代次冻干菌株剩余水分含量均<3.0%。
2.8 毒力 F5、F10、F15、F20代菌株对小鼠最小致死剂量测定结果见表2,9~10 CFU活菌皮下注射体重18~22 g小白鼠,均于7日内5/5死亡。
2.9 免疫原性 F5、F10、F15、F20代菌株对小鼠免疫原性测定结果见表3,各代次菌株制备成灭活抗原后,按两个剂量组免疫小鼠,每只小鼠分别免疫灭活抗原0.1 mL及灭活抗原4倍稀释液0.2 mL。免疫小鼠攻击1000 MLD强毒菌液全部健活,对照小鼠攻击1000 MLD强毒菌液全部死亡, 攻击1 MLD 强毒菌液C43-6株5/5死亡,C43-8株4/5死亡。各代次菌株免疫原性没有变化,较为稳定。

表1 不同代次菌株剩余水分含量Tab 1 The residual water content of differentgenerations of strains
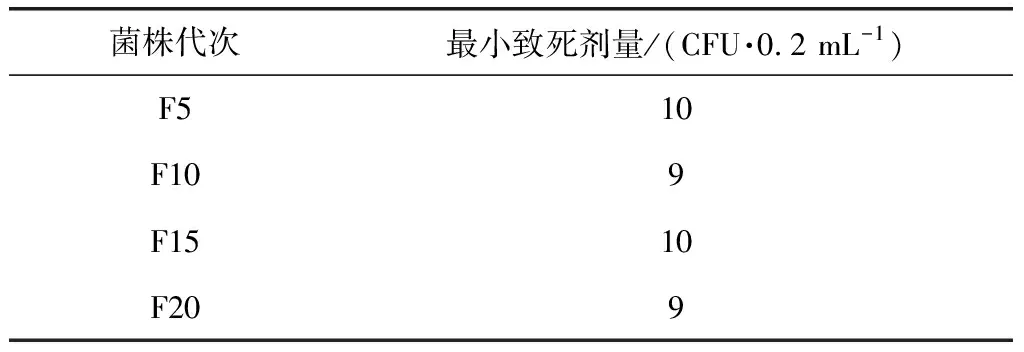
表2 不同代次菌株对小鼠的最小致死剂量Tab 2 The MLD to mice of different generations of strains

表3 不同代次菌株对小鼠的免疫原性Tab 3 The immunogenicity to mice of different generations of strains
剂量1为每只小鼠皮下注射灭活抗原0.1 mL; 剂量2为每只小鼠皮下注射灭活抗原40%氢氧化铝胶生理盐水4倍稀释液0.2 mL
2.10 小鼠最小免疫剂量 F5代菌株制备的氢氧化铝胶佐剂灭活疫苗对小鼠最小免疫剂量为2.1×108CFU/只(灭活前菌液含有的活菌数),攻击1000 MLD CVCC43006及CVCC43008株免疫组小鼠均全部健活,对照组小鼠攻击1000 MLD组均5/5死亡,攻击1MLD组均4/5死亡。结果见表4。
2.11 疫苗性状及无菌检验 6种疫苗均无菌生长,其性状检验结果见表5。

表4 F5代菌株制备的氢氧化铝胶佐剂灭活疫苗对小鼠的最小免疫剂量Tab 4 The minimum immune dose to mice of the inactivated aluminum hydroxide colloid vaccine

表5 不同佐剂疫苗性状检验Tab 5 The appearance of the vaccines prepared by different adjuvants
2.12 疫苗安全检验 6种疫苗18个组注射的180只小鼠于10个观察日内精神、采食均正常,但氢氧化铝胶佐剂疫苗、IMS1313VGNST佐剂疫苗及矿物质白油佐剂疫苗注射的小鼠,注射部位会出现肿胀、硬结、破溃等不良反应,结果见表6及图1。
2.13 疫苗效力检验 6种疫苗效力检验结果表明使用GEL01PR佐剂、铝胶佐剂、矿物质白油佐剂制备的疫苗免疫效果最好(表7)。

表6 不同佐剂疫苗注射局部反应Tab 6 The local reactions after injection of the vaccines prepared by different adjuvants

图1 小鼠注射局部不良反应Fig 1 The local adverse reactions to mice after injection
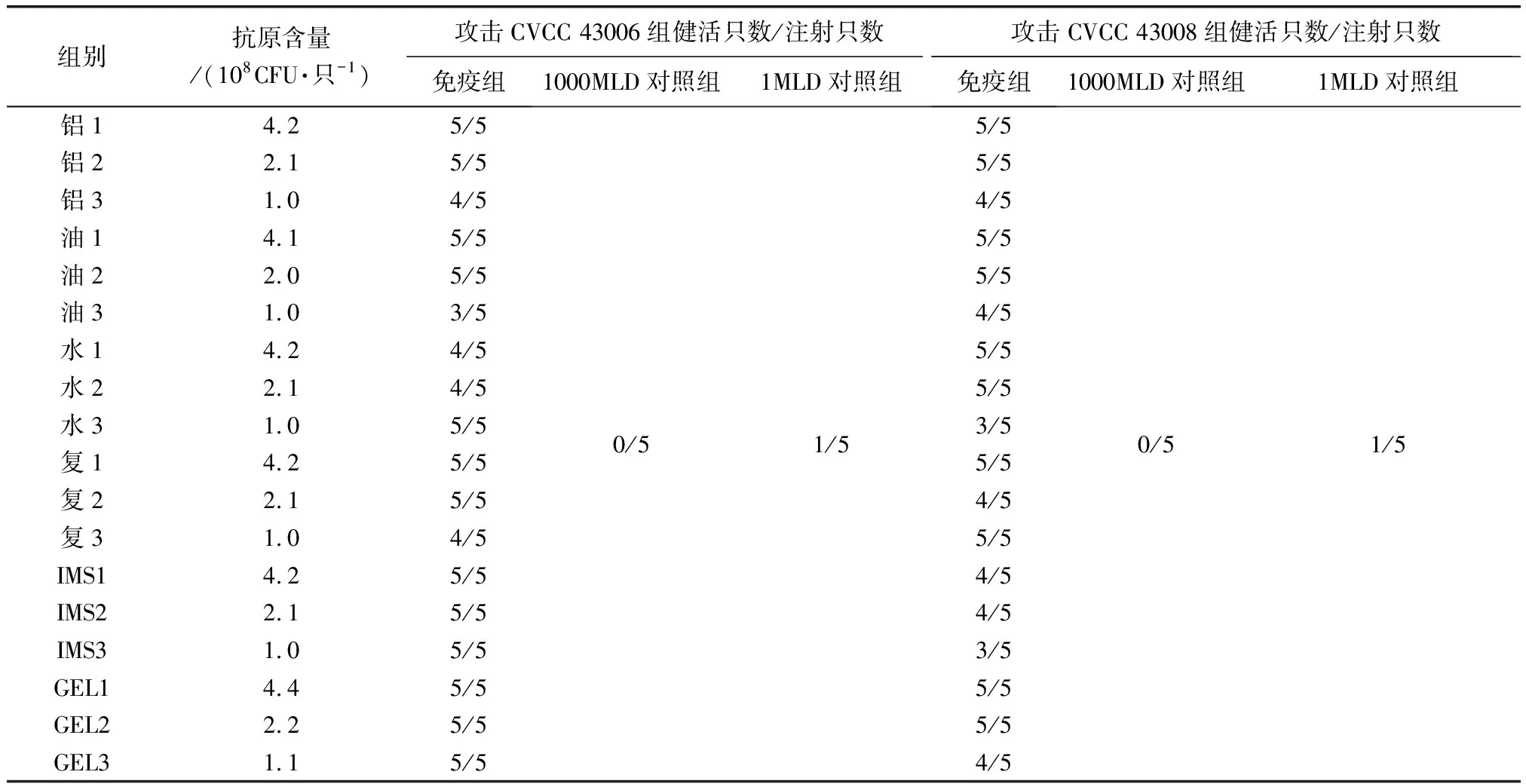
组别抗原含量/(108CFU·只-1)攻击CVCC 43006组健活只数/注射只数攻击CVCC 43008组健活只数/注射只数免疫组1000MLD对照组1MLD对照组免疫组1000MLD对照组1MLD对照组铝14.25/5铝22.15/5铝31.04/5油14.15/5油22.05/5油31.03/5水14.24/5水22.14/5水31.05/5复14.25/5复22.15/5复31.04/5IMS14.25/5IMS22.15/5IMS31.05/5GEL14.45/5GEL22.25/5GEL31.15/50/51/55/55/54/55/55/54/55/55/53/55/54/55/54/54/53/55/55/54/50/51/5
3 讨论与结论
小鼠对丹毒丝菌的毒力及免疫原性的反应是与猪的反应呈正相关的,目前国内市场上现有的猪丹毒产品均用小鼠来评价疫苗的安全性及效力,国外研究学者也是用小鼠来评价丹毒丝菌保护性抗原的免疫效果[4-6],用耗费资源更少的小鼠替代猪进行菌株毒力、免疫原性以及疫苗安全性和效力的评价,是遵循动物实验3R原则的体现。
经一定途径在一定时间内能使一组实验动物全部致死的最小微生物剂量为1 MLD,但在实际操作过程中由于动物个体反应及菌液混合均匀度、注射剂量准确性等不确定因素的影响,有时注射1 MLD的对照动物组无法达到100%死亡,目前市场上现有的猪丹毒产品对于攻击1 MLD强毒菌液对照组小鼠要求2/3死亡(即死亡率为66.7%)。本试验中不论最小免疫剂量的测定、菌种免疫原性的测定还是疫苗效力检验,攻击1 MLD强毒菌液对照组小鼠的死亡率均达到了80%以上,对照成立。
通过对CVCC43005株各代次冻干菌种的生化特性、培养特性、毒力、免疫原性等鉴定证明,各代次菌种传代稳定;形态、生化特性、培养特性均符合丹毒丝菌的特性;冻干菌种纯粹,没有杂菌污染;真空度及剩余水分含量符合冻干菌种要求;各代次菌株毒力没有明显变化,9~10 CFU活菌可于7日内致死小鼠;各代次菌株制成灭活疫苗免疫小鼠后,均能够产生完全的攻毒保护,以此为依据,建立了菌种的种子批,确定猪丹毒丝菌CVCC43005株基础种子代数为F1~F10代;生产用菌种的最高扩繁代次宜控制在5代以内[7]。
疫苗的安全高效和副作用小是评价疫苗质量的重要指标,而适当的佐剂选择对于疫苗安全性和效力至关重要。当18~22 g小白鼠背部皮下注射6种佐剂疫苗0.3 mL/只时,小鼠精神、食欲均无异常反应,但只有水溶性佐剂疫苗、水性复合免疫佐剂疫苗、GEL01PR佐剂疫苗注射的小鼠,注射部位没有出现肿胀、硬结、破溃等不良反应,表明此三种佐剂具有良好的安全性。免疫16~18 g小白鼠,使用GEL01PR佐剂、铝胶佐剂、矿物质白油佐剂制备的疫苗组表现最突出,皮下注射抗原含量2.0×108~2.2×108CFU的疫苗即可获得对小鼠100%的免疫保护;水性复合免疫佐剂次之,需皮下注射抗原含量为4.2×108CFU的疫苗才可获得对小鼠100%的免疫保护;MONTANIDETMIMS1313VGNST佐剂及水溶性佐剂最为不理想,即使皮下注射抗原含量为4.2×108CFU的疫苗,也只能获得对小鼠90%的免疫保护。综合评价疫苗的安全性及效力,GEL01PR佐剂为猪丹毒灭活疫苗的最佳佐剂。
本试验种子批的建立、CVCC43005株作为生产用菌种最高扩繁代次的确定及疫苗免疫佐剂的筛选,为修订菌种检定依据奠定了基础。
