基于TOPSIS分析与多组分定量的感冒灵制剂质量控制研究
2019-11-09肖日传匡艳辉郑捷王德勤
肖日传,匡艳辉,郑捷,王德勤
(广州白云山和记黄埔中药有限公司,广东 广州 510515)
感冒灵制剂是一种经典的中西药复方制剂,市面上的剂型主要包括颗粒剂、胶囊剂和片剂3种,如复方感冒灵颗粒、复方感冒灵片、感冒灵胶囊等,在临床上应用十分广泛,常用于治疗头痛、发热等由感冒引起的各种症状,现收载于《中华人民共和国卫生部药品标准中药成方制剂》[1]。作为中西药合用的典范,感冒灵制剂在不断临床实践中,得到了广泛认可。研究表明,由于中药组分的加入,中西药组方配伍后起到了非常明显的协同作用,特别是在抗感染和抑菌方面[2],同时也在一定程度上制约了西药成分的毒性或不良反应[3]。
以颗粒剂为例,感冒灵颗粒和复方感冒灵颗粒所用西药原料相同,均为对乙酰氨基酚、咖啡因和马来酸氯苯那敏,但在中药原料方面两者有所不同,感冒灵颗粒中的中药成分为三叉苦、金盏银盘、野菊花和岗梅,复方感冒灵颗粒中则为金银花、五指柑、野菊花、三叉苦、南板蓝根和岗梅。现行标准中,感冒灵3种剂型含量测定项均以西药成分对乙酰氨基酚为主要指标,或增加一种成分如咖啡因或绿原酸为控制指标;现有研究也多对西药成分对乙酰氨基酚、咖啡因和马来酸氯苯那敏中的一种或者几种进行测定,如丁宏珍[4]和吴小辉[5]对感冒灵颗粒中对乙酰氨基酚的质量分数进行了测定,蔡松涛等[6]报道了感冒灵片中对乙酰氨基酚、马来酸氯苯那敏、咖啡因化药成分的质量分数检测;或者仅有增加来源于中药原料的绿原酸成分测定的少量研究,如夏方亮等[7]对复方感冒灵胶囊中对乙酰氨基酚和绿原酸的质量分数进行了检测,倪坤仪等[8]在检测复方感冒灵片3种化药成分的基础上,增加了绿原酸成分的质量分数测定。
综上可知,中西药复方制剂的质量控制以测定多个组分为趋势,且中药成分的作用不容忽视。本文以绿原酸、木犀草苷、蒙花苷、异绿原酸B和异绿原酸C作为检测指标,其中绿原酸、异绿原酸B与异绿原酸C来源于野菊花、金盏银盘或金银花,蒙花苷来源于野菊花,木犀草苷来源于野菊花或金银花。探讨感冒灵多种剂型5种成分同时测定的质量分析方法,并基于质量分数测定结果,采用TOPSIS法进一步对不同批次样品进行比较和分析,以期为建立一种更全面、系统的感冒灵制剂整体质量评控的技术体系奠定基础,为其质量标准的完善提升提供数据支撑。
1 仪器与材料
Agilent 1260高效液相色谱仪及DAD检测器(美国Agilent公司);KQ-600VDB型双频数控超声波清洗器(昆山市超声仪器有限公司);CP225D十万分之一电子分析天平(赛多利斯科学仪器有限公司)。
绿原酸(批号110753-201415)、木犀草苷(批号111720-200905)购自中国食品药品检定研究院,异绿原酸B(批号MUST-18031602)、异绿原酸 C(批号MUST-18031603)、蒙花苷(批号MUST-17071710)购自成都曼斯特生物制品有限公司。乙腈为色谱纯,其余试剂为分析纯。感冒灵制剂来自不同生产厂家的不同剂型,各批次样品信息见表1。
2 方法与结果
2.1 色谱条件
Agilent Eclipse Plus C18(4.6 mm×250 mm,5 μm)色谱柱;流动相为乙腈(A)-0.1%(体积分数)H3PO4水溶液(B),梯度洗脱:0~10 min,13%A;10~15 min,13%A→20%A;15~20 min,20%A;20~40 min,20%A→30%A;40~50 min,30%A→60%A。体积流量:1 mL/min;柱温:30 ℃;检测波长:327 nm(绿原酸、异绿原酸B和异绿原酸C),334 nm(蒙花苷),350 nm(木犀草苷);进样量:10 μL。
2.2 混合对照品溶液的制备
分别精密称取各对照品适量,加甲醇溶液溶解,制成含绿原酸43 μg/mL、木犀草苷35 μg/mL、异绿原酸B 42 μg/mL、异绿原酸C 42 μg/mL、蒙花苷64 μg/mL的混合对照品溶液,于4 ℃冰箱保存备用,临用前经0.22 μm微孔滤膜滤过,即得。
2.3 供试品溶液的制备
取各感冒灵制剂(片剂需除去糖衣、胶囊剂取内容物、颗粒剂直接取样),置研钵中研细,过3号筛。分别精密称取各批样品3 g,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,超声处理(功率250 W,频率45 kHz)30 min。放冷后称定质量,用甲醇补足减失的质量,摇匀、滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 线性关系的考察 精密吸取“2.2”项下混合对照品溶液2、4、6、8、10、12 μL,分别注入液相色谱仪中,按“2.1”项下色谱条件测定。以进样量为横坐标,峰面积为纵坐标,绘制标准曲线,进行回归分析,回归方程及相关系数见表2。
表1 36批感冒灵制剂来源信息表
Table1Source information table of 36 batches of Ganmaoling preparations

编号制剂名称厂家批号规格每日用量/gS1感冒灵颗粒广东A117120110 g/袋30S2北京B2017072710 g/袋30S3安徽C17070810 g/袋30S4四川D17010110 g/袋30S5广西E1180130210 g/袋30S6广西E22017110110 g/袋30S7广西E31711020210 g/袋30S8广东A2D18F00910 g/袋30S9广东A317125110 g/袋30S10广西E418020910 g/袋30S11云南F2017111510 g/袋30S12广东A42017010110 g/袋30S13广东A52017081810 g/袋30S14广东A62017020510 g/袋30S15广西E418012810 g/袋30S16广西E518020410 g/袋30S17河南G2017050410 g/袋30S18广东A71801046H10 g/袋30S19广东A81808022H10 g/袋30S20感冒灵胶囊吉林A1712010.5 g/粒3S21黑龙江B201802020.5 g/粒3S22广西C1802010.5 g/粒3S23江西D18042610.5 g/粒3S24复方感冒灵颗粒河北A18033114 g/袋42S25广西B18034714 g/袋42S26广东C17123714 g/袋42S27复方感冒灵片广西A11712010.32 g/片3.84S28江西B12017121710.32 g/片3.84S29江西B22018030120.32 g/片3.84S30广西A21710030.32 g/片3.84S31广西A31703010.32 g/片3.84S32广东C1201612090.32 g/片3.84S33广东C275017010.32 g/片3.84S34广东C31707130.32 g/片3.84S35广东C431707080.32 g/片3.84S36广东C51705020.32 g/片3.84
表2 感冒灵制剂5种化学成分的线性关系考察
Table2Linear relationships of five chemical constituents in Ganmaoling preparations

化合物检测波长/nm回归方程r线性范围/μg绿原酸327Y=2.615 33×105X-3.108×1030.999 50.086 0~0.516 0木犀草苷350Y=1.673 97×105X+1.889 2×1040.999 70.070 0~0.420 0异绿原酸B327Y=2.748 35×105X+3.104 9×1040.999 60.084 0~0.504 0异绿原酸C327Y=3.416 71×105X-2.632 0×1040.999 60.084 0~0.504 0蒙花苷334Y=2.418 77×105X-1.184 2×1040.999 60.128 0~0.768 0
2.4.2 精密度试验 精密吸取“2.2”项下混合对照品溶液10 μL,连续进样6次,分别计算5种成分峰面积的RSD值,考察仪器精密度,结果绿原酸、木犀草苷、异绿原酸B、异绿原酸C、蒙花苷峰面积的RSD值分别为1.34%、0.39%、0.45%、1.24%、0.47%,表明仪器精密度良好。
2.4.3 重复性试验 取同一批次感冒灵制剂(感冒灵颗粒,批号170101),按“2.3”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样测定,计算峰面积的RSD值。结果绿原酸、木犀草苷、异绿原酸B、异绿原酸C、蒙花苷峰面积的RSD分别为2.52%、1.93%、2.46%、1.61%、2.13%,表明方法重复性良好。
2.4.4 稳定性试验 取同一批感冒灵样品(感冒灵颗粒,批号170101),按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件分别于0、2、4、6、8、10、12、24 h进样分析,记录色谱图,计算峰面积的RSD值。结果绿原酸、木犀草苷、异绿原酸B、异绿原酸C、蒙花苷峰面积的RSD值分别为1.90%、2.41%、1.56%、2.23%、0.40%,表明供试品溶液在24 h内稳定。
2.4.5 加样回收率试验 取已知质量分数的感冒灵样品粉末6份(感冒灵颗粒,批号170101),每份约1.5 g,置具塞锥形瓶中,分别精密加入绿原酸、木犀草苷、异绿原酸B、异绿原酸C、蒙花苷对照品0.290、0.321、0.556、0.528、0.584 mg,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,分别计算各成分加样回收率及RSD值。结果绿原酸、木犀草苷、异绿原酸B、异绿原酸C、蒙花苷的平均加样回收率分别为99.72%、99.08%、109.32%、112.21%、98.66%,RSD值分别为2.42%、1.64%、1.95%、2.77%、3.02%,表明方法加样回收率良好。
2.5 样品测定
取36批感冒灵制剂样品,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定。以外标法计算绿原酸、木犀草苷、异绿原酸B、异绿原酸C和蒙花苷5种化学成分的质量分数,得到感冒灵颗粒、感冒灵胶囊、复方感冒灵颗粒和复方感冒灵片的质量分数测定结果(以每日服用量计算,颗粒剂规格为10 g/袋,日服用量为30 g;胶囊剂规格为0.5 g/粒,日服用量为3 g;复方颗粒剂规格为14 g/袋,日服用量为42 g;片剂规格为0.32 g/片,日服用量为3.84 g)。见表3。供试品与混合对照品溶液不同波长下的色谱图见图1~3。
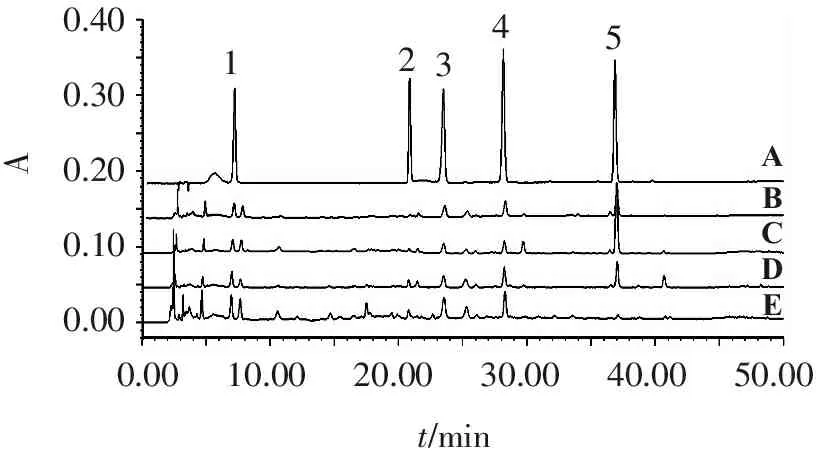
0.400.300.200.100.00AABC0.0010.0020.0030.0040.0050.00t/minDE12345
1.绿原酸; 2.木犀草苷; 3.异绿原酸B; 4.异绿原酸C; 5.蒙花苷。
A.混合对照品溶液; B.感冒灵颗粒溶液; C.感冒灵胶囊溶液; D.复方感冒灵片溶液; E.复方感冒灵颗粒溶液。
图1感冒灵4种制剂的HPLC色谱叠加图(327 nm)
Figure1HPLC chromatographic overlay charts of four Ganmaoling preparations (327 nm)
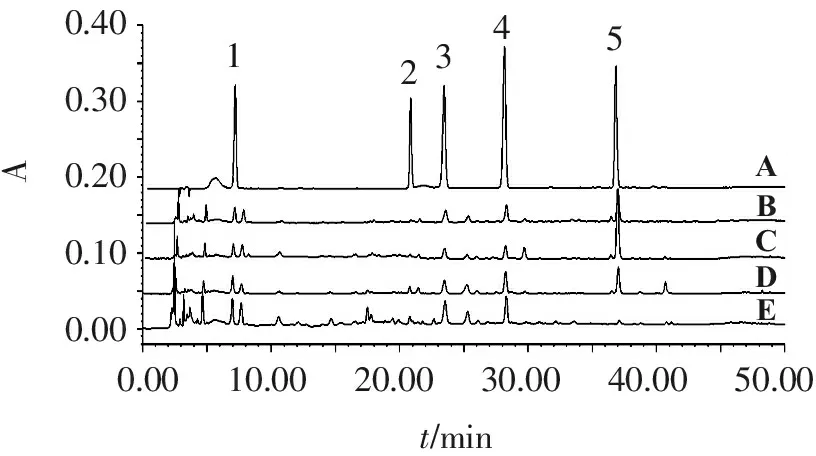
0.400.300.200.100.000.0010.0020.0030.0040.0050.00t/minABCDEA12345
1.绿原酸; 2.木犀草苷; 3.异绿原酸B; 4.异绿原酸C; 5.蒙花苷
A.混合对照品溶液; B.感冒灵颗粒溶液; C.感冒灵胶囊溶液; D.复方感冒灵片溶液; E.复方感冒灵颗粒溶液。
图2感冒灵4种制剂的HPLC色谱叠加图(334 nm)
Figure2HPLC chromatographic overlay charts of four Ganmaoling preparations (334 nm)

0.0010.0020.0030.0040.0050.00t/min0.400.300.200.100.00ABCDEA12345
1.绿原酸; 2.木犀草苷; 3.异绿原酸B; 4.异绿原酸C; 5.蒙花苷。
A.混合对照品溶液; B.感冒灵颗粒溶液; C.感冒灵胶囊溶液; D.复方感冒灵片溶液; E.复方感冒灵颗粒溶液。
图3感冒灵4种制剂的HPLC色谱叠加图(350 nm)
Figure3HPLC chromatographic overlay charts of four Ganmaoling preparations (350 nm)
表3 感冒灵制剂质量分数测定结果
Table3Determination results of mass fraction of Ganmaoling preparations 日服用量/mg
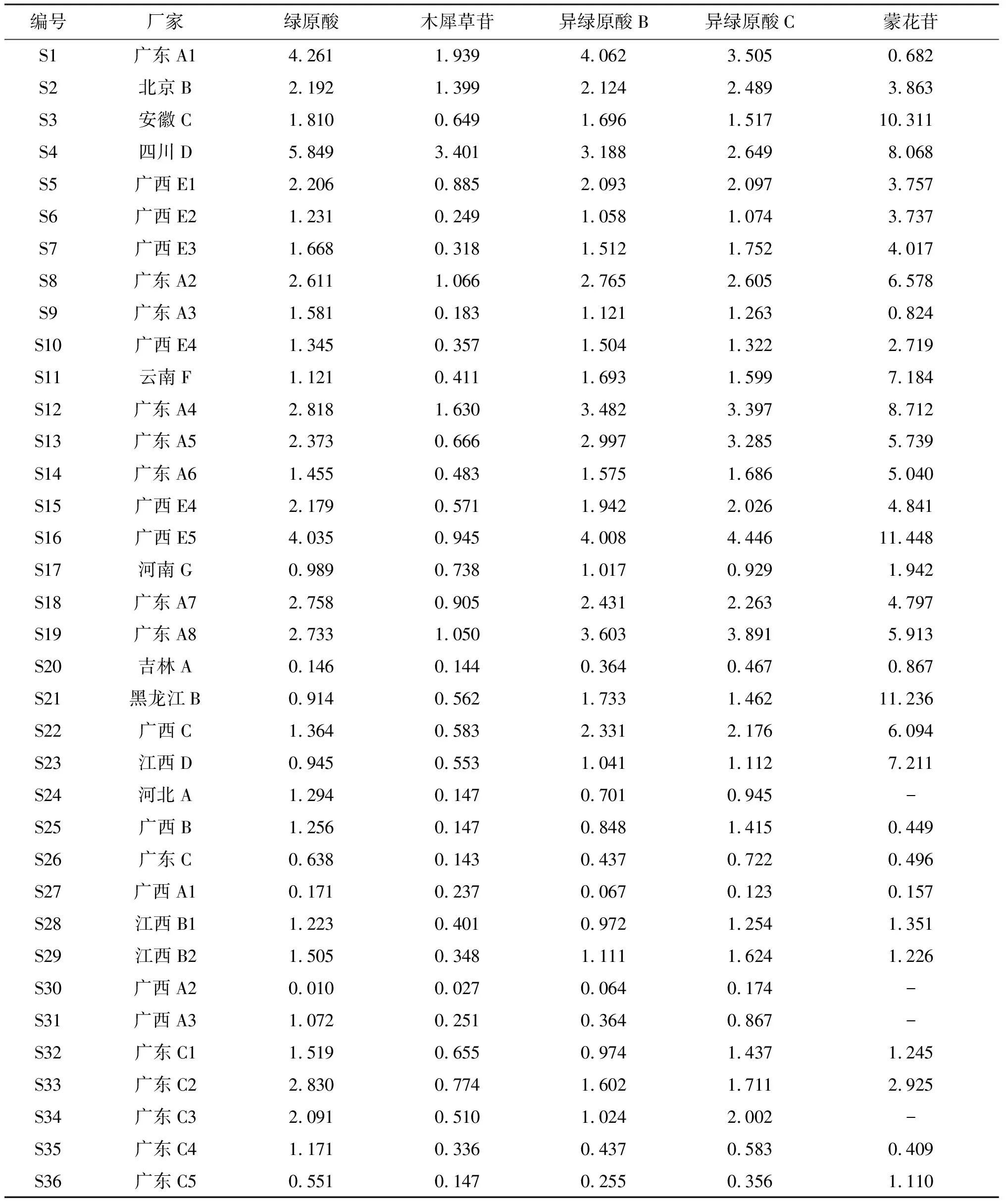
编号厂家绿原酸木犀草苷异绿原酸B异绿原酸C蒙花苷S1广东A14.2611.9394.0623.5050.682S2北京B2.1921.3992.1242.4893.863S3安徽C1.8100.6491.6961.51710.311S4四川D5.8493.4013.1882.6498.068S5广西E12.2060.8852.0932.0973.757S6广西E21.2310.2491.0581.0743.737S7广西E31.6680.3181.5121.7524.017S8广东A22.6111.0662.7652.6056.578S9广东A31.5810.1831.1211.2630.824S10广西E41.3450.3571.5041.3222.719S11云南F1.1210.4111.6931.5997.184S12广东A42.8181.6303.4823.3978.712S13广东A52.3730.6662.9973.2855.739S14广东A61.4550.4831.5751.6865.040S15广西E42.1790.5711.9422.0264.841S16广西E54.0350.9454.0084.44611.448S17河南G0.9890.7381.0170.9291.942S18广东A72.7580.9052.4312.2634.797S19广东A82.7331.0503.6033.8915.913S20吉林A0.146 0.144 0.364 0.467 0.867 S21黑龙江B0.914 0.562 1.733 1.462 11.236 S22广西C1.364 0.583 2.331 2.176 6.094 S23江西D0.945 0.553 1.041 1.112 7.211 S24河北A1.294 0.147 0.701 0.945 - S25广西B1.256 0.147 0.848 1.415 0.449 S26广东C0.638 0.143 0.437 0.722 0.496 S27广西A10.1710.2370.0670.1230.157S28江西B11.2230.4010.9721.2541.351S29江西B21.5050.3481.1111.6241.226S30广西A20.0100.0270.0640.174-S31广西A31.0720.2510.3640.867-S32广东C11.5190.6550.9741.4371.245S33广东C22.8300.7741.6021.7112.925S34广东C32.0910.5101.0242.002-S35广东C41.1710.3360.4370.5830.409S36广东C50.5510.1470.2550.3561.110
2.6 基于TOPSIS法的不同批次间感冒灵制剂质量评价
TOPSIS法又称为逼近理想解排序法、理想点法[9-10],是一种理想目标相似性的顺序选优技术,已在医药领域有广泛应用[11-12]。因这4种产品3类剂型的处方原料不相同,其处方剂量也不同,以制剂共有的中药原料野菊花为例,颗粒剂和胶囊剂中所含野菊花的生药量分别为2.46 g/袋和1.23 g/粒,片剂和颗粒剂(复方)所含野菊花的生药量分别为0.781 g/片和3.1 g/袋,故药材所含成分的质量分数实际有较大偏差。将其换算成每日服用量后,3种剂型所含野菊花的生药用量则较为相近。
为体现制剂整体临床疗效,本试验以36批样品中每日服用量所含5种化学成分的质量分数为指标,首先建立规范化矩阵,对矩阵数据进行无量纲化处理得到规格化向量[13]。由于该制剂现行标准尚未涉及中药各成分,且无明确的中药药效成分,多认为多组分协同起效,故定义此5种成分的权重值均等,进而可以得到加权后的规格化值。根据矩阵确立正理想解(最优值)和负理想解(最劣值),计算评价对象即各批样品与正负理想解的欧氏距离,以样品指标和正理想解的相对接近程度Ci值来评价各批样品的质量优劣。Ci值越接近1,则认为质量越好[14]。见表4。
结果显示,3类剂型由于涵盖2种原料处方,且处方剂量也不同,综合评价值Ci呈现出较大的差异。为排除处方不同的影响,进一步对同一原料处方进行分析评价,发现不同生产厂家之间整体差异减小,从颗粒剂和胶囊剂制剂产品来看,以S4批次样品质量最好;从片剂和颗粒剂复方制剂来看,以S33批次样品质量最好。此外,同一处方同一剂型内不同厂家生产的感冒灵产品质量良莠不齐,或少部分批次评价结果明显较差,其原因可能与中药材的来源、品质差异及制剂成型制备工艺的选择等有关。
3 讨论
3.1 色谱条件的建立
本实验在流动相的选择上,考察了甲醇-水、甲醇-0.1%(体积分数,下同)醋酸、甲醇-0.1%H3PO4、乙腈-水、乙腈-0.1%醋酸、乙腈-0.1%H3PO4等不同系统流动相对供试品溶液各成分分离的影响。通过对比色谱图,以乙腈-H3PO4为流动相效果最好,而乙腈-0.1%H3PO4和乙腈-0.2%H3PO4无明显差别,为了减少对色谱柱的损伤,选择H3PO4体积分数低的洗脱系统。实验中所采用的二极管阵列检测器,可以同时检测样品在所有波长的吸收情况,通过对样品进行全波长扫描,对各波长下的光谱图基于光谱吸收、文献比对和化合物极性等分析,得到蒙花苷的最大吸收波长为334 nm,木犀草苷的最大吸收波长为350 nm,绿原酸、异绿原酸B、异绿原酸C的最大吸收波长为327 nm。三处波长基线平稳、色谱图峰形好、各成分均达到有效分离,故选择327、334、350 nm作为检测波长,以充分反映感冒灵制剂中药组分信息和实际质量分数。

表4 感冒灵制剂的TOPSIS分析结果Table 4 TOPSIS Results of Ganmaoling preparations
Ci*为颗粒剂与胶囊剂两者比较,Ci**为片剂与颗粒剂(复方)两者比较。
3.2 供试品溶液制备条件的优化
对供试品的制备条件进行优化,通过比较不同超声处理时间(10、20、30、40、60 min)对色谱峰结果的影响发现,随着超声时间的延长,各色谱峰峰面积有所增加,30 min以后峰面积差异缩小,故确定超声时间为30 min。采用甲醇作为提取溶剂,色谱峰型较好,相比水或乙醇作溶剂提取杂质少。
3.3 数据分析
感冒灵制剂是常用的中西药复方制剂,西药成分的高质量分数与中药成分的低质量分数是导致该制剂整体质量难控制的主要原因。本着多种成分兼顾、多个剂型统一标准、多种方法共同分析的整合理念,本试验对不同批次感冒灵颗粒、感冒灵胶囊、复方感冒灵颗粒、复方感冒灵片4类制剂中的绿原酸、木犀草苷、异绿原酸B、异绿原酸C、蒙花苷进行了测定和化学计量分析。按照每天所服用的制剂中所含有的药材量计算,通过对比发现,同一剂型内各批次所含5种化学成分质量分数的差异不大,均以蒙花苷和绿原酸2种成分质量分数居高;而不同剂型各成分质量分数差异较大。以复方感冒灵片剂和复方感冒灵颗粒剂为例,由于该复方制剂处方中同时含有野菊花和金银花,所以片剂和复方颗粒剂所含绿原酸类成分质量分数理论上应大于颗粒剂和胶囊剂,但实际上并没有。这可能是组方原料不同与每日服用量差异所导致,复方片剂虽原料生药量大于颗粒剂,但其每日服用量却小于颗粒剂。
因此,为了更科学地评价不同剂型,统一采用能体现药品临床疗效和实际用途的每日服用量为指标进行TOPSIS分析。结果显示,同一原料处方条件下,不同生产厂家或不同批次感冒灵产品质量良莠不齐。为更好地控制该制剂整体质量,必须保证中药原料的均一性和道地性,确保临床合理用药。
本研究建立了感冒灵制剂整体质量评价模型,以多个指标对感冒灵产品进行了质量评价,符合中药多组分协同的整体观念。TOPSIS法用于多指标决策分析,将多个指标简化成一个综合评价值,提高了分析的科学准确性,实现了对感冒灵制剂整体质量的控制。
