增生性瘢痕的形成机制及丹参治疗的研究进展
2019-11-09赖建辉许小琪时军郭思旖
赖建辉,许小琪,时军,2,郭思旖
(1.广东药科大学中药学院,广东 广州 510006; 2.广东省局部精准递药制剂工程技术研究中心,广东 广州 510006)
增生性瘢痕(hypertrophic scars,HS),又称隆起性瘢痕、肥大性瘢痕或肥厚性瘢痕,是皮肤组织在创伤、炎症、手术和烧伤后过度修复而引起的病变。临床症状表现为不规则隆起、充血发红、质地坚韧的斑块,常伴有痒痛不适,严重者可致畸形、毁容或者其他生理功能障碍[1]。
HS形成因素多样,但组织学原因主要为人成纤维细胞(HSF)增殖和以胶原为主的细胞外基质(ECM)过度沉积,其内在信号通路改变与HS形成密切相关。HS的治疗是临床工作面临的治疗难点,现常采用手术切除、激光治疗、类固醇药物注射、硅凝胶治疗、放射治疗、5-氟尿嘧啶注射等手段,这些方法虽取得了一定疗效,但也存在各自的不足,因此至今尚无理想的治疗方法[2]。近年来,在中药或中药提取药物治疗HS的研究方面取得了一定的进展,本文从HS的形成机制入手,综述丹参治疗HS的研究进展。
1 HS的形成机制
皮肤损伤后,在组织学上HS的特征表现为高密度血管新生、大量炎症细胞浸润、大量HSF和人肌成纤维细胞(HMF)持续存在以及ECM过度积聚[3-4]。
研究发现,TGF-β、PDGF、IL-1等多种生长因子和炎症因子参与组织修复过程,并对HS的形成有着重要的调控作用,主要有以下方面[4-6]:(1)趋化炎症细胞聚集,加强炎症反应,延长伤口再上皮化时间;(2)促进HSF增殖活化和胶原蛋白合成分泌;(3)诱导HSF向HMF转化,进一步增加胶原蛋白、纤维黏连蛋白、α-平滑肌肌动蛋白(α-SMA)等基质的合成,促进了ECM的沉积;(4)抑制HSF、HMF等细胞的凋亡;(5)影响基质金属蛋白酶(MMPs)及金属蛋白酶组织抑制剂(TIMPs)的正常表达,导致新胶原蛋白合成速率超过其降解速率,引起以胶原为主的ECM在真皮下过度沉积;这些过度积聚和收缩的ECM难以被机体吸收或重塑,与HSF、HMF等细胞相互连结而进一步形成致密的纤维化结缔组织。伤口愈合后,致密的结缔组织取代实质组织,并阻碍创面恢复正常结构和功能,使得伤口部位皮肤表面升高和硬度增加,最终导致瘢痕增生,如图1所示。
1.1 细胞生长因子的调控
生长因子是HS发展的关键调节因子,它们通过多条信号通路传导交叉反应,对HS的形成有正向或者反向调控作用。如TGF-β1、PDGF等促纤维化生长因子能直接或间接促进HSF增殖和转化、抑制细胞凋亡、产生过量的胶原蛋白而造成ECM沉积;而bFGF等生长因子可通过降低HSF活性以及增加胶原酶合成分泌等途径发挥抗纤维化作用。
1.1.1 转化生长因子-β
转化生长因子-β(transforming growth factor-β,TGF-β),广泛存在于各种细胞组织,参与伤口愈合的所有过程。TGF-β是一大类具有复杂生物学特性的超蛋白家族,是目前已知与HS关系最密切的细胞因子,在哺乳动物中发现有TGF-β1、TGF-β2、TGF-β33种亚型表达,每种亚型有不同的功能和生理活性。研究证实,HS的形成与TGF-β 3种亚型的综合调控有关[8],其中TGF-β1和TGF-β2生物活性相同,参与瘢痕形成,是促进ECM过度沉积的最密切的正性调控因子之一;TGF-β3具有抗纤维化作用,可通过竞争性的与TGF-β膜受体结合,部分阻断或下调TGF-β1、TGF-β2活性或表达,从而抑制其对HS形成的诱导作用[9]。如表1所示。

图1 HS的形成机制[7]Figure 1 Formation mechanism of HS
1.1.2 血管内皮生长因子
局部微血管的异常增生是造成HS形成的重要因素之一。血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前所知最强的促血管生成细胞生长因子,在血管形成、促进创伤愈合、组织修复及再生等方面起着十分重要的作用。研究发现,VEGF在HS中大量表达,且其表达量和HS血管增生程度及瘢痕成熟程度密切相关[18]。
VEGF通过与血管内皮生长因子受体-2(VEGFR-2)结合,将胞外的信号传递到胞内,发挥生物学效应,激活NF-κB、PI3K/AKT/mTOR等信号通路调控血管内皮细胞增殖,促进新生血管的形成[19]。HS成纤维细胞增殖及分泌胶原需要大量的氧气及营养支持,VEGF促进血管新生可以运输氧气和营养物质,间接促进瘢痕进一步增生[20];另一方面,过量VEGF表达导致血管内皮细胞过度生长,突入管腔而造成阻塞,加上肌成纤维细胞的收缩功能影响,加剧了血管的阻塞而引起局部低氧[21]。缺氧环境下,成纤维细胞的增殖能力及其合成分泌功能均得到增强,同时缺氧部位会产生并积聚缺氧诱因子-1α(HIF-1α)。当HIF-1α与VEGF基因中的缺氧反应元件结合后,可上调VEGF表达,从而加重血管阻塞,导致缺氧反复循环,最终促进病理性瘢痕形成[22]。Xu等[23]研究证实了缺氧条件下,HIF-1α上调TGF-β1和Smad2/3/4的表达,增强TGF-β1/SMAD信号传导,从而促进胶原合成及沉积。
除此之外,有研究表明,血管内皮生长因子可直接影响HS的组织细胞行为。Harold等[24]发现,VEGF可刺激体外培养的HSF发生迁移,从而揭示VEGF对伤口修复的非血管生成作用,即趋化HSF在损伤部位聚集,并刺激胶原分泌与沉积,从而有效地促进肉芽组织成熟和伤口的闭合。但当VEGF作用过强时,会导致伤口的肉芽组织中HSF密度以及胶原含量过高,造成组织纤维化。因此,抑制VEGF及其受体过表达对HS的防治有重要意义。
1.1.3 血小板生长因子
血小板生长因子(platelet derived growth factor,PDGF)主要由创伤部位的血小板和巨噬细胞合成并释放,是体内一种主要的促有丝分裂剂和化学引诱剂,可以刺激HSF、血管平滑肌细胞等细胞的分裂和增殖;同时也是炎症细胞趋化因子,能诱使巨噬细胞聚集并释放大量的炎症因子及包括 TGF-β、PDGF等众多生长因子,在创面修复及HS的发病过程中起着重要的作用[25-26]。
PDGF主要由PDGF-A、B、C及D这4 种亚型组成,并可形成5种二聚体形式,即 PDGF-AA、AB、BB、CC和DD[25]。不同的PDGF二聚体均有促细胞有丝分裂的作用,但其作用活性有强弱之分。其中,PDGF-AA作用最弱,相关研究表明,PDGF-CC对大鼠肾成纤维细胞的促分裂作用为PDGF-AA作用效果的20倍;而PDGF-BB促纤维化的能力最强,可参与血管新生、炎症反应、受体表达、信号通路激活、胶原代谢等途径的调控[27],因此是HS中研究最多的亚型,见表2。PDGF调控作用过强能造成组织纤维化,促进瘢痕增生,现已成为治疗纤维化疾病的重要靶点,降低其作用活性是减轻HS形成的有效手段。
1.1.4 其他生长因子
已被证实能调控HS形成的生长因子还有:结缔组织生长因子(CTGF)、表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)等。这些生长因子由于表达抑制或是过表达,通过不同的信号通路途径,在不同程度上刺激HSF的增殖和转化以及影响胶原的正常代谢,最终导致HS形成,见表3。
1.2 炎症因子的调控
创面的修复首先表现为局部炎症反应。当皮肤受到一定程度的损伤时,早期炎症级联反应被激活,血小板和受损的皮肤驻留细胞释放TGF-β、PDGF、EGF等一系列生长因子,趋化中性粒细胞、巨噬细胞、肥大细胞等炎症细胞向伤口处聚集。这些渗透的炎症细胞可释放更多的生长因子和炎症因子,不仅促进清除坏死组织和异物,而且同时启动和调控创面修复进程[37]。适度的炎症有利于伤口愈合,但是过强的炎症反应却会导致不良结果,研究发现,与正常瘢痕形成相比,HS中存在增强且持续的炎症期,其特征在于更多的炎性细胞募集以及生长因子和炎症因子在创面局部高度蓄积[38]。研究较多的有肿瘤坏死因子(TNF-α)、白细胞介素类(IL-1、IL-4、IL-6等)、干扰素-γ(INF-γ)等,这些因子在组织纤维化过程中有着各自的生物学效应[1,37-41],见表4。
2 丹参抗HS机制
中医学认为HS属瘀证,其成因与先天因素或金刀所伤、水火烫伤、余毒未净及受外邪入侵肌肤而引起的气血壅滞、经络痹阻、湿热搏结等有关,治疗以理气活血、软坚散结、除湿化瘀为主[42]。丹参为活血祛瘀、凉血消痈的代表中药,现代药理学研究证实,其有减轻缺血再灌注损伤、抗心律失常、抗动脉粥样硬化、抗肿瘤、抗氧化、抗炎、抗纤维化等作用[43]。其代表性成分丹参酮ⅡA、丹酚酸B和丹参素除了应用于心血管系统,如保护心肌、扩张血管、抗血栓等之外,在抗纤维化方面亦有显著药理活性,能有效抑制病理性瘢痕的发生发展。如表5所示。
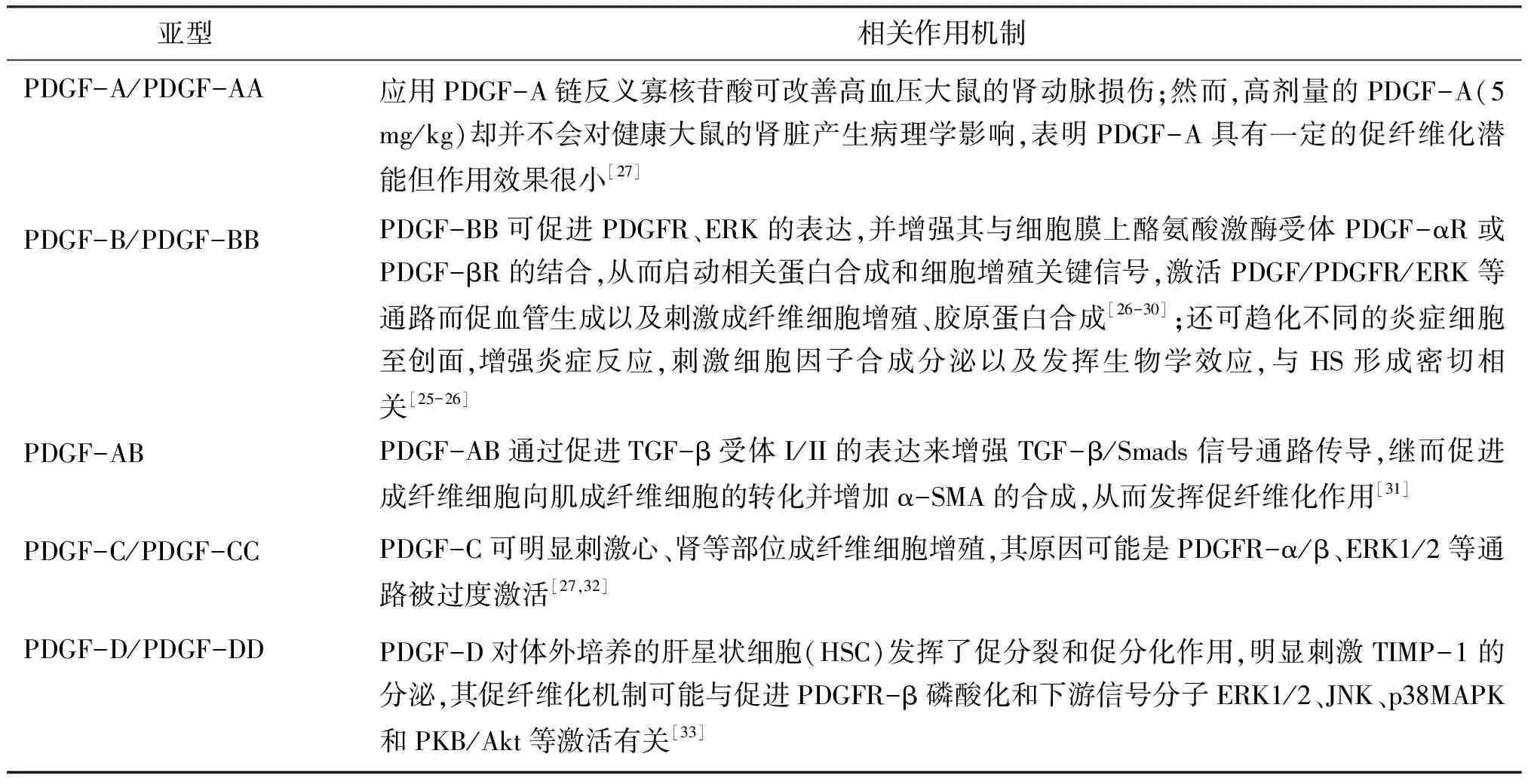
表2 PDGF的调控作用Table 2 Regulation of PDGF

表3 其他生长因子的调控作用Table 3 Regulation of other growth factors

表4 炎症因子的调控作用Table 4 Regulation of inflammatory factors

表5 丹参及相关制剂的抗纤维化作用Table 5 Anti-fibrosis effects of Salvia miltiorrhiza and related preparations
2.1 丹参酮ⅡA
丹参酮 ⅡA是丹参中的脂溶性有效成分,具有抗急性缺氧、抗心律失常、抗动脉粥样硬化、抗炎、抗肿瘤等广泛药理作用。而在抗纤维化方面,已有实验证明丹参酮ⅡA具有抗HS作用,其作用机制与抑制成纤维细胞增殖、诱导细胞凋亡和促进胶原降解有关。
陈刚等[48]发现,丹参酮ⅡA能有效阻滞体外培养的成纤维细胞的细胞周期,使其停留在G0/G1期,从而抑制其增殖活性并诱导凋亡;在对胶原的作用方面,蒙晓等[49]证明丹参酮ⅡA能下调大鼠成纤维细胞中纤溶酶原激活剂抑制剂-1(PAI-1)和炎症相关的环氧酶-2(COX-2)的表达,促进胶原降解,减轻瘢痕;在动物体内的研究也证实了丹参酮ⅡA能够通过增强MMP-1mRNA的表达及抑制成纤维细胞的增殖,减少胶原纤维的合成,从而抑制瘢痕的过度增生[50]。HSF、HMF等细胞的过度增殖以及凋亡受阻,产生大量ECM成分聚集在真皮下,导致伤口部位硬度增加,直接导致了瘢痕增生。这些发现为丹参酮ⅡA通过促进胶原降低、减轻组织纤维化而治疗HS提供理论依据。
2.2 丹酚酸B
丹酚酸B(SAB)是丹参中含量最高的水溶性成分,具有明显抗纤维化作用。现代研究表明,SAB抗纤维化的作用机制可能与其抗自由基过氧化损伤、抑制成纤维细胞增殖、作用于TGF/Smads等多个信号转导通路、下调细胞Ⅲ型胶原蛋白(COL-Ⅲ)等细胞因子的表达有关。在细胞、分子、基因等多个水平上抑制纤维化疾病的形成,作用于纤维化发病机制中多个环节从而发挥综合的抑制作用[7]。
SAB促细胞凋亡作用与丹参酮ⅡA作用类似。Shi等[51]对体外培养的 HSF细胞进行研究发现,SAB能够体外抑制HSF的增殖活性,通过将HSF细胞分裂周期阻滞于G0/G1期,进而诱导细胞凋亡,并且还具有抑制HSF的侵袭和迁移的能力,作用效果上呈现剂量和时间依赖性。Liu等[52]对SAB的抗皮肤纤维化机制做了更深入研究,实验结果发现,SAB对体外培养的皮肤成纤维细胞的增殖有显著抑制作用,能下调细胞外基质基因转录和胶原蛋白表达,在SAB处理的成纤维细胞中,TGF-β/Smad和MAPK/ERK途径的激活也被抑制;而通过对患者的皮肤成纤维细胞进行RNA序列检测,结果表明SAB还存在其他可能的抗纤维化途径,包括氧化应激抑制、细胞周期抑制和p53信号通路抑制。
2.3 丹参素
丹参素是丹参的水溶性成分,具有改善心血管、修复神经组织、保护肝脏和抗纤维化等作用。到目前为止,丹参素抗纤维化功能的研究多集中在肺部和肝脏,而鲜有治疗皮肤纤维化疾病的相关报道。HS的病理本质是HSF为主的效应细胞过度增殖和以胶原为主的ECM过度沉积的结果,肝、肺、肾等内脏及其他组织纤维化疾病在病理上同样也表现为大量ECM无序沉积,与皮肤HS产生的机制类似[43]。
TGF-β1是最重要的纤维化调控因子,TGF-β1mRNA纤维化组织中往往有高表达。秦静等[53]研究发现,经丹参素处理后,肺纤维化大鼠肺部TGF-β1、Smad3mRNA、α-SMA 表达明显减少,Smad7mRNA表达增多,其中Smad3促进纤维化的形成,Smad7是TGF-β1信号转导途径的主要抑制性蛋白,这表明了丹参素通过抑制TGF-β1/Smads 信号通路,而发挥抗肺纤维化作用。肝星状细胞(HSC)是肝纤维化发病的关键细胞,其功能过强可导致ECM的异常表达。Peng等[54]发现丹参素可通过靶向抑制PI3K/AKT/mTOR/p70S6K1信号传导途径,降低HSC活性并诱导细胞凋亡,还可以通过抑制炎症基因的表达来减轻炎症反应,从而发挥抗肝纤维化作用。综上可知,丹参素对胶原、α-SMA蛋白等ECM的合成有明显的抑制效应,其抗纤维化机制同样适用于HS的治疗。
3 结语
综上所述,生长因子、炎症因子的调控作用贯穿于皮肤创伤修复的全过程,上述调控的平衡趋势被打破时,相关信号通路会发生改变,从而引起持续的炎症反应、亢进的细胞修复功能等一系列促纤维化反应,主要表现为HSF过度增殖分化以及ECM在真皮过度沉积,这些因素最终导致HS的形成。另外,表皮在再上皮化延迟、血管过度增生和毛细血管阻塞等也在不同性质上参与了HS的形成。因此,在HS防治方面,可从减轻炎症反应、减少血管新生和抗纤维化等方向制定策略。中药丹参中的活性成分丹参酮ⅡA、丹参素、丹酚酸B等能通过介导多条信号通路抑制HSF增殖分化和促进ECM降解,发挥抗纤维化作用,提示丹参在治疗HS上有着多靶点、综合治疗的优势。后续结合网络药理学等手段,进一步阐明丹参防治HS的分子作用机制,以期为丹参治疗HS提供科学依据。
